山东地区10株H9N2亚型禽流感病毒HA和NA基因的遗传演化分析
2018-09-10王友令袁小远张玉霞徐怀英亓丽红宋敏训
王友令,袁小远,孟 凯,张玉霞,徐怀英,李 莉,亓丽红,宋敏训,艾 武
(山东省农业科学院家禽研究所,济南 250100)
禽流感是由A型禽流感病毒(Avian influenza virus,AIV)引发的具有高度接触传染性的病毒病。众所周知,可以导致养禽业的巨大经济损失,同时还严重影响人类公共卫生安全,其危害性不容小视[1]。禽类感染AIV后,症状可表现为呼吸道感染、蛋鸡产蛋量下降明显,最后部分病禽表现为急性全身致死性感染死亡[2]。H9亚型AIV的死亡率低,但可造成免疫抑制和产蛋量下降,引起养禽业巨大的经济损失。
H9N2亚型AIV目前已呈世界性分布,根据分布不同可分为北美和欧亚两个种系[3]。我国于1994年首次公开报道该病的出现[4]。AIV的HA蛋白是A型流感病毒致病性的主要影响因子[5,6];NA蛋白则能识别受体唾液酸残基并介导病毒进入细胞[7]。为了解 2016年山东地区 H9N2 亚型AIV的HA和NA 基因的变异和重组情况,我们选取分离的10株代表性分离株,对其HA和NA基因进行测序,分析其关键位点是否发生变化,探讨基因遗传演化规律,为山东地区H9N2 AIV的防控提供理论依据。
1 材料和方法
1.1 毒株 10株 H9N2亚型AIV流行株由山东省农业科学院家禽研究所分离鉴定保存,方法参照文献[1]。10株毒株依次为A/CK/SD/XT31/2016/H9N2、A/CK/SD/XT33/2016/H9N2、A/CK/SD/XT34/2016/H9N2、A/CK/SD/XT35/2016/H9N2、A/CK/SD/XT39/2016/H9N2、A/CK/SD/XT43/2016/H9N2、A/CK/SD/XT44/2016/H9N2、A/CK/SD/XT46/2016/H9N2、A/CK/SD/MHS3/2016/H9N2、A/CK/SD/MHS5/2016/H9N2。
1.2 鸡胚试剂 SPF鸡(胚)由山东省农业科学院家禽研究所SPF鸡研究中心提供。分子生物学试剂均购自大连宝生物有限公司。
1.3 引物合成 利用Oligo6.0软件设计了2对引物,由华大基因公司合成,用于扩增HA、NA基因全长序列,预期扩增的HA、NA基因大小为1687 bp、1402 bp。

表1 扩增所用引物Table 1 The primers for amplification
1.4 病毒RNA的提取及RT-PCR扩增、序列测定 按照Trizol试剂盒说明书提取病毒RNA,RT-PCR扩增、PCR产物连接克隆、序列测定按照文献[7]进行。
1.5 遗传进化分析 10株分离毒株和GenBank上已发表的8株H9N2 AIV的HA、NA基因序列(毒株具体信息及登录号详见表2),用MEGA5.0 分别进行遗传演化分析,绘制系统进化发育树。

表2 参考毒株的基本信息Table 2 The information of H9N2 AIV strains
2 结果
2.1 HA基因的分子特征、同源性和遗传分析 10株H9N2分离株与参考毒株的HA氨基酸序列进行遗传演化分析,绘制的进化树见图1。从进化树可以看出,所有毒株分属为3大分支:BJ94、Y439、G1。10株分离的AIV遗传距离很近,都属于BJ94大分支的G57小分支。10个分离株与BJ94参考毒株HA核苷酸同源性为89.1%~91.3%,氨基酸同源性为90.0%~93.4%;而10株分离株间的HA核苷酸同源性为94.1%~99.8%,氨基酸序列同源性为94.3%~100%。
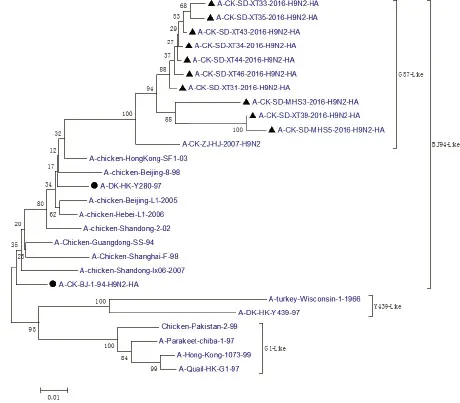
图1 HN基因遗传进化树Fig.1 Phylogenetic tree of HA genes of isolated AIVs
所有分离株的HA裂解位点均为RSSR↓GLF,为弱毒株的序列特征。同时,分离毒株有6~8个潜在的糖基化位点,其中XT39毒株在218~220位和313~315位出现糖基化位点双缺失。10株分离株191位的构成HA唾液酸受体结合位点的氨基酸为N(天冬酰胺),与经典的禽流感国内分离株的特征一致,非常保守。10株分离株中有3株在198位上变异为A(丙氨酸),6株变异为T(苏氨酸),1株变异为M(甲硫氨酸)。10株分离毒在234位受体结合位点均为L(亮氨酸),也就是具有了与哺乳动物唾液酸α,2-6受体结合的特征。从进化树分析可知,10个分离株同属于欧亚分支中的A/Chicken/Beijing/1/1994亚群,与近年在中国的鸡群中流行的由A/Chicken/Zhejiang/HJ/2007为代表的新的基因型(G57分支)遗传关系最近[8],推测是由其进化演变而来。
2.2 NA 基因同源性和遗传分析 NA氨基酸序列进化树如图2。从进化树可以看出,所有毒株分属为3大分支:Y280、Y439、G1。10株分离毒株遗传距离很近,都属于Y280大分支的G57小分支。2007 年以来的 H9N2 毒株的NA 基因有相近的同源性关系。10个分离株与近年在中国的鸡群中流行的G57分支遗传关系最近。
所有分离株之间NA核苷酸序列同源性为94.9%~100%,氨基酸的同源性为94.2%~100%;此外,10个分离株与G57分支的NA核苷酸同源性为93.4%~94.4%,氨基酸的同源性为92.7%~94.4%。
分析特殊位点可知,分离的AIV的 NA茎部有不同长度氨基酸的缺失,即颈部均有9个核苷酸(3个氨基酸)的缺失。此外,血凝素结合HB位点第367均为赖氨酸(K);而368 位,1株为天冬氨酸(D),其余均为天冬酰胺(N);369位均为甘氨酸(G)。
3 讨论
AIV的HA 蛋白是病原致病性和毒力的主要影响因子,尤其是HA裂解位点氨基酸序列是毒力的决定要素之一。本研究中10个毒株HA基因裂解位点氨基酸序列为RSSR↓GLF,也就是非多个连续碱性氨基酸,因此具有低致病性病毒分子特征。已发现流感病毒表面血凝素 HA蛋白上第226 位氨基酸是关键的受体结合位点,与病毒的受体结合特性和宿主特性相关[8]。本研究中10个毒株的HA受体结合位点只有第149、198、234位氨基酸存在变异。10株分离株中有3株在198位上变异为A(丙氨酸),6株变异为T(苏氨酸),1株变异为M(甲硫氨酸)3种形式。另外有9株病毒在313位氨基酸处出现了一个新的潜在的糖基化位点,这一新糖基化位点出现是否参与病毒的感染尚未知。
NA 能识别受体唾液酸残基并介导病毒进入细胞,NA存在6个潜在的糖基化位点[9]。近年来,国内陆续分离到NA上糖基化位点缺失或突变的毒株,但是氨基酸缺失或突变是否影响NA功能未知。
Sun等[10]发现,同一时期不同地区H9N2病毒株之间同源性较高;不同的是,较早期病毒均有不同程度的变异和进化。杨婧等[11]发现,H9N2 HA和NA基因的变异情况与地域无相关性,但是与时间有部分的相关性。本研究中,从进化树分析可知,10株H9N2分离毒 HA 和 NA 基因呈现出相近的同源性关系。

图2 分离毒株的NA氨基酸进化树Fig.2 Phylogenetic tree of NA of isolated AIVs
H9N2 AIV对公共安全也有潜在威胁。2003年香港出现的感染人类的H9N2禽流感毒株HA蛋白的226位为L,而从家禽体内分离的毒株为谷氨酸(Q)[12]。本研究10株 H9N2 AIV HA蛋白的226 位为L,呈现出典型的人流感受体结合特性。因此,我们需要加强重视低致病性AIV的潜在风险,避免其产生严重的公共危害。
