表达Renilla Luciferase重组流感病毒的构建及生物学特性研究
2018-09-10任超超周洁文闫丽萍李泽君
宿 鑫,任超超,周洁文,闫丽萍,2,李泽君
(1.中国农业科学院上海兽医研究所,上海200241;2.南京农业大学,南京210095)
流行性感冒病毒(Influenza virus)简称流感病毒,是一种人畜共患传染病的病原[1,2]。流感病毒在分类学上属于正粘病毒科,为单股、负链、分节段的RNA病毒。流感病毒根据其蛋白的抗原性被分为4个型:A型、B型、C型和D型;根据感染对象的不同,流感病毒还可分为人流感病毒、禽流感病毒、猪流感病毒等类群[3,4]。据美国科学技术委员会调查表明,近年来美国每年死于流感的人数为2~4万,并且每年用于治疗流感的费用及流感引起的劳动力损失超过了1.2亿美元。即使在非流感大流行期间,全球季节性流感每年也会引起300万~500万的严重病例,并导致30万~50万人死亡[5,6]。流感病毒的不断变异与传播严重危害着人们的生命财产安全,面对流感病毒的威胁我们必须时刻提高警惕,做好预防措施。目前应对流感病毒感染的主要措施为疫苗接种和药物治疗[6,7],虽然预防流感病毒的疫苗不断更新,但是因为生产条件和技术的限制,疫苗的生产往往需要耗费几个月的时间,在应用上具有明显的滞后性;而抗流感病毒药物的使用对于疫情的控制虽然起到非常重要的作用。但长时间使用同种抗流感病毒药物,可使流感病毒对药物产生抗药性,因此新型抗流感药物的筛选显得极为重要[8]。现有的抗流感药物筛选方法耗时长,工作量大,因此建立新的筛选方法极为迫切。
本研究构建了1株可以表达Renilla Luciferase的重组流感病毒[9],并利用Luciferase报告基因系统[10]对其生物学特性进行了研究,检测到的Luciferase的表达量与病毒复制生长情况是一致的,因此本研究构建的病毒可以用于抗流感药物的高通量筛选。
1 材料方法
1.1 材料
1.1.1 质粒与细胞 HA-Renilla-HA质粒和表达HA蛋白的MDCK-HA2细胞系由上海兽医研究所动物流感病原生态学创新团队构建;PR8病毒反向操作系统和MDCK细胞由上海兽医研究所动物流感病原生态学创新团队保存。
1.1.2 主要试剂 Renilla Luciferase Assay System试剂盒购自TaKaRa 公司;SFM(serum free medium,无血清培养基)购自赛默飞世尔生物化学制品有限公司;胎牛血清购自上海玉博生物科技有限公司。
1.2 方法
1.2.1 重组流感病毒的拯救 将293T细胞传代培养在直径3.5 cm的无菌小平皿中,待细胞长至70%~80%时,进行转染。具体步骤如下:向2个无菌的1.5 mL的EP管中分别加入250 μL的Opti-MEM培养液。HARenilla-HA质粒与PR8病毒株PB1、PB2、PA、NP、NA、NS和M基因的7种质粒,分别以1.0 μg的量加入其中1个EP管中,混匀。向另1含有250μL Opti-MEM EP管中加入24 μL TransIT-293转染试剂,混合并作用5 min。将2个EP管中液体轻柔混合,静置30 min,静置期间用opti-MEM洗细胞2次,动作要轻柔。静置完毕将混合液轻轻加入到293T细胞并补加溶液至2 mL。转染完的平皿置于37℃细胞培养箱中培养48 h,然后向细胞上清加入2 μL的TPCK胰酶,作用2 h后将细胞吹散混匀,将细胞悬液接种9~11日龄SPF鸡胚(0.5 mL/枚),37℃孵化器孵育48 h后测定血凝效价。
1.2.2 重组病毒半数组织感染量(tissue culture infective dose,TCID50)的测定 首先将MDCK-HA2细胞按照104/孔铺至96孔板。等细胞长至80%左右时,用无菌PBS洗2次;将毒株用SFM进行10倍系列稀释,稀释好的病毒按照0.1 mL/孔接种细胞,37℃孵育2 h;弃去上清,用无菌PBS洗3遍,加入DMEM细胞维持液500 μL;将96孔板放置在37℃、5%CO2恒温培养箱,48 h后观察细胞病变,根据Reed-Muench方法计算TCID50。
1.2.3 Luciferase报告基因系统稳定性的研究 为了评估Luciferase报告基因系统的稳定性,将重组流感病毒在MDCK-HA2细胞上进行连续传代,在传代过程中,用Luciferase报告基因系统检测Renilla Luciferase的表达量。Renilla Luciferase的测定方法:用无菌PBS将5×裂解液稀释成1×裂解液,稀释完毕后4℃保存备用。在收集细胞上清后的孔内加入无菌PBS洗3遍,每次0.3 mL。洗完后每孔加入65 μL 1×裂解液,覆盖所有细胞,放置摇床上摇动15 min。在细胞裂解的过程中配制1×Renilla Luciferase Assay Reagent,每个样本的上样量为0.1 mL,根据需要量进行配制,震荡混匀后分装,每管0.1 mL。最后在化学发光检测仪上测定Luciferase的活性值。
1.2.4 不同滴度的重组流感病毒生长特性的研究 首先将生长状况良好的MDCK-HA2细胞传至48孔细胞培养板内,待细胞长至80%左右时,弃去培养液,用无菌PBS洗2遍,洗完后在每个细胞孔内加入0.1 mL SFM。将重组流感病毒按照0.1、0.01、0.001、0.0001 MOl的量接种MDCK-HA2细胞,接种量为100 μL/孔。将接种病毒后的细胞放至37℃、5%CO2培养箱孵育2 h,然后弃掉细胞上清,用无菌PBS洗2遍,加入250 μL SFM。在接种病毒后的12、24、36、48 h分别进行Luciferase的活性值的测定。
1.2.5 重组流感病毒在MDCK细胞与MDCK-HA2细胞上生长能力差异的研究 将MDCK与MDCK-HA2细胞传至48孔细胞培养板内,待细胞长至80%左右时,弃去培养液,用无菌PBS洗2遍;将含有0.01 MOI的病毒接种MDCK、MDCK-HA2细胞,接毒量为100 μL/孔。接种后将细胞放至37℃、5%CO2培养箱孵育2 h,然后将上清弃掉,用无菌PBS洗细胞2遍,洗完后加入250 μL SFM。在接毒后的12、24、36、48、60、72 h进行Luciferase的活性值的测定。
1.2.6 不同病毒滴度对磷酸奥司他韦敏感性的研究将磷酸奥司他韦用无菌PBS溶解,溶解后的磷酸奥司他韦用SFM稀释至500 μ mol/L备用。将MDCKHA2细胞铺至48孔板内并分为A、B两组,待细胞长至80%左右时弃去培养液,用无菌PBS洗2遍。A组MDCK-HA2中每孔加入0.1 mL含500 μmol/L 磷酸奥司他韦的SFM,B组细胞内加入等量的SFM,每个浓度作2个重复,37℃孵育15 min。
将病毒液按照1、0.1、0.01、0.001、0.0001、0.000 01 MOI的量接种A组细胞,每个浓度重复2个孔;B组细胞加入等量的SFM,做2个重复孔。37℃、5% CO2培养箱中孵育2 h,孵育后将两组细胞上清弃掉,用无菌PBS洗2遍,洗完后A组加入250 μL含有500 μmol/L磷酸奥司他韦的SFM,B组加入等量不含磷酸奥司他韦的SFM。将细胞放至37℃、5%CO2的培养箱内,分别在8 h和24 h进行Luciferase的活性值的测定。
1.2.7 重组流感病毒对不同浓度的磷酸奥司他韦的敏感性的研究 将磷酸奥司他韦用无菌PBS溶解,溶解后的磷酸奥司他韦用SFM稀释成5000、1000、500、100、50、25、12.5、6.25、3.125 μmol/L,每种浓度配成1 mL溶液备用。待MDCK-HA2细胞长至80%时,弃去培养液,用无菌PBS洗2遍,洗完后加入100 μL含有不同磷酸奥司他韦浓度的SFM,每个浓度做2个重复孔。37℃孵育15 min。对照组分为A、B两组,先分别加入等量的不含磷酸奥司他韦的SFM,37℃孵育15 min;将病毒按照0.01 MOI接种MDCK-HA2细胞(每孔100 μL),A对照组按照0.01 MOI的感染量接种100 μL,B对照组加入等量的SFM,37℃孵育2 h。孵育完毕后,将细胞上清弃掉,并用无菌PBS洗2遍,洗完后每孔加入250 μL含有对应浓度的磷酸奥司他韦,A、B对照组加入等量的不含磷酸奥司他韦的SFM,在接种病毒12 h后进行Luciferase的活性值的测定。
2 结果
2.1 重组流感病毒的拯救 经血凝试验测定,重组病毒的血凝效价为24。
2.2 Luciferase报告基因系统的稳定性 在连续传代过程中运用Luciferase报告基因系统检测到的Luciferase的活性值相对一致,这说明重组病毒可稳定表达Renilla Luciferase,可通过检测Renilla Luciferase活性值来确定病毒复制,结果见图1。
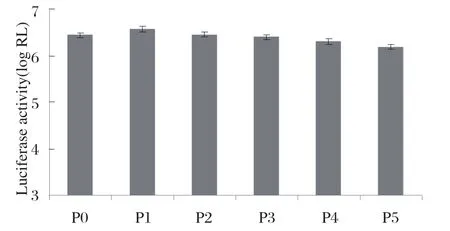
图1 Luciferase报告基因表达稳定性检测Fig.1 Luciferase reporter gene expression stability assay
2.3 重组流感病毒的TCID50的测定 为在后续的实验中能够确定重组病毒的感染量,对该病毒的TCID50进行了测定。将10-1、10-2、10-3、10-4、10-5、10-6稀释的重组病毒,按照0.1 mL/孔接种48孔板上的MDCK-HA2细胞,每日观察并记录细胞病变。根据记录结果,按照Reed-Muench法计算病毒的TCID50。经测定该病毒滴度为105.61TCID50/100 μL。
2.4 重组病毒对MDCK-HA2不同感染量生长曲线的测定 将重组流感病毒按照0.1、0.01、0.001、0.0001 MOI的量接种MDCK-HA2细胞,每孔100 μL。在接毒后的12、24、36、48 h进行Renilla值的测定,将测得的Renilla Luciferase值绘制成生长曲线,结果见图2。

图2 重组流感生长曲线Fig.2 Growth curve of recombinant inf l uenza virus
感染剂量为0.1 MOI时病毒增殖最快复制能力最强,在第6 h测得的Renilla值已经明显高于其他组。感染剂量为0.001、0.0001 MOI时病毒复制能力较弱,而感染剂量为0.01 MOI时病毒生长速度较为适中。因为后续的实验中要进行药物敏感性的检测,病毒的复制能力太强或者太弱对实验结果都有一定的影响,因此将病毒感染量定为0.01 MOI。
2.5 重组流感病毒在MDCK与MDCK-HA2细胞生长曲线的比较 将重组流感病毒以0.01 MOI接种生长状况良好的MDCK、MDCK-HA2细胞,每孔100 μL。在接毒后的12、24、36、48、60、72 h进行Renilla活性值的测定,绘制成生长曲线,结果见图3。

图3 重组流感在MDCK与MDCK-HA2细胞上生长曲线Fig.3 Growth curve of recombinant inf l uenza virus on MDCK and MDCK-HA2 cells
从结果中可以看出重组病毒在MDCK与MDCK-HA2上均能表达Renilla Luciferase,在接种病毒后24 h内表达量基本相同,但接毒后24~60 h,病毒在MDCK-HA2上的表达量明显高于在MDCK细胞。接毒60~72 h Renilla Luciferase表达量开始下降,且在MDCK上的下降速率明显高于在MDCK-HA2。结果表明重组流感病毒利用MDCK-HA2细胞提供的HA基因进行包装、复制,因此MDCK-HA2细胞更适合用于后续研究。
2.6 不同滴度的重组流感病毒对磷酸奥斯他韦敏感性的研究 将磷酸奥司他韦用无菌PBS溶解,用SFM将其稀释成500 μmol/L,按照0.1 mL/孔的量加到细胞孔内,37℃、5% CO2培养箱中孵育15 min,在用药浓度为500 μmol/L的前提下选取不同的病毒滴度进行研究。接毒后8 h和24 h进行Renilla值的测定,结果见图4、5。

图4 不同滴度的重组流感病毒对500 μmol/L磷酸奥司他韦的敏感性(接毒后8 h)Fig.4 Renilla values of the different titers recombinant inf l uenza virus inhibited by 500 μmol/L oseltamivir phosphate for 8 h

图5 不同滴度的重组流感病毒对500 μmol/L磷酸奥司他韦敏感性研究(接毒后24h)Fig.5 Renilla values of the different titers recombinant inf l uenza virus inhibited by oseltamivir phosphate for 24 h for 500 μmol/L
从Luciferase报告基因系统测得的Renilla活性值可以看出,500 μmol/L的磷酸奥斯他韦抑制流感病毒复制后,也同步明显的抑制了重组流感毒株对Renilla Luciferase表达,当感染剂量为0.01 MOI时抑制作用最明显。
2.7 不同浓度磷酸奥司他韦对病毒生长的影响 将磷酸奥司他韦用SFM稀释成5000、1000、500、100、50、25、12.5、6.25、3.125 μmol/L。待MDCKHA2长至80%时,用无菌PBS洗2遍,按照100 μL/孔加入稀释好的磷酸奥斯他韦,每个稀释度作2个重复。37℃、5%CO2培养孵育15 min后,按照0.01 MOI接种病毒100 μL,接毒后12 h测定Renilla值,结果见图6。

图6 重组流感病毒对不同浓度磷酸奥司他韦敏感性的研究Fig.6 Sensitivity of the recombinant inf l uenza virus to different concentrations of oseltamivir phosphate
从 Luciferase报告基因系统测得的Renilla值可以看出,不同浓度的磷酸奥司他韦对重组流感病毒Renilla Luciferase的表达量影响不同;磷酸奥司他韦浓度越大,Renilla Luciferase表达量越低,测得的Renilla值越低,当浓度达到一定值时测得的Renilla值与阴性对照组基本一致;当磷酸奥司他韦浓度低至一定程度时测得的Renilla值与不含磷酸奥司他韦的接毒组基本一致。
结果显示,Luciferase报告基因系统可以十分灵敏检测到病毒的复制情况,当病毒复制能力强时测得的Renilla值高,当复制能力降低时测得的Renilla值低。
3 讨论
流感病毒不仅给养殖业带来了巨大的经济损失,也在一定程度上威胁到人类的健康。目前抗流感药物和接种疫苗是预防流感的最主要的手段,但因疫苗研制周期长,疫苗株需要及时更新,所以当流感大流行暴发的早期,抗流感病毒药物的使用对于控制疫情的蔓延可起到非常重要的作用。但长时间使用同种抗流感病毒药物,又使得流感病毒对药物产生了抗药性,因此新型抗流感药物的筛选及应用就显得极为重要。
2006年, Garcia-Perez等[9]运用重组病毒NL0641Ren研究了人类免疫缺陷病毒I型的药物敏感性;2010年,Huang等[10]运用Renilla Luciferase检测系统对线粒体融合的速率进行了测定。受此启发,我们成功构建了1株表达Renilla Luciferase的重组流感病毒,并运用Luciferase报告基因系统进行了该株病毒生物学特性的研究。研究发现重组流感病毒Renilla Luciferase的表达量能直接反应病毒的复制情况,而Luciferase检测试剂盒可以快速而且灵敏地检测到该基因的表达。当重组病毒与抗流感药物磷酸奥司他韦作用后测得的Renilla值明显低于无磷酸奥司他韦的病毒感染组,当用药浓度提高到一定值时测得的Renilla值与阴性对照组基本一致;而用药浓度降低时对病毒的抑制作用降低,测得的Renilla值较高。
本研究中对表达Renilla Luciferase的重组流感病毒生物学特性研究的方法为新型抗流感药物的筛选提供了一种新的思路,这种方法不仅快速灵敏,而且耗时短、工作量小,能极大地加快抗流感药物筛选的进程,加快新的抗流感药物的出现,为人们的生命健康提供保障。
