猪瘟E2亚单位疫苗攻毒保护效力研究
2018-09-10王遵宝李俊辉豆智华李森江
王遵宝,李俊辉,豆智华,郑 侃,李森江,寇 春,贺 笋
(天康生物股份有限公司,乌鲁木齐 830032)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的猪的高度致死性、接触性传染病,是OIE规定的必须通报的A类动物传染病之一,在我国列为一类传染病,常给养猪业带来巨大的经济损失,历来是各国研究的热点。
目前我国使用猪瘟兔化弱毒疫苗来预防猪瘟病毒,其免疫效力是毋庸置疑的。然而,在使用过程中会因为母源抗体的干扰而影响仔猪免疫效果。此外,活疫苗无法通过抗体检测区分免疫与野毒产生的抗体,是猪瘟的净化瓶颈之一。
猪瘟病毒E2糖蛋白是猪瘟病毒的主要结构蛋白之一,是诱导中和抗体及激发保护性免疫应答的主要抗原蛋白,其免疫原性依赖于正确的蛋白空间构象(或糖基化)。杆状病毒表达系统不仅可以高效表达外源蛋白,而且进行糖基化、磷酸化、酰基化、正确的信号肽切割、蛋白水解以及适当的折叠等真核细胞转录后加工作用,将重组蛋白聚集定位在同一细胞器上,经适当的寡聚化装配,使表达产物在结构及功能上接近天然蛋白。
因此,前期工作将猪瘟病毒E2全基因序列进行密码子优化和修饰,重组于杆状病毒内,在昆虫细胞上培养重组杆状病毒,分泌表达了猪瘟病毒E2重组蛋白,与进口佐剂乳化制成新型亚单位疫苗。免疫该疫苗猪可使用商品化猪瘟E2、E0抗体检测试剂盒区分野毒感染与疫苗免疫产生的抗体,为规模化猪场净化猪瘟带来可能。
本试验用不同疫苗免疫猪瘟抗体阴性猪,二免后14 d用强毒人工感染,根据攻毒后各组动物的临床症状及体温变化、血样及组织器官中的病毒载量,结合病理解剖结果比较分析了不同疫苗的保护力,结果证实猪瘟E2亚单位疫苗能可靠的免疫保护效力。
1 材料和方法
1.1 材料
1.1.1 试验猪 4~5 w健康仔猪(猪瘟病毒抗体为阴性),购自新疆天康畜牧有限公司。
1.1.2 疫苗 猪瘟E2亚单位疫苗、猪瘟兔化弱毒活疫苗(传代细胞源)由天康生物股份有限公司提供。
1.1.3 攻猪瘟强毒株 猪瘟石门系血毒购自中国兽医药品监察所。
1.1.4 主要试剂 血液RNA提取试剂盒购自天根生化科技,反转录试剂盒、Premix ExTaqTM购自TaKaRa公司,Plasmid Plus Midi Kit购自QIAGEN公司,猪瘟抗体检测试剂盒购自IDEXX公司。
1.1.5 引物 根据参考文献设计荧光定量CSFV引物。CSFV-F:5'-TACAGGACAGTCGTCAG TAGTTCGA-3';CSFV-R:5'-CCGCTAGGGTT AAGGTGTGTCT-3';CSFV-P:5'-CCCACCTCGA GATGCTATGTGGACGA-3';目的片段长121 bp,退火温度55.7℃。
1.2 方法
1.2.1 阴性猪筛选方法 用猪瘟病毒抗体检测试剂盒(IDEXX)筛选猪瘟抗体阴性猪。
1.2.2 免疫及攻毒方法 用猪瘟病毒抗体检测试剂盒(IDEXX)筛选获得的猪瘟抗体阴性猪15头,5头猪颈部肌肉注射猪瘟E2亚单位疫苗,2 mL/头份(每头份含50 ug重组E2蛋白);5头猪颈部肌肉注射猪瘟兔化弱毒疫苗,2 mL/头份(每头份含7500个RID50病毒);剩下的5头猪不注射疫苗作为对照,在同条件下隔离饲养。21 d后均加强免疫1次,二免后14 d,连同对照猪各耳后颈部肌肉注射猪瘟病毒石门系血毒1 mL(含106.0MLD),连续测温并观察16 d。
1.2.3 采样方法 攻毒后每2 d采集各组试验猪全血600 μL,置于含100 μL EDTA-Na 抗凝剂的1.5 mL离心管中,-70℃以下保存;试验结束后对存活动物处以安乐死后剖检,采集扁桃体、下颌淋巴结、脾脏、肾脏、肺脏、脑、肛拭子,-70℃以下保存。
1.2.4 核酸提取及RT-PCR 采用血液RNA提取试剂盒提取猪全血RNA。称取1 g组织于1.5 mL离心管中,加入1 mL无菌PBS中,用组织均浆机均浆,离心取上清,用病毒核酸提取试剂盒提取样品RNA。选用PrimeScript® RT reagent Kit进行反转录,将提取的RNA反转录为cDNA,用于PCR模板。
1.2.5 病毒含量测定 以cDNA为模板进行荧光qPCR,其反应体系:Premix ExTaq酶混合液12.5 μL,上、下游引物各0.5 μL,荧光探针0.5 μL,cDNA模板2 μL,补ddH2O至终体积为25 μL;反应条件:95℃预变性30 s;95℃变性5 s,55.7℃退火30 s,收集荧光信号,扩增40个循环。以E2基因构建重组质粒,用已知浓度的质粒DNA10倍梯度稀释,作为荧光定量PCR的标准品,绘制标准曲线,根据标准曲线计算未知样品的基因含量,分析相对表达量。
1.2.6 数据统计与分析 根据标准曲线计算的未知样的基因含量,利用SPSS13.0软件进行方差分析,比较各试验组病毒载量差异。
2 结果
2.1 抗体测定结果 用猪瘟病毒抗体检测试剂盒筛选出猪瘟病毒抗体阴性且阻断率相近的15头猪作为试验猪。免疫后监测猪只抗体阻断率变化,统计分析了每个监测点阳性率、平均阻断率及离散度。结果表明:猪瘟E2亚单位疫苗组在二次免疫时抗体5/5转阳,兔化弱毒组在二免后14 d 5/5转阳,对照组5/5保持阴性;E2亚单位疫苗组免疫后各监测点平均抗体阻断率均高于兔化弱毒疫苗组,离散度小于猪瘟兔化弱毒疫苗组,详见图1。

图1 免疫猪CSFV特异性抗体动态变化Fig.1 CSFV specific antibody responses in piglets of different groups after immunization
2.2 临床症状观察及体温测定结果 在攻毒后3 d,对照组猪精神沉郁,胃寒怕冷,食欲明显下降,便秘与腹泻交替发生,部分猪出现结膜炎症状,并有脓性分泌物,体温升高,可至41.5℃以上,攻毒后11 d内对照猪5/5死亡;免疫组仅部分猪体温稍有升高,平均体温测定结果如图2所示,免疫组均无异常临床反应,见图3。
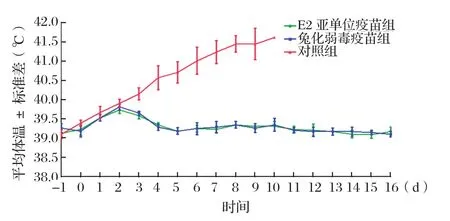
图2 攻毒前后猪只体温变化曲线Fig.2 Body temperature changes of experimentally infected piglets

图3 攻毒后各组猪不同时间的存活情况Fig.3 Survival of piglets challenged with CSFV
2.3 病理变化 对照组猪剖检发现,扁桃体有出血、溃疡甚至化脓;下颌、腹股沟、肠系膜等淋巴结严重肿大、出血,切面呈大理石样花纹;体表、喉头、膀胱、有出血点或出血斑;脾脏边缘梗死;肾脏表面有大量出血点,呈现典型“雀斑肾”病理变化;E2亚单位疫苗组剖检未见异常病理状况,兔化弱毒疫苗组部分猪只淋巴结肿大,但未见出血,剖检结果见图4及表1。组织器官病理切片结果表明,E2亚单位疫苗组猪淋巴结、肾脏无明显病变,脾脏结构正常,淋巴滤泡完整;对照组猪淋巴结反应性增生,红细胞进入淋巴结被吞噬后形成棕黄色颗粒,肾脏可见较大区域与大量单核细胞浸润于肾小管间质中,呈现较大区域间质性肾炎,脾脏淋巴细胞流失,并有大量网状内皮细胞浸润。

图4 内脏器官病理变化Fig.4 The autopsy lesions of experimentally infected piglets
2.4 病毒含量测定结果 用标准曲线法对采集的组织器官进行了猪瘟病毒含量测定。结果表明,对照组所采样中均可检出猪瘟病毒,其中脾脏中病毒含量最高,为9190.2±121.44 copies/μL,肺脏病毒含量最少,为1823±75.69 copies/μL,肛拭子中检出较高病毒含量,表明机体向外排毒;在免疫组的扁桃体、下颌淋巴结、脾脏中检出微量病毒,肛拭子中未检测到病毒,提示病毒未被排出体外;在所检组织样品中,对照组与免疫组的病毒载量均差异极显著(P<0.01),E2亚单位疫苗和猪瘟兔化弱毒疫苗组仅在下颌淋巴结中的病毒载量有显著性差异(P<0.05),详见表2。
由表3可以看出,对照组猪在攻毒后血液中的病毒含量随感染天数逐渐升高,至频死期达到最高,可达1.7×107copies/mL。免疫猪瘟E2亚单位疫苗的猪只仅在攻毒后6 d内检测到微量病毒(不高于150 copies/mL),之后的监测点均未检出病毒;猪瘟兔化弱毒疫苗组猪只血液病毒载量在攻毒后6 d达到最高,可达1453 copies/mL,但整个攻毒过程病毒含量始终较低,但均高于猪瘟E2亚单位疫苗组。
3 讨论
国内外研究结果表明,人工感染强毒的抗体阴性猪在攻毒后1 d即可从扁桃体、淋巴结、脾脏等中检测出猪瘟病毒,感染后3~8 d相继在肾脏、回肠、肺脏、肝脏、脑等组织中检出较高病毒,提示猪感染病毒3 d后开始通过呼吸道和消化道向外排毒。猪瘟病毒最早在宿主扁桃体、淋巴结等组织进行复制,随后通过淋巴、血液循环系统向其他组织、器官扩散,最终导致全身病毒血症[2-5]。
Rachel等[6]用昆虫细胞表达的重组E2蛋白及水包油佐剂配制的KNB-E2疫苗免疫猪,对照猪注射生理盐水溶液。二免后2 w,用猪瘟强毒攻击试验猪,试验发现感染CSFV的对照猪停止生长,发生高热,血液和鼻拭子中含有大量猪瘟病毒核酸,白细胞严重减少;免疫猪生长不受影响,未见任何异常,血液和鼻液中仅可检测到微量病毒核酸。研究结果表明,KNB-E2疫苗免疫猪可产生高水平的E2特异性抗体,可中和病毒,保护靶动物。
Xia等[7]用rAdV-SFV-E2疫苗免疫了不同母源抗体水平的仔猪,并用CSFV石门株人工感染。试验结果显示,免疫组未见任何异常,未免疫仔猪出现了典型的CSF临床症状、病毒血症及病理、组织病理学变化,攻毒期间全部发病死亡。其研究表明,rAdV-SFV-E2或C株的母源抗体不影响rAdVSFV-E2的免疫效果,突出了疫苗控制和根除CSF的巨大潜力。

表1 人工感染猪解剖病变统计结果Table 1 Statistics on autopsy lesions of experimentally infected piglets
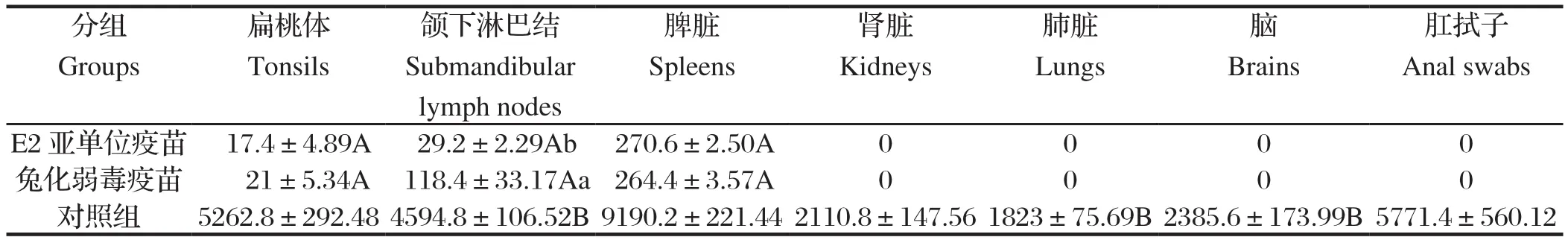
表2 组织器官中的猪瘟病毒含量(copies/μL)Table 2 Copies of CSFV RNA in the internal organs of experimentally infected piglets(copies/μL)

表3 人工感染猪全血中猪瘟病毒含量(copies/mL)Table 3 Copies of CSFV RNA in the whole blood samples of experimentally infected piglets(copies/mL)
Hua等[8]用BHK-21细胞产生的猪瘟病毒E2重组蛋白乳化配苗(ME2疫苗),免疫猪体首免后32 w,采用猪瘟强毒进行攻击,攻毒后2 w,所有免疫猪存活,无明显猪瘟症状,而未免疫猪体攻毒后4 d表现出猪瘟症状,攻毒后7~9 d猪体频死时处以安乐死,进行剖检,可见典型的病理、组织病理学变化。结果表明,ME2疫苗是一种安全有效的猪瘟亚单位疫苗。
Wang等[9]用rPRVTJ-E2嵌合体疫苗免疫猪,攻毒后免疫组没有观察到猪瘟临床症状;对照猪攻毒后体温持续升高,陆续出现精神沉郁、食欲不振、畏寒怕冷、共济失调、便秘及腹泻等症状,9 d内全部发病死亡。攻毒后14 d,将所有存活猪安乐死并进行病理剖检,对照组中的猪均显示出严重的病理变化,包括扁桃体出血、有坏死灶,淋巴结肿大、出血,脾脏梗死,肾脏和膀胱中有广泛的针尖状出血点,以及回盲部的纽扣状溃疡结节。荧光定量PCR检测结果显示,对照组中猪的组织、器官含有7.2×104~6.3×107个拷贝的CSFV RNA,免疫猪未检测到病毒核酸,表明该嵌合体疫苗对靶动物有很好的免疫保护力。
本研究首次免疫E2亚单位疫苗21 d后,抗体全部转阳,较猪瘟兔化弱毒疫苗早,免疫后每个监测点抗体阻断率均高于猪瘟兔化弱毒疫苗组。攻毒前免疫组抗体全部转阳,对照猪抗体始终为阴性,对照组中的猪试验在攻毒11 d内全部死亡,免疫组个别试验猪体温稍有升高,但均无异常临床反应。组织、器官病毒含量分析结果表明,免疫组在脑、肺脏、肾脏、肛拭子中均未检测到病毒,在脾脏、扁桃体和下颌淋巴结中检出较低的病毒拷贝数;而对照组所采集的样品中均可检出大量病毒核酸,其中脾脏病毒含量最高。以上结果表明,用猪瘟石门系血毒攻毒后,免疫猪瘟病毒E2亚单位疫苗与猪瘟兔化弱毒疫苗均可为试验猪提供可靠的免疫保护效力。
