不同表达模式组合对谷氨酸棒状杆菌中脑钠肽蛋白表达的影响
2018-09-06彭枫刘秀霞陈静杨艳坤白仲虎
彭枫,刘秀霞,陈静,杨艳坤,白仲虎*
1(江南大学 生物工程学院,江苏 无锡,214122) 2(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)3(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)
谷氨酸棒状杆菌(Corynebacteriumglutamicum)是一种革兰氏阳性细菌,已被广泛用于谷氨酸、赖氨酸等氨基酸的生产,以及食品工业、动物饲料和医药开发等领域,是一种普遍认为安全(generally recognized as safe, GRAS)的表达宿主[1]。由于其无内毒素无致病性,可以分泌正确折叠的活性蛋白直接到胞外上清液中等优点,近年来C.glutamicum也被开发作为一种新的外源蛋白表达宿主[2]。同时,随着发酵过程优化来提高生物反应器中产物产量以及遗传学改造来增强宿主蛋白合成能力等技术被开发运用[3-4],也使得C.glutamicum越来越多地应用于重组蛋白表达。近十年来已有多种外源真核及原核蛋白在C.glutamicum中被高效表达的报道和应用。例如葡萄球菌核酸酶、转谷氨酰胺酶、人源抗体片段和胰岛素等[5-6]。
目前C.glutamicum中,外源蛋白的表达系统依据启动子作用方式分为诱导型及组成型表达系统,诱导型系统在表达对细胞有毒害作用的蛋白时有很好的效果,组成型表达可以得到很高的表达量[7-8]。外源蛋白表达系统按照蛋白表达后的去向可分为胞内表达和分泌型两种表达策略,细胞分泌较少的宿主细胞蛋白到胞外,分泌型表达可降低下游纯化难度[9]。然而,因为信号肽的不同选择以及分泌过程中断裂的影响,分泌表达有时会得到不正确折叠的蛋白。胞内表达可以提供蛋白正确折叠的内环境,但胞内蛋白酶较胞外多,会造成更多的外源蛋白降解[10]。所以,利用谷氨酸棒杆菌表达系统表达目标蛋白时需要解决的一个重要问题就是选择哪种表达模式组合能够达到最优的表达效果。本研究试图在C.glutamicum中找到表达脑钠肽(BNP)的最优表达模式。
BNP是一种肽类激素,它具有排钠利尿、舒张血管以及抗肾素的作用[11]。BNP属于一个结构相似的肽类激素家族,此家族还包括心房肽(atrial natriuretic peptide, ANP)、C型脑钠肽(C-type natriuretic peptide, CNP)和尿扩张素。BNP分子由32个氨基酸残基组成,在第10位半胱氨酸和第26位半胱氨酸之间有1个二硫键[12]。
BNP是脑钠肽前体原(pro-brain natriuretic peptide, proBNP)的蛋白酶裂解产物。BNP以及没有分解的proBNP都被分泌到血液中并在血液中循环[13]。已确定proBNP的合成随着心壁的张力上升而增加,继而导致血液中BNP和proBNP浓度的升高[14]。这两种多肽浓度在心力衰竭、急性冠状动脉综合症、心肌病、心脏瓣膜疾病、心房纤维性颤动和心脏淀粉样变性等不同的心脏病患者样品中都有升高[15]。心衰患者血液中这两种多肽的浓度与疾病的严重程度成正比。因此,血液中此种肽的检测被广泛用于鉴定心衰患者和检测心衰的严重程度[16]。BNP蛋白作为心血管检查试剂盒中的标准品和校准品,目前尚未有用C.glutamicum表达BNP蛋白的相关报道,而作为GRAS菌株生产的蛋白在药品审批时比非安全菌株会更有优势。
本研究基于pXMJ19质粒骨架,整合Ptac启动子、gfp基因、Ncgl0949信号肽等基因表达元件,构建了一套高效的谷氨酸棒状杆菌表达系统,该系统分为诱导型胞内表达、组成型胞内表达、诱导型分泌表达、组成型分泌表达4种表达模式组合,同时这4种模式组合被用来研究BNP在谷氨酸棒状杆菌中的最适表达模式。研究结果将对以谷氨酸棒状杆菌作为宿主快速表达外源蛋白具有重要指导意义。
1 材料方法
1.1 材料
1.1.1 菌株和质粒
谷氨酸棒状杆菌C.glutamicumCGMCC1.15647用于外源蛋白的表达,保藏于中国普通微生物菌种保藏管理中心。大肠杆菌E.coliDH5α用于质粒的克隆和构建,本研究室保藏。pXMJ19用于谷氨酸棒状杆菌中蛋白表达,质粒pEGFP为绿色荧光蛋白表达质粒,均由实验室保存。
1.1.2 主要的试剂
质粒提取试剂盒,胶回收试剂盒及PCR产物回收试剂盒购自Axygen公司。RNA反转录,荧光定量,T4 DNA连接酶及In-Fusion重组试剂购自Takara公司。RNA提取试剂盒和限制性内切酶购自Thermo公司。BNP标准品购自罗氏。氯霉素购自上海生物工程有限公司。引物由苏州金唯智合成。所用引物见表1。

表1 扩增引物序列Table 1 Primers used in this study
1.1.3 培养基和培养条件
LB培养基用于培养大肠杆菌,培养温度为37 ℃,LBB培养基(LB培养基中添加1%脑心浸液)用于培养谷氨酸棒状杆菌,培养温度为30 ℃。如需添加抗生素,氯霉素在大肠杆菌中的使用终质量浓度为30 mg/L,在谷氨酸棒状杆菌中的使用终质量浓度为10 mg/L。
1.2 方法
1.2.1 谷氨酸棒状杆菌组成型表达载体的构建
Ptac启动子为Lac(乳糖启动子)与Trp(色氨酸启动子)结合而成的杂合启动子,当有lacIq基因产生阻遏蛋白时启动子为IPTG诱导型启动子,去掉阻遏蛋白基因时启动子会成为组成型强启动子[17]。以pXMJ19 为质粒骨架,利用引物tacF和tacR扩增Ptac启动子序列Ptac-C,同时在5’端引入EcoRV酶切位点,在3’端引入HindIII酶切位点。利用EcoRV和HindIII酶切pXMJ19,删除掉载体中的Ptac启动子及laIq区域,酶切回收后的载体片段与同样用限制性EcoRV和HindIII消化回收后的Ptac片段连接,构建pXMJ19组成型表达载体pXMJ19C(图1)。
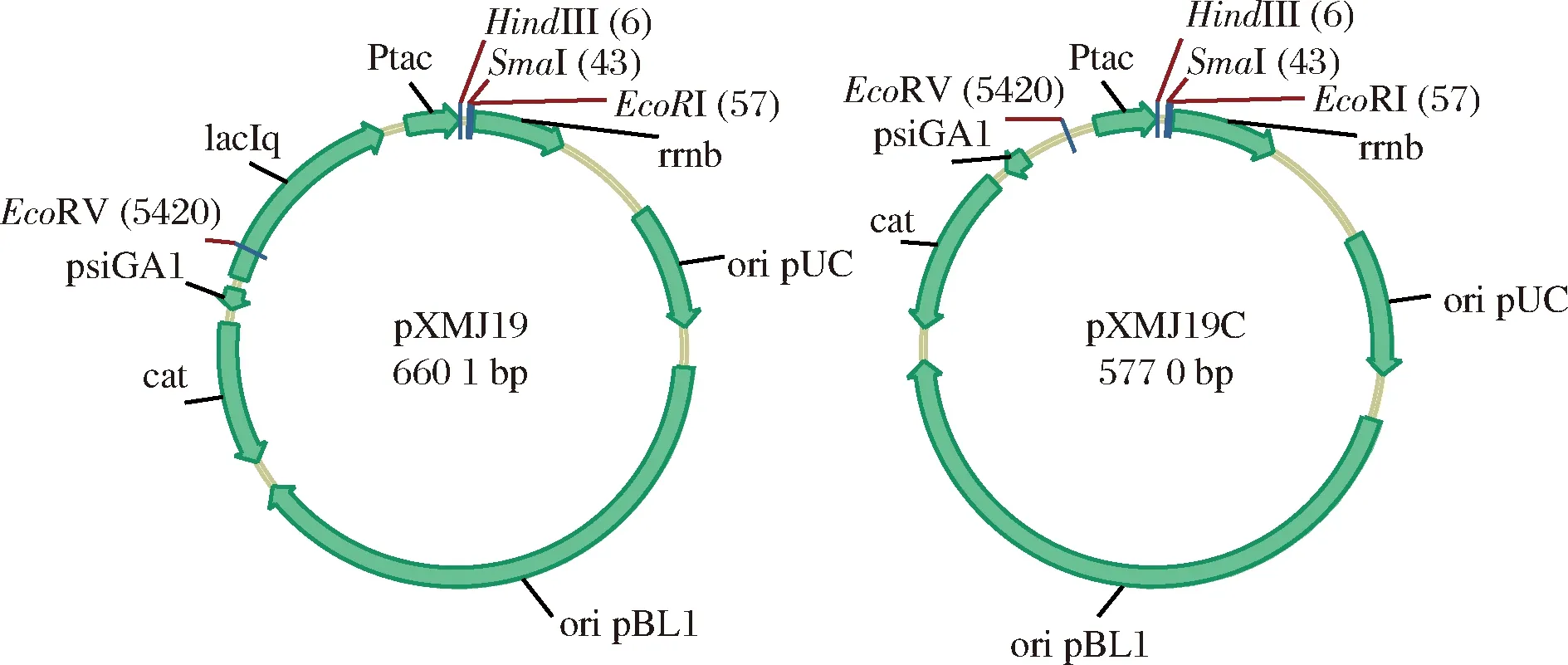
图1 pXMJ19C组成型表达载体的构建Fig.1 The plasmid construction of pXMJ19C
1.2.2 谷氨酸棒状杆菌GFP胞内表达载体的构建
以pEGFP质粒为模板利用引物gfpF和gfpR扩增gfp基因,同时在gfp基因ATG之前加上SD(AAAGGAGGACAACTA)序列,在片段的5’端引入HindIII酶切位点,在3’端引入EcoRI酶切位点,扩增的片段经过凝胶电泳分析,利用限制性内切酶HindIII和EcoRI消化回收后,与同样用HindIII和EcoRI消化回收后的载体pXMJ19连接,连接后产物转化入大肠杆菌DH5α感受态细胞,转化液涂布于30 mg/mL氯霉素的LB琼脂平板过夜培养,再挑取单菌落接种LB液体培养基过夜培养,提取质粒后进行酶切验证,正确的质粒即为谷氨酸棒状杆菌中GFP蛋白胞内诱导型表达载体pXMJ19-gfp。
同样的将扩增的片段经过凝胶电泳分析,限制性内切酶消化回收后,连接到同样经HindIII和EcoRI酶切消化回收后的组成型表达载体pXMJ19C中,构建GFP胞内组成表达载体pXMJ19C-gfp。
1.2.3 谷氨酸棒状杆菌GFP分泌型表达载体的构建
以pEGFP为质粒骨架,合成SD序列插入到gfpATG之前,SD序列前插入Ncgl0949信号肽(ATGCAAATAAACCGCCGAGGCTTCTTAAAAGCCACCGCAGGA CTTGCCACTATCGGCGCTGCCAGCATGTTTATGCCAAAGGCCAAC GCCCTTGGAGCA),利用引物0949gfpF和0949gfpR扩增sgfp片段,在5’端引入HindIII酶切位点,在3’端引入EcoRI酶切位点,限制性内切酶HindIII和EcoRI消化回收后,连接到经相同限制性内切酶处理的表达载体pXMJ19及pXMJ19C中,构建成GFP蛋白的诱导型分泌表达载体pXMJ19-sgfp及组成型分泌表达载体pXMJ19C-sgfp。
1.2.4 谷氨酸棒状杆菌中BNP胞内表达载体的构建
人源的BNP蛋白(GenBank: NP_002512.1)经过谷氨酸棒状杆菌密码子优化后合成bnp基因,bnp基因ATG前加入SUMO基因(GenBank: KP405837.1),SUMO多用于融合蛋白的切除,也有报道SUMO具有促进蛋白折叠,促进蛋白可溶的特点[18],本研究中引入SUMO用于促进BNP的表达。SUMO基因前引入组氨酸标签(CATCATCACCACCACCAC),然后再引入SD序列,以引物bnpF和bnpR扩增bnp片段,最终的片段两端分别引入pXMJ19载体SmaI位点两端同源序列,通过同源重组的方法连接到pXMJ19和pXMJ19C中,分别构建BNP蛋白的组成型胞内表达载体pXMJ19-bnp和诱导型的胞内表达载体pXMJ19C-bnp。
1.2.5 谷氨酸棒状杆菌BNP分泌表达载体
谷氨酸棒状杆菌密码子优化后的bnp基因,ATG前加入SUMO基因, SUMO基因前引入组氨酸标签,组氨酸标签前加入Ncgl0949信号肽,信号肽前再加入SD序列,以引物0949bnpF和0949bnpR扩增sbnp片段,片段两端引入pXMJ19载体SmaI位点两端同源序列,通过同源重组的方法连接到pXMJ19和pXMJ19C 中,构建BNP蛋白的组成型分泌表达载体pXMJ19-sbnp和诱导型分泌表达载体pXMJ19C-sbnp。
1.2.6 转化谷氨酸棒状杆菌
谷氨酸棒状杆菌感受态的制作方法及电击转化方法依据文献报道[19]。
1.2.7 GFP的表达鉴定
为了分析GFP以不同的表达模式组合在谷氨酸棒状杆菌中的表达情况,将包含有不同GFP表达载体的菌株接种到24孔板中过夜培养,按1∶10的比例转接到2 mL新鲜培养基中生长24 h, 需要添加诱导剂的在培养8 h时添加浓度为0.01 mmol/L的IPTG。Dark Reader,SDS-PAGE及多功能酶标仪被用来分析GFP的表达量。取2 mL培养液分为2份,于12 000 r/min离心,菌体和上清分开,菌体PBS洗涤2遍后,用Dark Reader 来观察不同菌株的菌体和发酵上清荧光情况。每份菌体用1 mL PBS重悬,1份菌悬液高通量破碎后,取破碎上清和发酵液上清一起用SDS-PAGE来检测GFP的表达量。另1份菌悬液取200 μL和200 μL发酵液利用多功能酶标仪测量荧光,荧光测量条件为激发488 nm发射507 nm。
1.2.8 不同表达模式gfp转录水平分析
为了分析不同表达模式GFP表达量与转录水平的关系,以gfp基因为模板设计荧光定量引物RTgfpF和RTgfpR。不同表达模式GFP表达菌株的培养条件与GFP表达量测定时相同,取样点选取在加入IPTG前2 h和加入后2 h即培养的6 h和10 h,使用RNA提取试剂盒提取谷氨酸棒状杆菌的总RNA,反转录成cDNA,并使用RT-PCR检测gfp基因的转录水平。以16S rRNA为内参基因,采用2-ΔΔCt方法测定gfp基因的相对表达量。RNA提取,反转录及荧光定量体系参考试剂盒说明书。
1.2.9 BNP的表达鉴定
为了分析BNP在不同表达模式下的表达情况,将包含有BNP表达质粒的菌株接种到24孔板中,培养过夜后按1∶10的比例转接于新鲜的2 mL培养基中,需要添加诱导剂的在培养8 h后添加浓度0.01 mm的IPTG,培养至24 h。SDS-PAGE,Western Bolt,化学发光法被用来分析BNP的表达。收获后的细胞 1 mL 12 000 r/min 离心10 min,分别收集发酵液上清和菌体。菌体PBS洗涤2遍后冰上超声波破碎。破碎后的上清,发酵液上清都通过SDS-PAGE来检测。 同时通过Western Blot来分析BNP的表达。化学发光法利用双抗体夹心法,通过光子数来指示BNP的表达量,具体操作方法参考文献[11]。
1.2.10 BNP的纯化
包含有BNP表达载体的菌株接种到20 mL LBB培养基中30 ℃过夜培养,然后按1∶10稀释到200 mL培养基中30 ℃培养24 h,细胞收获后4 ℃ 4 000 r/min 离心去上清,菌体用PBS洗涤2次,冰上超声破碎。BNP利用AKTA纯化仪并利用HisTrap HP进行纯化,纯化后的蛋白利用SDS-PAGE进行检测,并利用BCA蛋白定量试剂盒进行定量。
2 结果与分析
2.1 谷氨酸棒状杆菌中GFP不同表达模式菌株的构建
组合诱导型、组成型、胞内以及分泌4种表达方式,外源蛋白表达系统可分为诱导型胞内表达、组成型胞内表达、诱导型分泌表达及组成型分泌表达4种模式。为了在谷氨酸棒状杆菌中快速构建这4种表达系统,研究中选取GFP作为模式蛋白,结合SD序列,利用Ptac诱导型启动子和Ptac-C组成型启动子分别构建了 GFP诱导型胞内表达载体pXMJ19-gfp和组成型胞内表达载体pXMJ19C-gfp; 同时结合SD序列,Ncgl0949信号肽构建成诱导型分泌表达载体pXMJ19-sgfp和组成型分泌表达载体pXMJ19C-sgfp。构建完成的表达载体通过酶切、PCR和测序来验证(图2)。正确的载体转化谷氨酸棒状杆菌即构建成相应的GFP表达菌株。
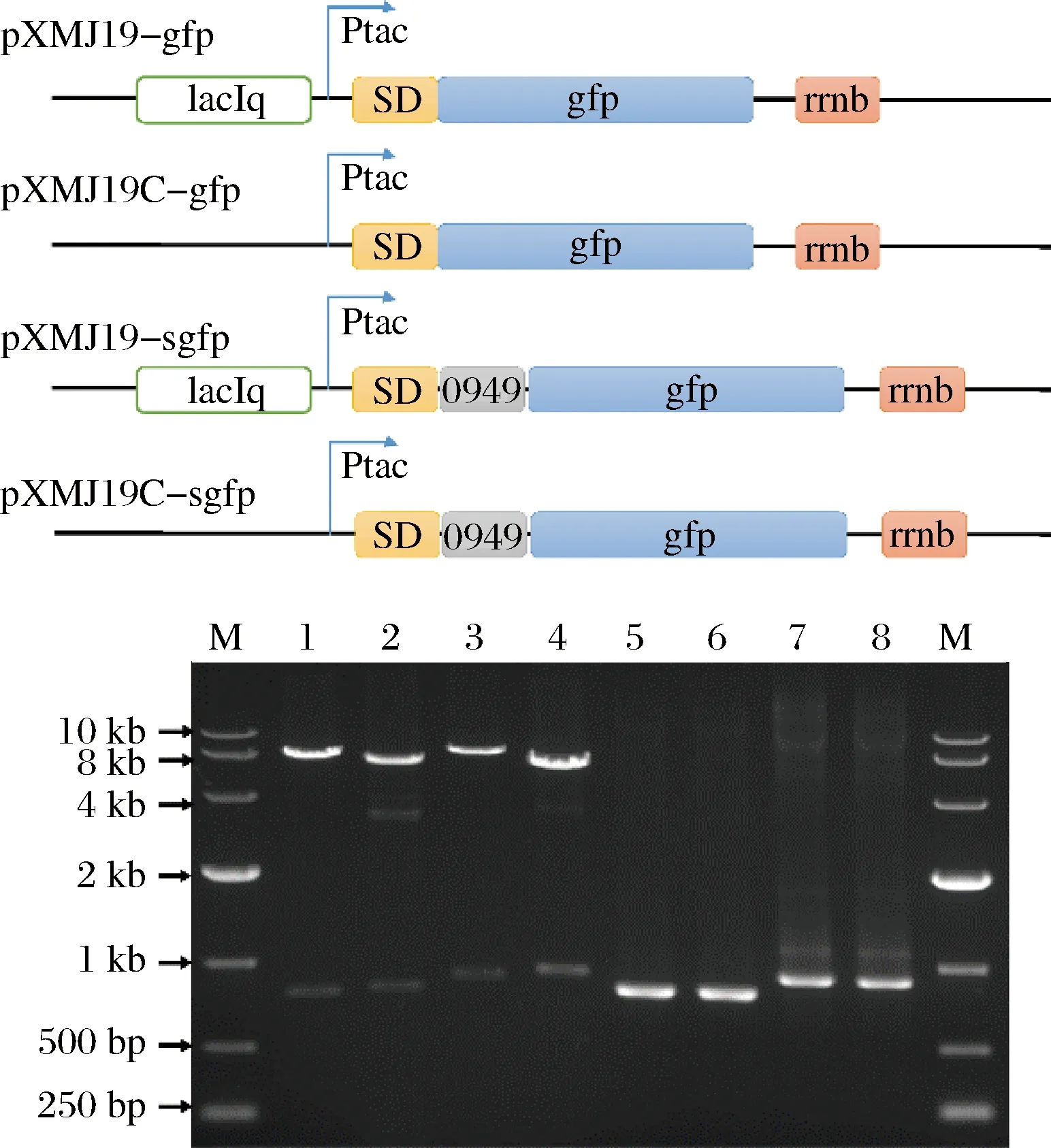
M-DL10 000 marker;1,2,3,4分别为质粒pXMJ19-gfp,pXMJ19C-gfp,pXMJ19-sgfp和pXMJ19C-sgfp的酶切验证结果,5,6,7,8分别为PCR验证结果图2 GFP表达载体的构建Fig.2 Construction of plasmids for GFP expression
2.2 GFP在谷氨酸棒状杆菌中的表达分析
为了验证所构建的4种表达系统在谷氨酸棒状杆菌中是否可行,以GFP作为模式蛋白,分析了GFP在这4种表达系统中的表达量差异。以含有pXMJ19 的谷氨酸棒状杆菌转化子作为阴性对照,利用24孔板培养不同类型GFP表达菌株,利用SDS-PAGE,多功能酶标仪及Dark Reader来分析不同表达模式下GFP的表达水平。Darker Reade结果表明,胞内表达的只在菌体中有荧光,分泌表达的只在上清中有荧光,分泌表达的诱导型比组成型菌株荧光强度高(图3-a,图3-b)。培养液的菌体和上清分别用SDS-PAGE 和多功能酶标仪来检测。结果表明GFP的组成型胞内表达量是诱导型胞内表达的1.2倍,是诱导型分泌表达的1.9倍,是组成型分泌表达的2.9倍(图3-c,图3-d)。说明4种表达模式都能在谷氨酸棒状杆菌中成功表达外源蛋白,但对于GFP蛋白,组成型胞内表达是更好的表达方式。
2.3 不同表达模式下gfp转录水平分析
为了分析不同表达模式对转录水平的影响,本研究以16S rRNA作为内参基因,使用RT-PCR测定了4种表达模式下gfp的转录水平。结果可以看出,组成型的胞内表达及诱导型的胞内表达具有相似的转录水平,明显高于组成型分泌表达及诱导型分泌表达模式下的gfp转录水平。说明分泌型表达元件的加入影响了gfp基因的转录。同时,组成型分泌表达模式和诱导型分泌表达模式下都能观察到gfp的转录,说明这2种表达模式GFP表达量的差异不是发生在转录水平上(图4)。
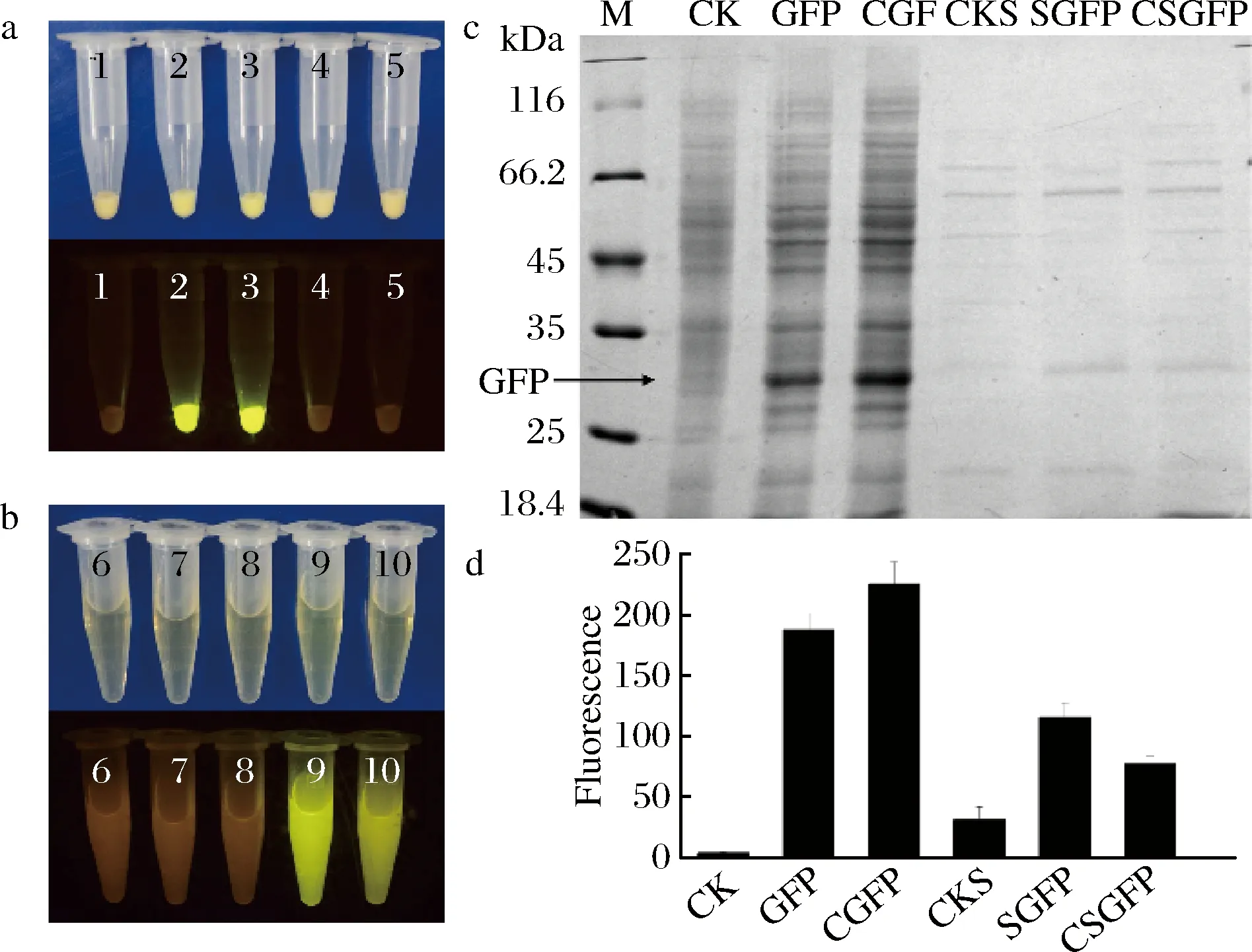
a-Darker Reade分析不同菌株菌体的荧光强度;b-Darker Reade分析不同菌株培养液上清的荧光强度;c-SDS-PAGE分析不同菌株GFP表达水平;d-多功能酶标仪分析不同菌株GFP的表达水平;1-菌体阴性对照;2-诱导型胞内表达的菌体;3-组成型胞内表达的菌体;4-诱导型分泌表达的菌体;5-组成型分泌表达的菌体;6-上清阴性对照;7-诱导型胞内表达的上清;8-组成型胞内表达的上清;9-诱导型分泌表达的上清;10-组成型分泌表达的上清;M-蛋白marker;CK-菌体阴性对照;GFP-诱导型胞内表达的菌体;CGFP-组成型胞内表达的菌体;CKS-上清阴性对照;SGFP-诱导型分泌表达的上清;CSGFP-组成型分泌表达的上清图3 GFP表达量的检测Fig.3 Detection of the expression of GFP
2.4 谷氨酸棒状杆菌中BNP不同表达模式菌株的构建
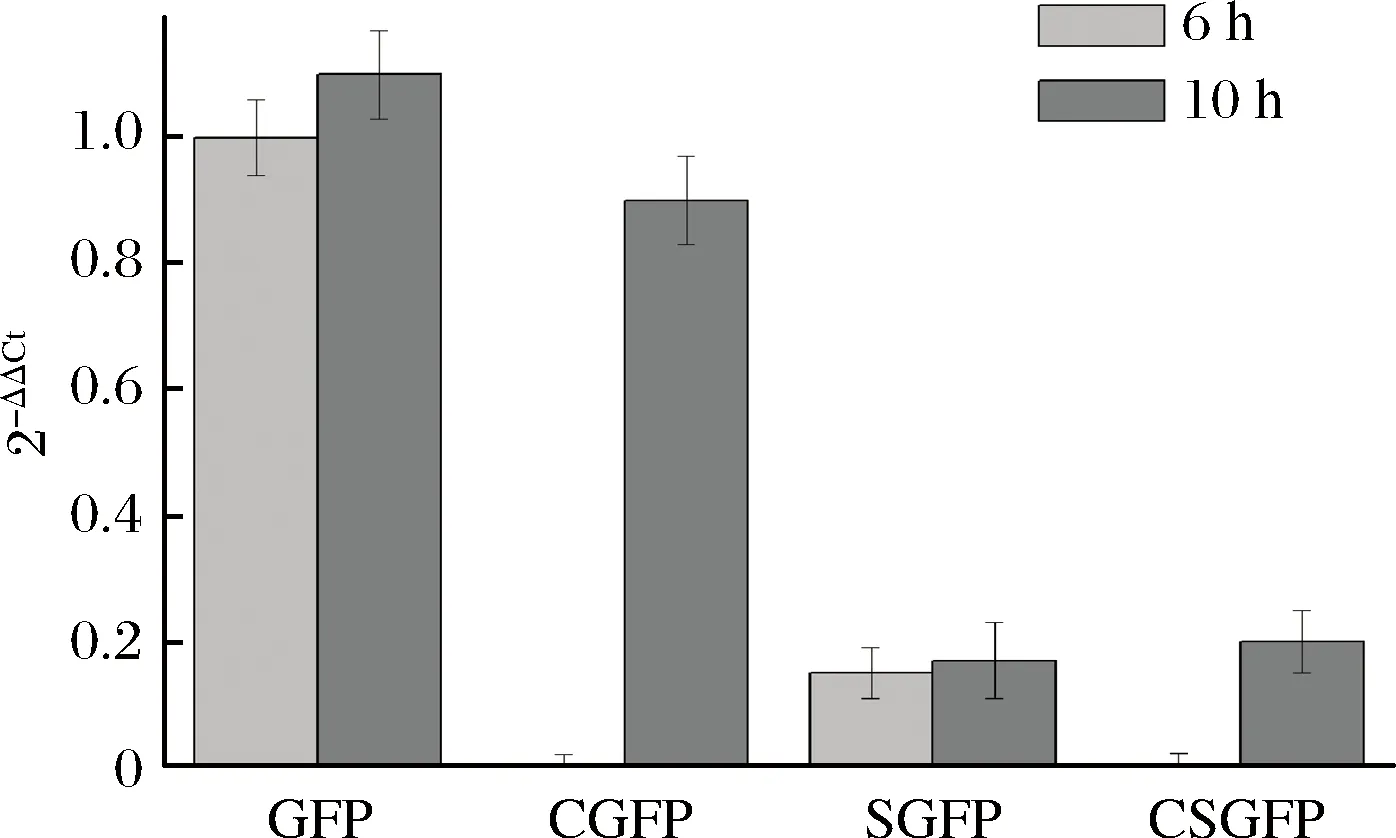
GFP-诱导型胞内表达;CGFP-组成型胞内表达; SGFP-诱导型分泌表达;CSGFP-组成型分泌表达图4 gfp转录水平分析Fig.4 Relative quantification of gfp gene mRNA level
为了在谷氨酸棒状杆菌中表达BNP蛋白,同时探究BNP表达的最佳模式组合。本研究组装Ptac诱导型及Ptac-C组成型启动子,SD序列,SUMO基因,bnp基因等表达元件分别构建成BNP诱导型胞内表达载体pXMJ19-bnp和组成型胞内表达载体pXMJ19C-bnp。同时,组装SD序列,Ncgl0949信号肽,SUMO基因,bnp基因及Ptac诱导型和组成型启动子分别构建成BNP诱导型分泌表达载体pXMJ19-sbnp和组成型分泌表达载体pXMJ19C-sbnp。载体通过酶切,RCR基因和测序验证。验证正确的质粒转化谷氨酸棒状杆菌构建成相应的BNP表达菌株(图5)。
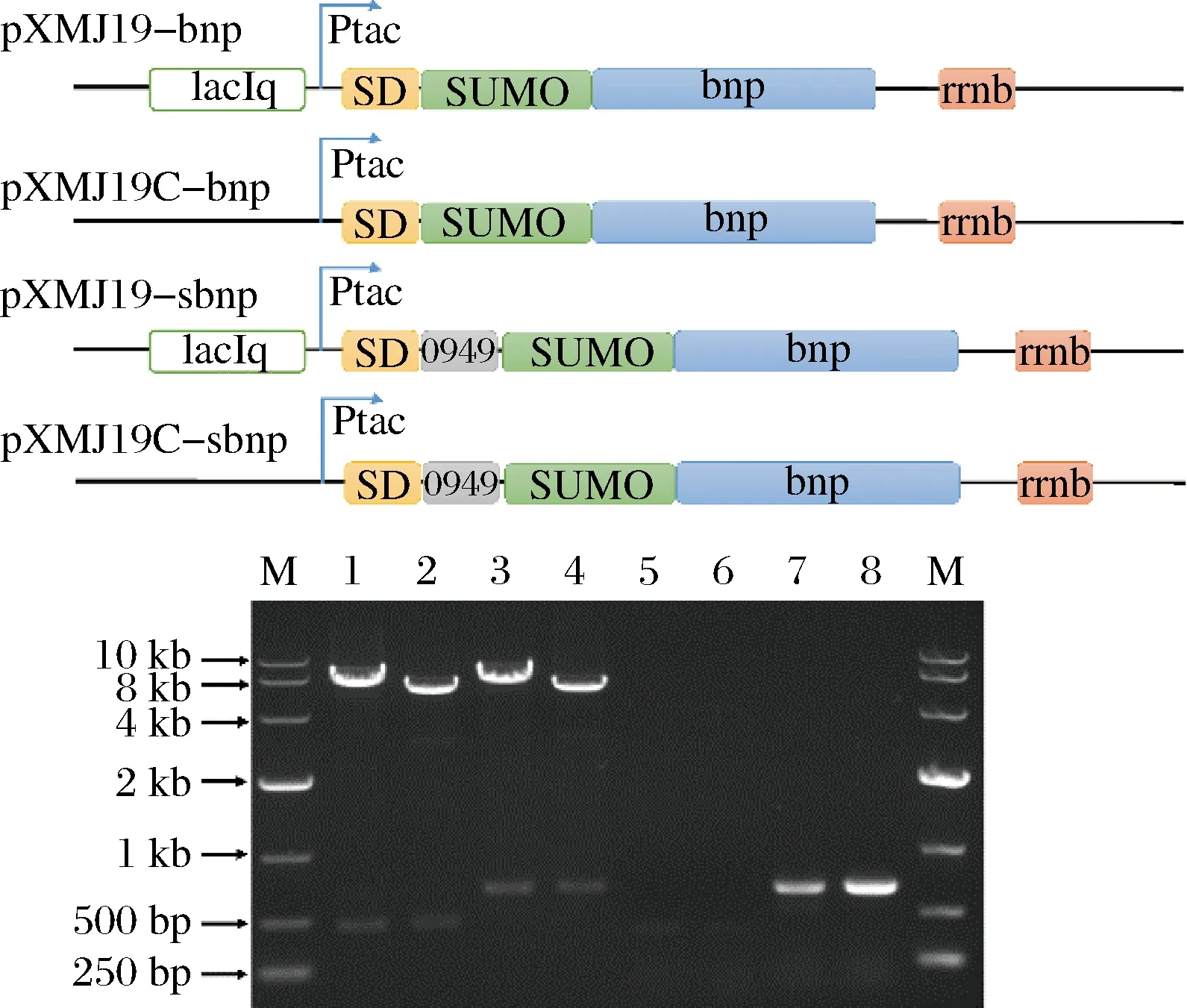
M-DL10000 marker;1,2,3,4分别为质粒pXMJ19-bnp,pXMJ19C-bnp,pXMJ19-sbnp和pXMJ19C-sbnp的酶切验证结果,5,6,7,8分别为PCR验证结果图5 BNP表达载体的构建Fig.5 Construction of plasmids for BNP expression
2.5 BNP蛋白在谷氨酸棒状杆菌中的表达分析
为了检测BNP以不同表达模式在谷氨酸棒状杆菌中的表达情况,以含有pXMJ19转化子作为阴性对照,利用24孔板培养包含有不同的BNP表达载体的菌株。1 mL培养液离心后,分别取上清和菌体通过SDS-PAGE 和Western Bolt 来分析不同菌株BNP的表达情况。结果表明,胞内表达的组成型和诱导型都可以观察到BNP的表达。诱导型分泌表达的上清中可以观察到BNP的表达,组成型分泌观察不到BNP蛋白的表达(图6-a,图6-b)。同时通过化学发光法检测BNP的表达量,BNP的表达量组成型胞内表达是诱导型胞内表达的1.3倍,是诱导型分泌表达的3.3倍。组成型分泌表达并不能观察到BNP蛋白的表达(图6-c)。表明BNP不适合组成型分泌表达,组成型胞内表达为最佳的表达模式。
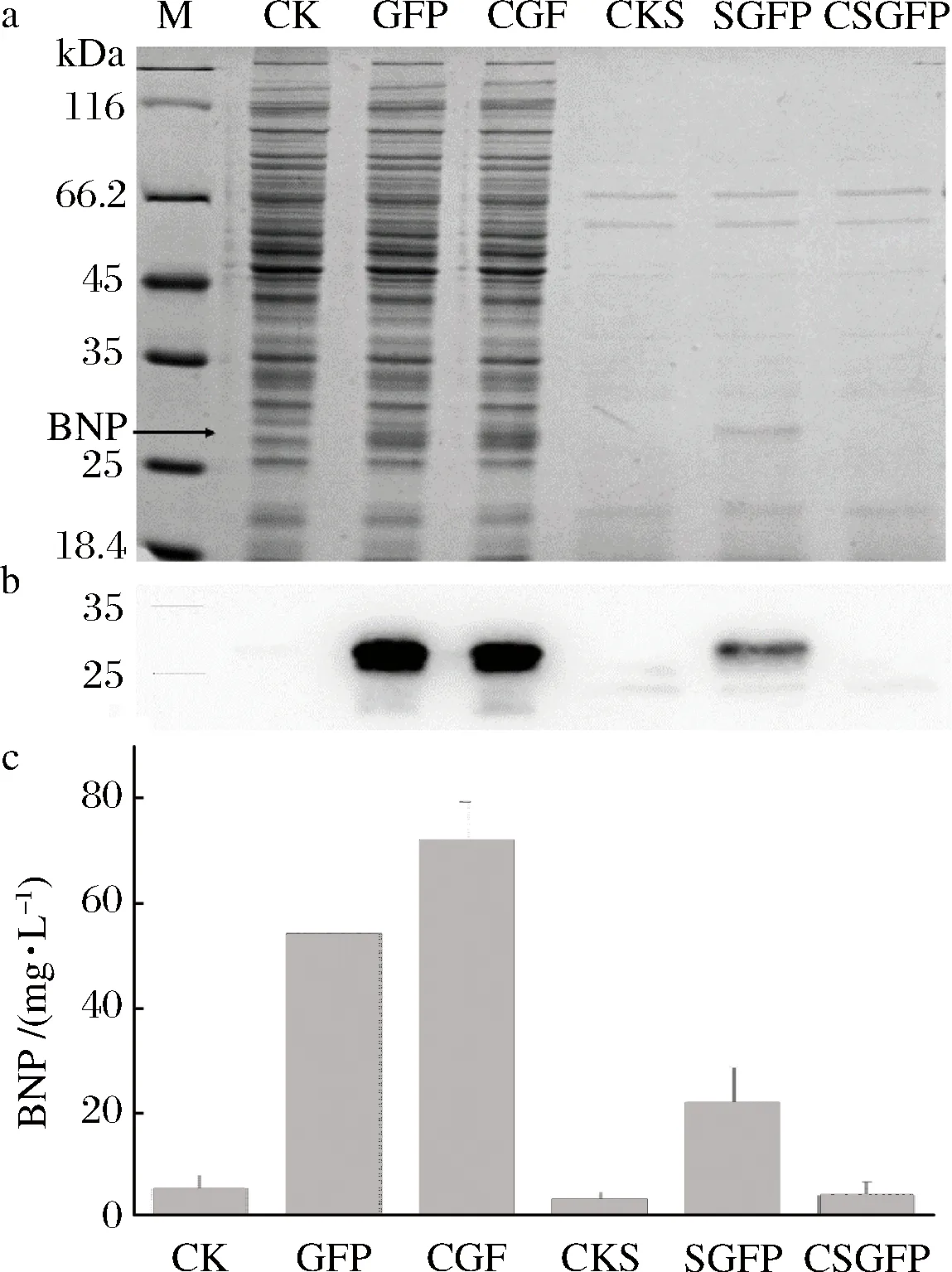
a-SDS-PAGE分析不同菌株BNP表达水平;b-Western Bolt分析不同菌株BNP表达水平;c-化学发光法分析不同菌株BNP表达水平;M-蛋白marker;CK-菌体阴性对照;BNP-诱导型胞内表达的菌体;CBNP-组成型胞内表达的菌体;CKS-上清阴性对照;SBNP-诱导型分泌表达的上清;CSBNP-组成型分泌表达的上清图6 BNP表达量的检测Fig.6 Detection of the expression of BNP
2.6 BNP的纯化及抗原特性分析
经过不同表达模式分析,组成型胞内表达为BNP最优的表达选择。为了进一步得到大量纯化后的BNP蛋白,利用200 mL摇瓶培养,培养液通过AKATA纯化系统纯化,纯化产物通过SDS-PAGE检测及通过BCA蛋白定量试剂盒定量。通过一步纯化,最终从1 L培养产物中分离纯化得到235.5 mg BNP蛋白,通过SDS-PAGE检测,纯化效率可到90%以上(图7-a)。取纯化后的BNP(SUMO-BNP)及购买的BNP标品分别稀释成不同的梯度,利用化学发光法分析纯化后的BNP抗原特性。结果显示纯化后的BNP与标品相比具有同样的抗原特性(图7-b)。
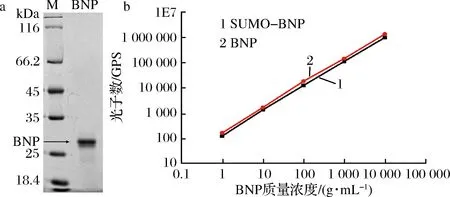
a-SDS-PAGE检测纯化后BNP的纯度;b-化学发光法分析纯化后的BNP抗原特性图7 BNP蛋白的纯化及抗原特性分析Fig.7 Analysis of purified of BNP
3 讨论
谷氨酸棒状杆菌越来越多的被应用于合成生物学领域表达高附加值的化合物[20],同时也被开发用来表达外源蛋白。外源蛋白在谷氨酸棒状杆菌中表达可分为诱导型胞内表达、组成型胞内表达、诱导型分泌表达、组成型分泌表达几种模式[7-9],本研究利用GFP构建了一套快速探索外源蛋白在谷氨酸棒状杆菌中表达模式的方法,同时利用这套方法探索了BNP蛋白的最适表达模式。
BNP蛋白被广泛运用于体外诊断行业,不经糖基化修饰的BNP反而比糖基化修饰后的BNP具有更好的检测效果[14]。至今尚未有在谷氨酸棒状杆菌中成功表达BNP的相关报道。研究发现,BNP可以在胞内组成型表达,同时也可以分泌形式表达,但分泌表达表达量非常低,组成型分泌表达甚至检测不到BNP的表达(图6)。虽然谷氨酸棒状杆菌具有胞外蛋白酶少的特点,分泌表达将会简化提纯步骤,但就目前的分泌信号肽,启动子,终止子的组合,胞内表达是最理想的表达策略。以后的工作也会继续研究不同的信号肽等表达元件的组合,探寻最佳的分泌表达模式。
BNP蛋白具有分子量小结构简单的特点,等电点分析表明BNP蛋白的等电点为10.95,研究中尝试直接表达BNP蛋白,但检测不到蛋白的表达。SUMO等电点为4.66,多用于融合蛋白的切除,也有报道SUMO具有促进蛋白折叠,促进蛋白可溶的特点[18]。当SUMO与融合BNP蛋白后,融合的蛋白等电点为6.59,偏近中性,推测可能会有助于蛋白的表达。最终结果也表明,BNP融合SUMO后,才可以检测到BNP蛋白的表达,这也为在谷氨酸棒状杆菌中表达高等电点蛋白提供了一种表达思路。
