前蛋白转化酶枯草溶菌素9抑制剂降低血清LDL-C的作用机制及临床疗效
2018-09-05旦菊花李秋霞唐文如
刘 宁,旦菊花,李秋霞,唐文如*
(1.昆明理工大学 医学院 衰老与肿瘤分子遗传学实验室,云南 昆明 650500;2.大理白族自治州人民医院 神经内科, 云南 大理 671000)
动脉粥样硬化心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的发病率逐年升高,研究表明血清低密度脂蛋白胆固醇(low density lipo-protein-cholestero,LDL-C)不仅对动脉粥样硬化斑块形成尤为重要,而且决定此类疾病的预后[1]。大量临床数据显示,LDL-C每降低40 mg/dL,冠心病(CVD)的患病风险将减少22%[2]。尽管他汀类药物降脂效果显著,但是临床应用结果表明部分高风险CVD患者和近50%的家族性胆固醇患者最大剂量使用他汀类药物时,前者存在心血管剩余风险,后者不能达到正常LDL-C水平。此外,他汀类药物存在血糖升高、横纹肌溶解、 肝损伤等不良反应。因此,开发更安全有效的降脂药物具有重要意义。
前蛋白转化酶枯草溶菌素9(proprotein conver-tase subtilisin/kexin type 9,PCSK9)由肝细胞合成并分泌至血浆中, 循环回肝脏后,在肝细胞表面与低密度脂蛋白受体(low density lipoprotein receptor,LDLR)结合,然后护送LDLR到溶酶体降解,机体通过LDLR清除胆固醇的作用因此减弱,最终血浆 LDL-C水平升高,引起动脉粥样硬化及心血管疾病。他汀类药物因激活甾醇调节元件结合蛋白2(sterol regulatory element-binding protein 2,SREBP-2)而上调PCSK9表达,限制了自身的降脂作用[3]。因此,降低PCSK9浓度成为解决这一问题的关键。
本文将对PCSK9调节LDL-C的机制,及目前为止降低PCSK9血清浓度的方案及临床疗效进行综述,旨在为相关领域的研究者提供参考。
1 PCSK9的结构与功能
PCSK9位于1p32.3,片段长度大约为22 kb,结构主要由前体肽、信号肽、催化区域和富含半胱氨酸组氨酸的C端构成[4]。PCSK9主要在内质网合成,在高尔基体中自动催化裂解形成Pro-PCSK9(可溶性酶原)并转化为成熟分泌型PCSK9,分泌并储存在血浆中。
PCSK9的主要功能是调控翻译后LDLR在肝细胞的转运[5]。血浆PCSK9在肝细胞表面通过富含半胱氨酸、组氨酸的C端与LDLR富含半胱氨酸的表皮生长因子A区域结合,通过细胞内吞作用进入细胞的核内体[6]。然后利用细胞内和细胞外两种独立的途径促进溶酶体降解LDLR。细胞内途径用时较短,在反面高尔基体中,PCSK9和新形成的LDLR结合,随后溶酶体靶向PCSK9与LDLR形成的复合体[5]。细胞外途径用时较长,分泌后的PCSK9在血浆中循环,在肝细胞表面与LDLR结合,通过网格蛋白介导的内吞作用被护送到溶酶体。重要的是,PCSK9与LDLR的结合抑制LDLR重循环到细胞表面,增强LDLR在溶酶体的降解,机体清除LDL-C颗粒的作用减弱。PCSK9失功能性突变主要导致它自身的合成、催化裂解、成熟和分泌障碍,使其在血浆中的水平降低,最终引起胆固醇降低[7]。功能获得型突变导致降解LDLR的功能增强,血液LDL-C清除功能减弱,最终血中胆固醇水平升高[8]。因此,抑制 PCSK9的表达或降低PCSK9浓度有望成为降脂治疗的新靶标。
2 他汀类药物调控PCSK9的机制
他汀类药物作为羟甲基戊二酸单酰辅酶 A(HMG-CoA)还原酶的一种竞争性抑制剂,通过降低内源性胆固醇的合成效率,促使甾醇调节元件结合蛋白2(SREBP- 2)激活,继而调控LDLR 和PCSK9的活化。PCSK9的高表达增加肝脏对LDLR基因转录之后的降解作用,机体对胆固醇清除能力减弱,导致LDL-C水平升高[9]。这就是他汀类药物的矛盾所在(图1)。
他汀类药物与PCSK9代谢和分泌的研究结果表明:服用阿托伐他汀40 mg/d,16周后,对比安慰剂组,患者血清PCSK9含量增加34%[10];阿托伐他汀80 mg/d,从第4周开始一直持续到16周,对比安慰剂使用组,患者血清PCSK9水平增加47%。综合结果表明他汀类药物可以使PCSK9浓度增加14%~47%,药效具有剂量依赖性[11]。也有临床数据表明PCSK9血浆水平和2型糖尿病(T2DM)发病率呈正相关[5]。由于他汀类药物可以上调PCSK9水平,因此强化剂量他汀治疗会增加新型糖尿病发生的可能性。这些结果均为进一步限制他汀大剂量使用提供了证据,导致靶向PCSK9单克隆抗体的治疗方法快速发展。目前PCSK9单克隆抗体的代表性药物包括阿利库单抗(Alirocumab)和依伏库单抗(Evolocumab),也称为PCSK9抑制剂。
3 PCSK9抑制剂的临床实验
2009年PCSK9的第一个单克隆抗体mAb1在小鼠和非人类灵长动物体内可以降低近30%的LDL-C水平[12]。之后其他几种具有类似性质的抗体被开发出来,并在猴子体内进行了单独治疗或与他汀类药物联合使用的试验。结果表明PCSK9单克隆抗体通过抑制血浆中PCSK9水平增加,导致LDL-C水平下降20%~50%[13]。这些抗体在灵长类动物体内进行的成功实验开启了临床Ⅰ期、Ⅱ期的测试和试验。
临床Ⅰ期的试验者包括健康的志愿者(LDL-C水平>116 mg/dL)、家族性或者非家族性胆固醇患者。研究比较多的PCSK9单克隆抗体是 Alirocumab和Evolocumab。用Alirocumab治疗的过程中,将家族性胆固醇患者分为两组,1组用他汀药物治疗,另1组通过饮食治疗。结果发现增加 Alirocumab的剂量,他汀药物治疗组LDL-C降低水平可以高达61%[14]。用Evolocumab治疗的过程中, 治疗对象是56名健康的志愿者和57例接受他汀治疗的患者。结果健康组LDL-C水平降低高达64%;他汀治疗组LDL-C水平降低高达81%[15]。研究表明,PCSK9在临床降脂治疗中表现优越,但仍需进一步观察其普适性及不良反应。
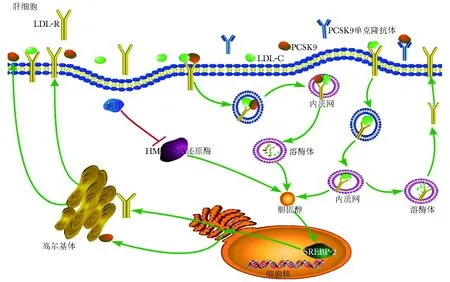
他汀类药物通过竞争性抑制HMG-CoA还原酶,减少胆固醇生成,细胞内胆固醇浓度降低激活SREBP- 2,进一步促进LDLR和PCSK9的表达;PCSK9高表达增加LDLR进入肝脏细胞的降解,从而限制他汀类药物的降脂疗效。PCSK9单克隆抗体可通过与PCSK9结合,减少LDL-R降解。因此他汀类药物与PCSK9单克隆抗体联用可增强机体通过LDLR清除胆固醇的作用(注释:红色箭头代表抑制作用,绿色箭头代表激活作用)
图1他汀类药物、PCSK9以及PCSK9单克隆抗体对胆固醇代谢的作用机制
Fig1Mechanismofstatins,PCSK9andPCSK9monoclonalantibodyoncholesterolmetabolism
临床Ⅱ期针对不同剂量的Alirocumab和 Evolocumab进行试验。Alirocumab治疗分为3个实验组,第1个实验组的患者随机分为2组且给予不同剂量Alirocumab,12周后89%以上的患者LDL-C水平降到100 mg/dL以下,且对该药品具有良好耐受性,不良反应也没有增加[16]。第2个实验组,10与80 mg阿托伐他汀分别与同等剂量Alirocumab联合使用,结果表明阿托伐他汀80 mg对LDL-C水平降低更显著[17]。第3个实验组,Alirocumab分为2组,第1组剂量为150 mg每2周,第2组剂量为100、200、或者300 mg每4周。在这个试验组,80%患者LDL-C水平降到70 mg/dL以下[18]。此外,对比高胆固醇患者用药Alirocumab、阿托伐他汀及安慰剂的疗效以目标值LDL-C<70 mg/dL为准,结果Alirocumab组约90%的患者可以达到,阿托伐他汀及安慰剂组仅为17%。证实Alirocumab较他汀类药物对高胆固醇患者降脂效果更好[19](表1)。
针对 Evolocumab疗效的临床Ⅱ期,根据患者的血清LDL-C水平及其他影响LDL-C血清浓度的情况将其分为5个实验组。LAPLACE-TIMI 57实验组探索了不同给药方式及不同剂量的Evolocumab对LDL-C的影响。每2周的最高用药量140 mg和每4周的最高用药量420 mg,服药1周后,对LDL-C浓度分别降低为85.0%和70.4%[20]。第12周后,没有证据表明AMG 145的剂量或用药方式与LDL-C的浓度和不良事件有关联[20]。MENDEL实验组针对未接受他汀治疗的患者,随机给药Evolocumab、依折麦布或者安慰剂。结果表明Evolocumab降脂效果更好,并且没有严重的治疗相关的不良事件发生[21]。GAUSS实验组为他汀耐受性患者,结果显示单独使用Evolocumab组,54%患者LDL-C水平降到100 mg/dL以下,18%患者LDL-C水平降到70 mg/dL以下;Evolocumab+依折麦布组,90%患者LDL-C水平降到100 mg/dL以下,62%患者LDL-C水平降到70 mg/dL以下[22]。RUTHERFORD实验组,比较Evolocumab 350 mg每4周和420 mg每4周的治疗效果。12周后,Evolocumab 420 mg每4周的效果更为显著。其中89%的病人LDL-C水平降到100 mg/dL以下,65%患者LDL-C水平降到70 mg/dL以下[23]。YUKAWA实验组,针对不同剂量且不同用药频率的高风险心血管患者,实验结果表明高剂量的Evolocumab用药LDL-C降低水平更为显著,并且96%以上的高风险患者LDL-C水平降到70 mg/dL以下[24]。

表1 阿利库单抗和依伏库单抗的临床Ⅱ期实验Table 1 Phase Ⅱ clinical trials of Alirocumab and Evolocumab
缩写: Ali=阿利库单抗; Evo=依伏库单抗; Q2W=2周1次; Q4W=4周1次; QM=每月1次.
临床Ⅱ期结果表明,PCSK9单克隆抗体单独使用或者与他汀药物联用都可以大幅度降低LDL-C水平,并且其降脂的效率具有剂量依耐性和短期耐受性。针对Evolocumab 和Alirocumab在不同患者中的降脂水平不同,Ⅲ期做了一系列临床实验。结果表明:在家族性胆固醇患者中,Alirocumab和Evolocumab对LDL-C的降低水平分别为45.0%~47.2%和56.1%~57.0%[25];在他汀耐受型患者中Alirocumab和Evolocumab对LDL-C的降低水平分别为45.0% 和55.3%~ 56.1%[25];在心血管高风险患者群体中,Alirocumab和Evolocumab对LDL-C的降低水平分别为44.1%~61.0%和55.7%~75.9%[25];此外,Evolocumab的临床降脂效果更显著且更适用于家族性高胆固醇患者的治疗;而对于最大剂量耐受他汀的患者,给药Alirocumab不但可以降低LDL-C水平,还可以减少心血管的发病风险;这些结果为临床推广Alirocumab和Evolocumab降低LDL-C水平打下坚实基础。
4 问题与展望
PCSK9抑制剂通过靶向PCSK9,抑制PCSK9与LDLR结合,增加LDLR的重循环数目而达到清除更多LDL颗粒的目的。对此降低LDL-C的新药受到广泛关注,主要包括单克隆抗体(mAB)、反义寡核苷酸、小干扰RNA、抑制性抗体模拟物及EGF-A模拟性多肽。其中,单克隆抗体的临床研究结果表明:PCSK9抑制剂作为一种新型高效降低LDL-C水平的药物具有降脂效率高、耐受性好、安全且适用人群广的特点。临床实践指南已经采用了PCSK9单克隆抗体阿利库单抗(Alirocumab)和依伏库单抗(Evolocumab),但考虑到成本和效益的问题,目前仅用于最大剂量他汀使用不能达到正常水平的患者、他汀不耐受性个体以及家族性高胆固醇患者。
值得注意的是:1)PCSK9基因的单核苷酸多态性与血清LDL-C水平和冠心病的发病风险均有关联。2)ApoB和PCSK9的基因变异在极低水平LDL-C患者中也较常见。所以随着对脂质基因结构的理解,高通量测序技术的发展,精准医学的兴起,基因诊断治疗应该运用于临床,通过鉴定人群中新的脂质相关基因突变体,可以为临床提供重要的新型药物靶标,进而提高疾病的预后,使治疗手段更为有效。
