白杨素减轻机械性创伤导致的大鼠继发性心肌损伤
2018-09-05肖慧玉李秀杰陈菲凡张非凡刘丽红于德钦李树壮
肖慧玉,李秀杰,陈菲凡,李 静,张非凡,刘丽红,于德钦,李树壮
(大连医科大学 生理学教研室,辽宁 大连 116044)
近年来,随着工业发展,机械性创伤(mechanical trauma, MT)引起了人们的广泛关注。国家统计局官方数据表明,2015年中国发生交通事故187 781起,其中死亡率高达30%。心脏作为人类生存的重要器官之一,MT可以引起心肌细胞凋亡[1],进而引发的继发性心功能障碍严重影响受伤患者的生命和生活质量[2]。前期研究发现TNF-α的过量产生、细胞内氧化应激和Ca2+浓度变化都会导致心肌继发性损伤。凋亡细胞在创伤后一段时间内随时间的延长而增多[3],因此临床上尽早采取措施阻断细胞凋亡具有重要意义。
白杨素(chrysin)是一种天然黄酮类化合物,它主要存在于蜂胶和西番莲属植物中。大量研究表明,白杨素可以促使TNF-α介导肿瘤细胞凋亡和抑制病态血管形成从而发挥抗肿瘤作用[4]。白杨素还具有多种生物活性,如抑制细胞增殖[5]和抗高血压[6]。本研究旨在阐明白杨素在TNF-α和活性氧(reactive oxygen species, ROS)介导MT中能否抑制心肌细胞凋亡和发挥心脏保护功能,并对其潜在的机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级SD大鼠20只,雄鼠,体质量180~220 g[大连医科大学实验动物中心,合格证:SCXK(辽)2008- 0002]。
1.1.2 主要试剂:大鼠心肌细胞系(H9c2)、人单核细胞系(THP- 1)(中国医学科学研究院基础医学研究所细胞资源中心);白杨素(大连美仑有限公司,单体纯度:99.3%);TNF-α(Sigma-Aldrich公司);DMEM高糖培养基(Hyclone公司);胎牛血清和胰蛋白酶(Gibco公司);MTT 细胞增殖及毒性检测试剂盒、TUNEL细胞凋亡检测试剂盒和ROS 检测试剂盒(碧云天生物技术研究所);Fluo4-AM(Dojindo同仁化学研究所)。
1.2 实验方法
1.2.1 大鼠分组及处理:将大鼠分为对照组、创伤组(参照制备MT模型文献[7])、创伤给药组(创伤前0.5 h腹腔注射白杨素溶液20 mg/kg)和创伤溶剂组(创伤前0.5 h腹腔注射与药物溶液等体积的DMSO),每组5只,先后进行在体和离体实验。
1.2.2 大鼠血流动力学参数检测:创伤后12 h,麻醉大鼠,沿右颈总动脉插管(PE50)至左心室,用TM_WAVE系统记录左心室心功能参数:左心室收缩压(LVSP)、左心室舒张末期压(LVEDP)、平均动脉压(MAP)、左心室内压最大上升速率(+dP/dTmax)和左心室内压最大下降速率(-dP/dTmax)等指标。计算左心室发展压(LVDP=LVSP-LVEDP),并对以上数据进行统计学分析。
1.2.3 细胞培养及分组:H9c2细胞:DMEM高糖培养基中加入10% 胎牛血清,4 mmol/L谷氨酰胺,105U/L青链霉素,细胞铺于平皿内,在37 ℃含5% CO2的细胞孵箱中培养。2~3 d换液,细胞增殖至汇合度为70%~80%时进行传代,传代至7~13代间,细胞处于对数增殖期时,进行试验。THP- 1细胞采用1640培养基,其余步骤同上。
不同浓度白杨素对正常H9c2 细胞影响实验分为空白组、对照组和给药组。空白组只需加MTT,对照组不做特殊处理,给药组在加入MTT之前给予含有0.1%不同药物浓度的培养基处理。TNF-α作用下不同浓度白杨素对细胞的影响实验分为空白组、对照组、TNF-α组和白杨素药物保护组。ELISA检测TNF-α:在体实验分为对照组、创伤组、创伤药物干预组和创伤溶剂组(n=5);离体实验分为对照组、脂多糖LPS组、LPS+药物干预组和LPS药物溶剂组;THP- 1细胞对照组不予特殊处理;LPS组为THP- 1细胞中加入LPS(1 mg/L);药物干预组和溶剂组为药物和溶剂作用0.5 h后,再加入LPS(1 mg/L)。ROS的检测实验中THP- 1细胞分组及处理同ELISA检测TNF-α的离体实验;H9c2贴壁细胞样本分为对照组、TNF-α组、TNF-α+药物干预组、TNF-α溶剂组,药物和溶剂组作用0.5 h后,加入TNF-α(10 μg/L)。
1.2.4 细胞存活率的检测:用MTT比色法检测细胞存活率。细胞活力/%=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。TNF-α作用下不同浓度白杨素对细胞的影响实验在加入MTT前,每孔加入TNF-α(10 μg/L),孵育12 h,其余步骤同上。
1.2.5 原位缺口末端标记法(TUNEL)检测细胞凋亡:术后24 h取左心室壁心肌组织,4%多聚甲醛常温固定包埋,制成冰冻切片,后续步骤按说明书进行。计算时每张切片随机选取10个视野,每视野计数 100个细胞,以TUNEL染色阳性的凋亡细胞占所有被计数的心肌细胞的百分比作为凋亡指数。
1.2.6 ELISA检测TNF-α:创伤完毕1.5 h后,麻醉大鼠,取心尖血1.5 mL于离心管(事先加入1%肝素50 μL)中,室温静置30 min,离心,取上清,ELISA检测TNF-α。操作参照试剂盒说明书。在450 nm下测量A值,计算出样品浓度。
1.2.7 ROS的检测:THP- 1细胞处理12 h后,按说明装载探针,各组分别收集离心,取上清,用荧光酶标仪488 nm激发波长,525 nm发射波长检测荧光强度。装载DFCH-DA活性氧探针,测定各组活性氧的A值。H9c2 细胞处理6 h后按上述步骤检测。
1.2.8 激光共聚焦显微镜观察大鼠心肌细胞内Ca2+浓度:激光共聚焦显微镜下以494 nm波长激发,516 nm波长发射,使用油镜,放大倍数为63倍,观察大鼠心肌细胞内Ca2+浓度。每隔10 s拍摄图像,记录15 min。得到的细胞钙荧光图像用Image-Pro Plus 6.0软件进行分析。
1.3 统计学分析
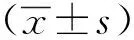
2 结果
2.1 白杨素对创伤后大鼠血流动力学参数的影响
本组前期工作发现,随着创伤程度增大,心肌细胞凋亡数目也逐渐增加,而200 r/min能造成大鼠非致死性且比较理想的创伤,故用此于后续实验。对照组和创伤组大鼠的心室舒缩功能见图 1所述。
相比于对照组,创伤组LVDP、MAP、+dP/dTmax和-dP/dTmax均明显下降(P<0.01),在给予白杨素后心功能各指标较创伤组明显上升(P<0.01)(图 1)。
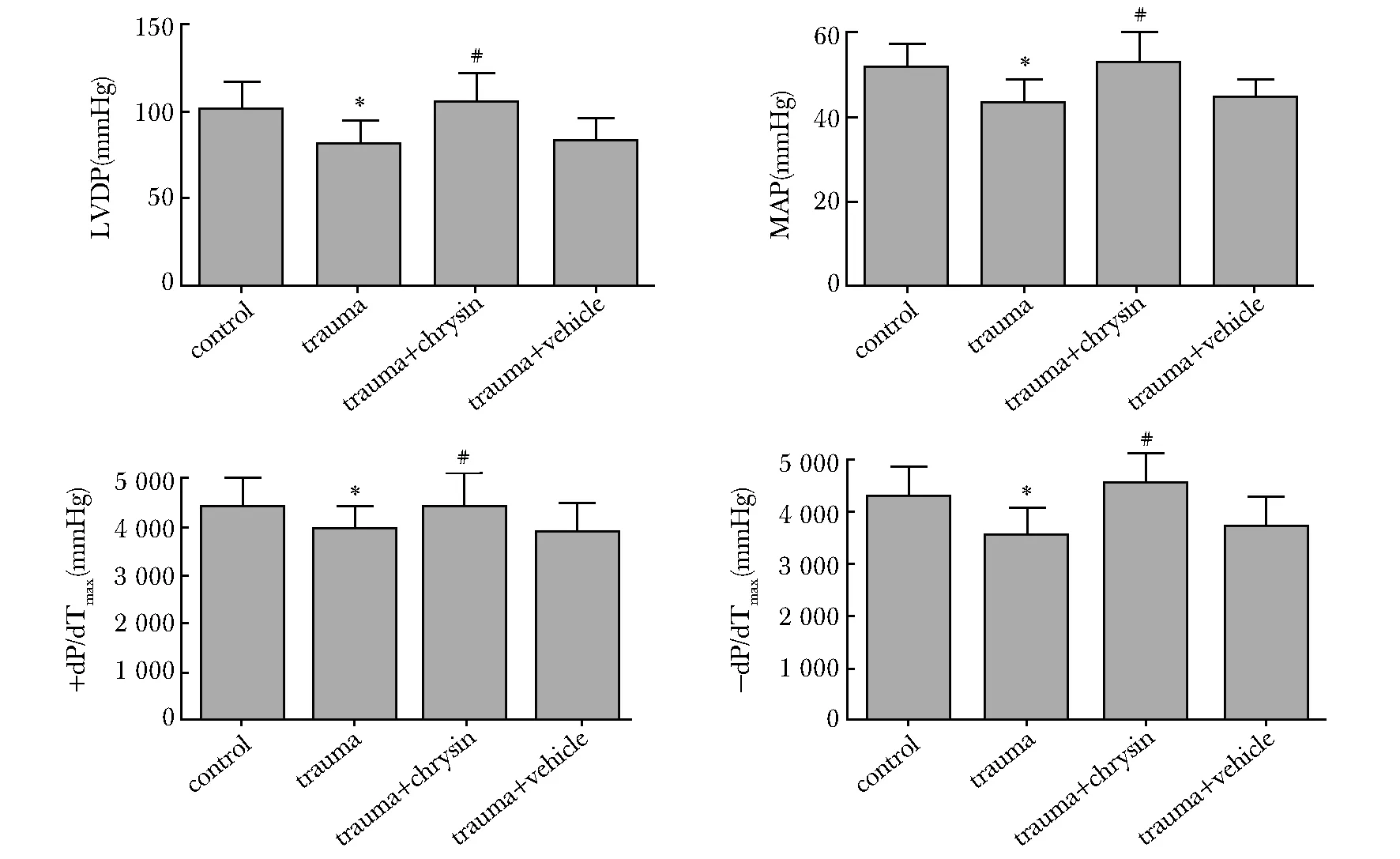
2.2 白杨素对创伤后心肌组织细胞凋亡的影响
创伤组、创伤给药组和创伤溶剂组凋亡指数与对照组相比均明显升高(P<0.01)。与创伤组相比,创伤给药组凋亡指数明显下降(P<0.01)(图 2)。
2.3 细胞实验确定白杨素药物浓度
20、40和80 μmol/L的白杨素药物浓度作用下细胞存活率分别下降了3%、7%和15%(图 3)。与对照组相比,TNF-α组的细胞存活率明显下降(P<0.01),各个药物干预组细胞存活率均上升(P<0.01)(图 4)。对正常心肌细胞没有毒性且在创伤因子TNF-α诱导下又对细胞起保护作用的白杨素药物浓度为10 μmol/L。
2.4 白杨素对单核细胞和细胞系THP-1 TNF-α释放的影响
在体实验中,与对照组相比,创伤组血浆中TNF-α的水平明显上升(P<0.01),但创伤给药组TNF-α的含量较创伤组明显下降(P<0.01)(图5A)。
细胞实验中,结果与在体实验一致(图5B)。
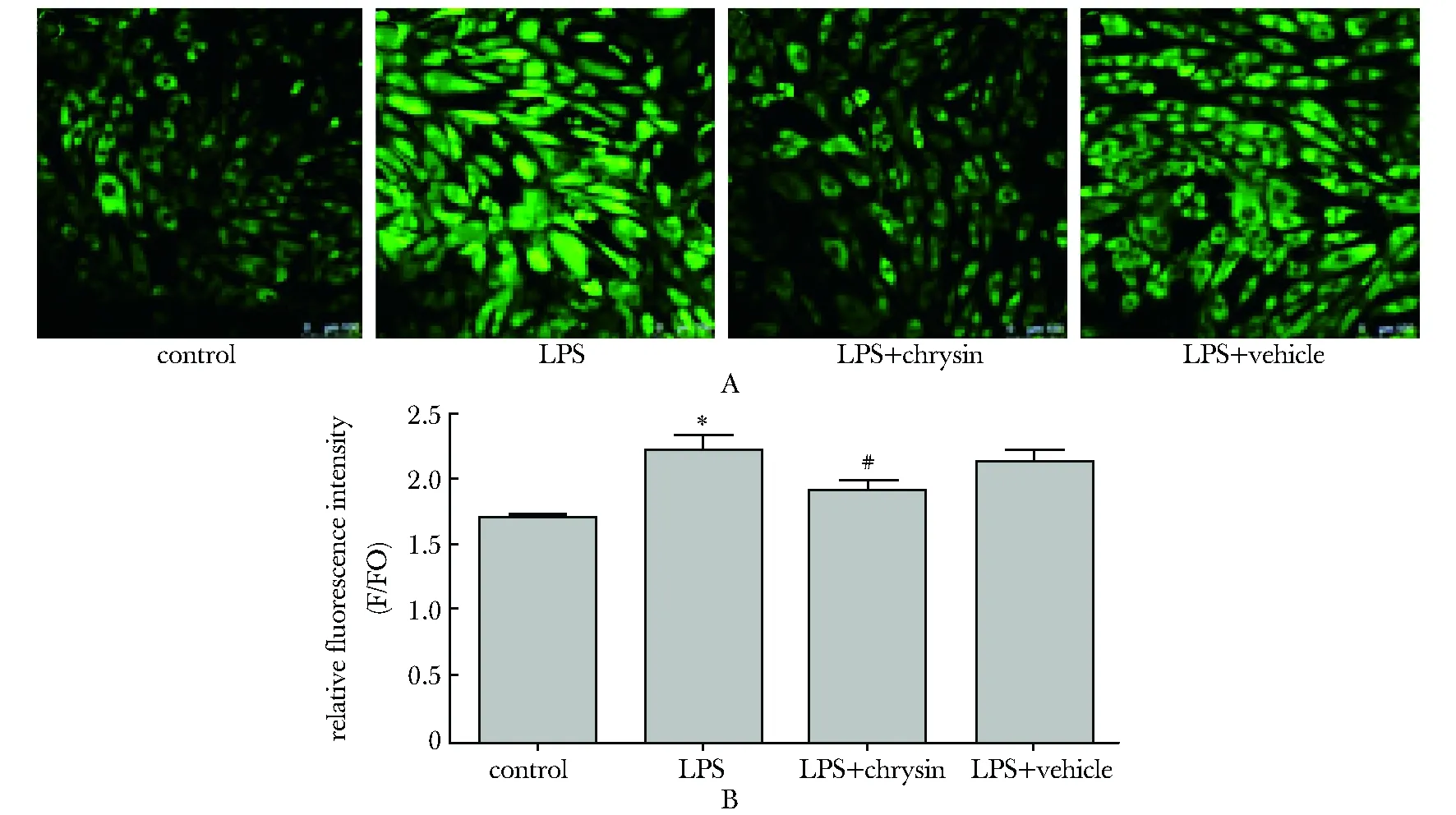
2.5 白杨素对细胞内ROS水平的影响
在LPS刺激THP- 1创伤模型中,与对照组相比,LPS组ROS荧光强度显著上升(P<0.01)。LPS+白杨素组与LPS组相比ROS含量明显下降(P<0.01)(图 6A)。
在TNF-α刺激H9c2创伤模型中,结果与上述一致(图 6B)。
*P<0.01 compared with control group; #P<0.01 compared with trauma group图1 白杨素对创伤后大鼠血流动力学参数的影响Fig 1 Effect of chrysin on hemodynamic parameters following MT-induced myocardial injury
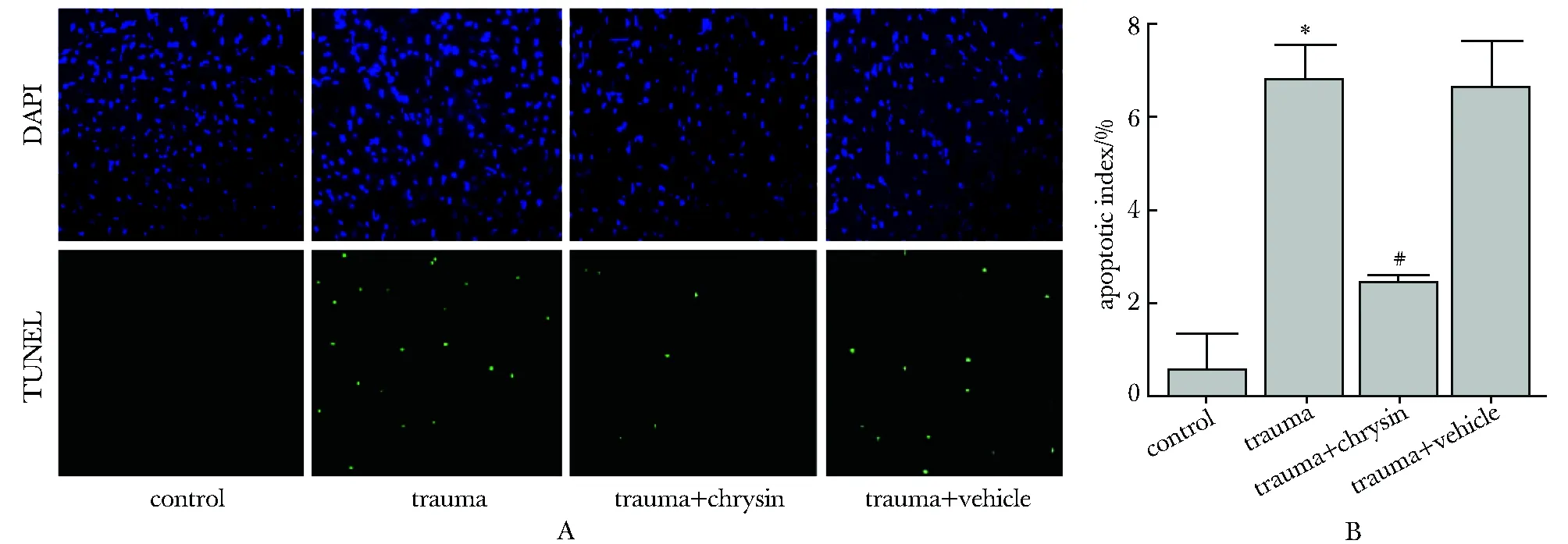

图2白杨素对创伤后心肌组织细胞凋亡的影响
Fig2EffectofchrysinontheapoptosisofcardiacmusclecellsfollowingMT-inducedinjury
2.6 白杨素对创伤引起的心肌细胞内钙离子浓度变化的影响
创伤组和创伤溶剂组,较对照组明显上升(P<0.01),而创伤给药组与创伤组相比,Ca2+浓度明显下降(P<0.01)(图7)。
3 讨论
随着当今的医疗卫生条件的逐年提升,创伤造成的直接性损伤可以得到很好的控制,但创伤后造成的MODS已经成为影响创伤病人生存率和生活质量的主要因素[8]。因此, 寻找预防治疗继发性损伤的药物是亟待解决的问题。
*P<0.05,#P<0.01 compared with control group图3 不同浓度白杨素作用下H9c2细胞的存活率Fig 3 Viability of H9c2 cells in different chrysin levels

*P<0.01 compared with control cells; #P<0.01compared with TNF-α-treated cells图4 TNF-α诱导不同浓度白杨素作用下H9c2细胞的存活率Fig 4 Viability of TNF-α-induced H9c2 cells in different chrysin n=5)

A.effect of chrysin on TNF-α levels in plasma of trauma group;*P<0.01 compared with control;#P<0.01 compared with trauma group; B.effect of chrysin on LPS-induced TNF-α levels in THP- 1 cells;*P<0.01 compared with control cells;#P<0.01 compared with LPS-treated cells


A:fluorescence intensity in LPS-induced THP- 1 cells,*P<0.01 compared with control cells,#P<0.01 compared with LPS-treated cells; B:fluorescence intensity in LPS-induced H9c2 cells,*P<0.01 compared with control cells,#P<0.01 compared with LPS-treated cells
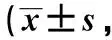
A.confocal image (×63 objective, NA1.4, oil immersion)showing Ca2+labeling; B.Ca2+fluorescence intensity of each group;*P<0.01 compared with control;#P<0.01 compared with LPS-treated cells

在本次实验中发现MT后给予白杨素,心功能指标明显上升,心肌细胞凋亡指数显著下降,表明白杨素能够有效改善心功能紊乱。大量的实验证明TNF-α是引起风心病[9]和慢性心衰竭[10]等心功能紊乱的关键因素。同时有研究发现MT后引起心肌细胞凋亡的关键因子也是TNF-α,其中的主要机制为caspase- 8和caspase- 3的激活,以及ROS的大量产生[11],心肌细胞凋亡后进而导致心功能紊乱。本研究表明白杨素对TNF-α诱导下细胞的存活起保护作用。ELISA检测结果显示:与其它组相比,药物干预组TNF-α释放显著降低;荧光检测结果显示:药物干预组较其它组ROS的产生明显减少。提示白杨素能抑制TNF-α释放、ROS的产生从而减少心肌细胞凋亡。
氧化应激与细胞内Ca2+的相互关系对心肌损伤的影响也是非常重要的。在本次实验中机械创伤可导致细胞内Ca2+浓度的升高,而白杨素可以降低细胞内Ca2+的增多。而其中的机制是因为白杨素具有缓解钙超载和抗氧化应激的作用[12]。
本实验中应用H9c2细胞系和THP- 1细胞系代替整体动物分离的细胞,是因为整体动物分离得到的心肌细胞受技术和操作等方面的影响更大,稳定性不如H9c2细胞系。基于前期研究发现,TNF-α主要来自单核细胞。因此本实验采用THP- 1细胞系,便于研究TNF-α的释放。
综上所述,白杨素可以通过抗氧化作用和降低细胞内钙超载来改善TNF-α介导的心肌细胞损伤,从而发挥创伤后心脏保护的作用,这为临床防治机械性创伤导致的继发性心肌损伤和MODS提供新的研究策略。但是对于氧化应激相关分子机制探讨还存在一定的局限性,仍需要进一步的工作来深入探讨。
