中性粒/淋巴细胞的比值和预后营养指数在食管鳞癌患者预后评估的应用
2018-09-05方炎鑫张仁泉黄云龙吴开明
方炎鑫,张仁泉,黄云龙,姚 龙,吴开明
随着全球食管癌患者人数逐年增高,其发病率目前位居全球恶性肿瘤第八位,死亡率位居第六位[1],我国每年因食管癌所致死亡的人数已超过20万人[2]。尽管近年来食管癌的诊治水平在不断提高,但患者的预后仍不尽人意。因此寻找有效的食管癌预后指标,更好地反应患者预后,有助于临床制定个体化治疗方案。目前认为,全身炎症反应和营养不良与恶性肿瘤的术后密切相关[3]。中性粒/淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)是外周血中性粒细胞和淋巴细胞的比率,作为系统性炎症指标之一,已经证实与多种恶性肿瘤的术后预后密切相关[4-6]。预后营养指数(prognostic nutritional index, PNI)是基于营养和免疫状况的评分系统,最初用来评估手术前营养状况、手术风险及相关术后并发症,现多个研究证实PNI 与肝癌[7]、结直肠癌[8]、胃癌[9]预后密切相关。该研究联合检测NLR和PNI并探讨其与腔镜下食管鳞癌患者预后的关系。
1 材料与方法
1.1病例资料回顾性分析2010年10月~2012年4月在安徽医科大学第一附属医院普胸外科住院并行食管癌根治术的患者118例。病例中选标准:① 经过病理科证实为食管鳞癌;② 术前未行放化疗;③ 入院前无感染病史和血液性疾病。排除标准:① 近期有输血史及临床资料不全者;② 无随访记录者;③ 围手术期存在严重并发症和死亡病例者。结果共有103例患者纳入本研究,其中男81例,女22例,年龄45~81(61.80±7.056)岁。搜集所有入选病例的一般资料:性别、年龄、肿瘤位置、肿瘤大小、侵袭深度、淋巴结转移数、术前一周内外周血中性粒细胞总数、淋巴细胞总数、血清白蛋白结果以及总生存时间。入选的所有病例从住院开始随访,术后第1~2年每1~3个月随访1次,其后至第5年内每3~6个月随访1次,5年后则按照每年随访1次。生存时间开始日期设定为手术日期时间,终点日期则定为患者死亡日期或者最后一次随访时间。随访截止日期为2017年4月。
1.2计算方法通过将患者手术前一周以内血常规及生化检测结果按照以下公式计算进行分组:NLR=外周血中性粒细胞总数/淋巴细胞总数;PNI=血清白蛋白(g/L)+5×外周血淋巴细胞总数(×109/L)。根据NLR及PNI的分布特征进行分组,NLR的分布为偏态(P<0.05),依其中位数分为高NLR组(≥2.21)和低NLR组(<2.21);PNI的分布为正态分布(P=0.186),依其均数分为高PNI组(≥44.56)和低PNI组(<44.56)。
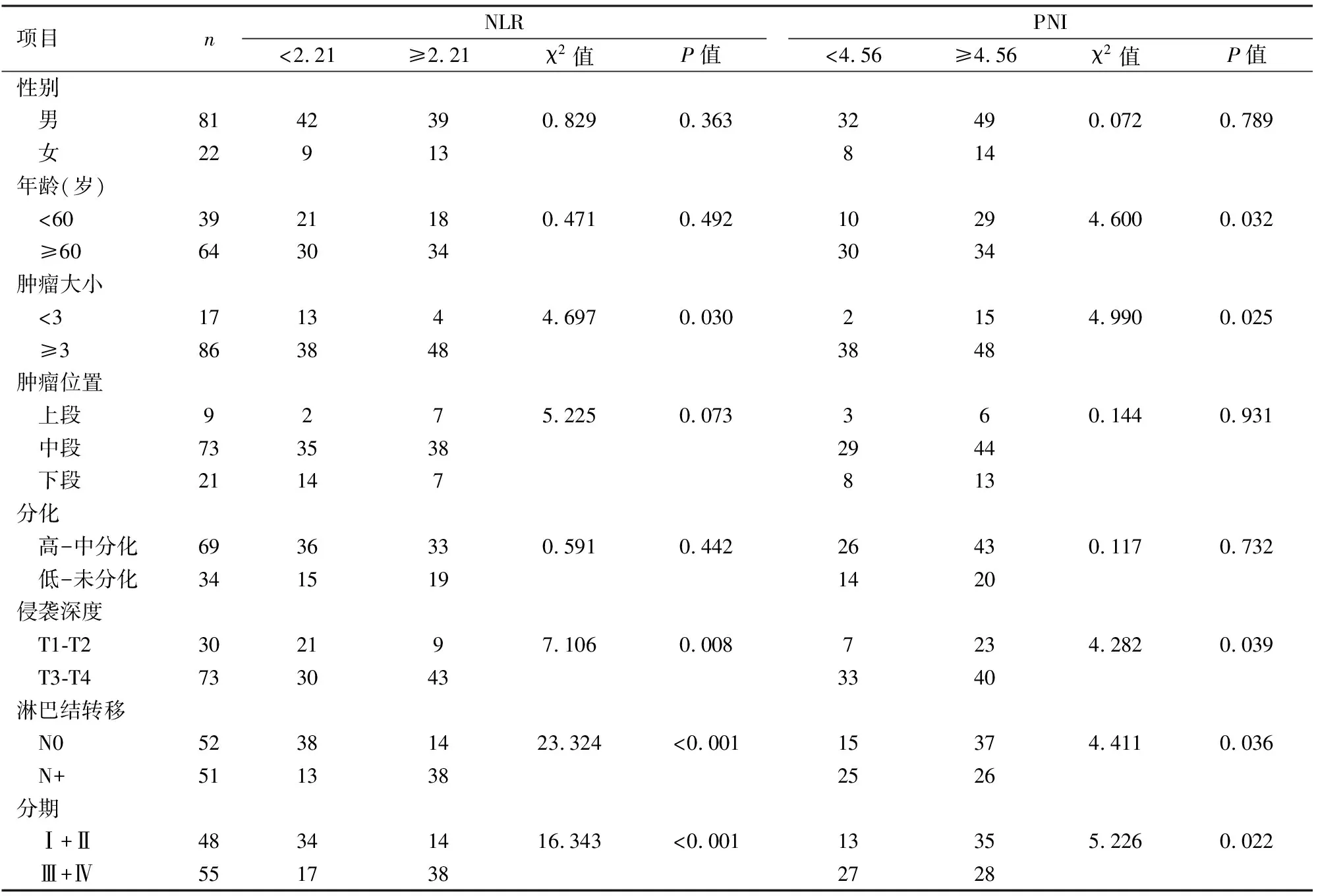
表1 根据NLR和PNI分组后的临床特征(n)
1.3统计学处理采用SPSS 17.0软件进行数据分析。其中计数资料比较采用χ2检验。生存曲线采用Kaplan-Meier法构建,组间比较采用Log-rank法检验,小样本率的比较采用Fisher精确概率法。单因素分析和多因素分析采用Cox比例风险模型,以P<0.05表示差异有统计学意义。
2 结果
2.1食管癌患者临床病理特征与不同NLR组和PNI组的关系随访的103例食管癌患者中,男81例(78.6%),女22例(21.4%),男女比例3.68 ∶1。术前NLR两组之间以及PNI两组之间的年龄、性别、肿瘤位置、分化的差异经χ2检验均无统计学意义(P>0.05);而在肿瘤大小,侵袭深度、有无淋巴结转移的差异NLR两组和PNI两组之间比较均有统计学意义(P<0.05)。见表1。
2.2总生存率的单因素及多因素分析该研究随访时间长达2~80个月,经单样本Kolmogorov-Smirnov正态分布检验近似正态分布,平均生存时间是(40.41±25.02)个月,中位生存时间为34.3个月。1、3、5年的总生存率分别是81.56%、49.51%、31.06%。术前高NLR组患者3年生存率和5年生存率分别为34%和15%,术前低NLR组患者3年生存率和5年生存率分别是68%和43%。术前高PNI组患者3年和5年生存率分别是66%和41%,术前低PNI组患者3年和5年生存率分别是30%和17%。采用Kaplan-Meier法分别构建NLR高低组、PNI高低组以及分期高低组生存曲线,经Log-rank检验,低NLR组累积生存率明显高于高NLR组,高PNI组累积生存率显著高于低PNI组,Ⅰ~Ⅱ期患者累积生存率优于Ⅲ~Ⅳ期患者。见图1~3。

表2 COX单因素和多因素分析结果
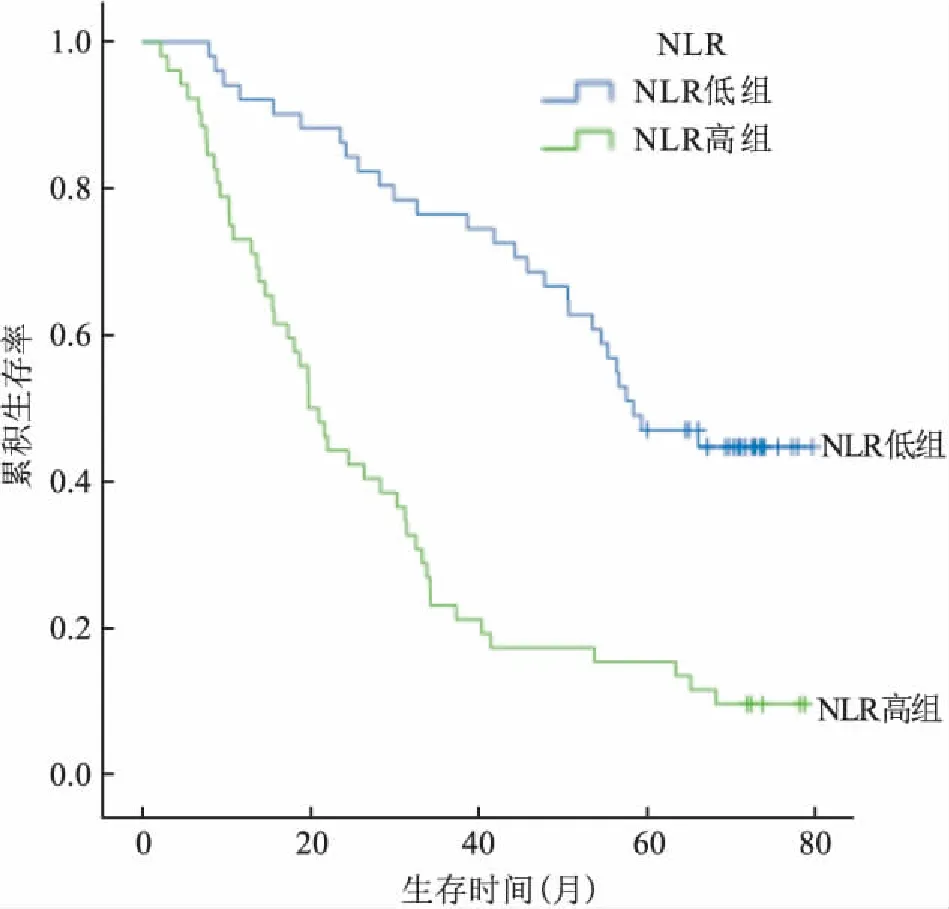
图1 NLR高低组生存曲线图

图2 PNI高低组生存曲线图
经由Cox比例风险模型单因素分析显示,肿瘤大小(HR=0.306,95%CI: 0.140~0.668,P=0.003)、分化程度(HR=0.594,95%CI:0.373~0.948,P=0.029)、TNM分期(HR=0.317,95%CI:0.194~0.517,P<0.001)、NLR(HR=0.294,95%CI:0.182~0.474,P<0.001)和PNI(HR=2.887,95%CI:1.821~4.576,P<0.001)与患者食管癌术后的总生存率有着密切关系(P<0.05)。将单因素分析有意义的变量纳入多因素分析模型,通过Cox多因素分析显示,术前NLR(HR=0.562,95%CI:0.324~0.975,P=0.04)、PNI(HR=1.877,95%CI:1.125~3.129,P=0.016)和TNM分期(HR=0.444,95%CI:0.262~0.753,P=0.003)是食管癌患者术后总生存率的独立预后危险因素(P值均<0.05)。见表2。

图3 分期高低组生存曲线图
3 讨论
近年来,利用炎症反应生物标志物判断肿瘤患者预后或指导治疗方案是目前不断寻求探索的方向之一。目前,越来越多的研究[10]证实肿瘤的产生和发展与机体的炎症反应密切相关。NLR作为系统性炎症反应指标之一,虽然已被表明与多种恶性肿瘤预后有关,但在食管癌中尤其是食管鳞癌中作用尚不明确。Rashid et al[11]发现术前NLR(≥3.5)升高与患者总生存期并无相关性。Sharaiha et al[12]在分析了295例食管癌(包括220例腺癌)患者中,NLR增高(≥5.0)患者的术后总生存期及无病生存期均较差。在本次研究中,调查了103例食管癌患者术前血液学检查并通过计算得出NLR值,通过比较显示,NLR高组患者较低组更容易出现淋巴结转移,分期更晚,预后较差。这与Feng et al[13]等的发现相一致。这可能是因为全身炎症反应过程可使炎性细胞因子和炎性介质异常释放,从而产生适合肿瘤生存生长的微环境。肿瘤炎症微环境可通过促进肿瘤细胞增殖、提高肿瘤细胞活动与侵犯能力、诱导肿瘤血管生成、抑制机体抗肿瘤免疫反应等多种途径,促进肿瘤的产生、增殖和转移。此外,在炎症反应中中性粒细胞可被激活,一方面使得中性粒细胞分泌白细胞介素-18、肿瘤坏死因子以及血管内皮生长因子等增多,导致DNA损伤并促进新的血管生成,激发了肿瘤的增殖和转移[14-15],另一方面,系统炎症可降低机体CD4+T淋巴细胞能力和抑制CD8+T淋巴细胞的增加[16],使肿瘤细胞获得免疫逃逸,机体细胞免疫应答能力减弱,抗肿瘤能力下降,使患者预后较差。因此,NLR作为系统性炎症反应的有效指标之一,能够反映机体外周血中性粒细胞和淋巴细胞的相对变化,可反映机体促肿瘤和抗肿瘤的动态平衡状态,影响患者的预后。
PNI是由Buzby et al[17]通过测量血清白蛋白、三角肌皮皱厚度、血清运铁蛋白和迟发性超敏皮试反应,运用公式PNI=158-16.6×血清白蛋白-0.78×三角肌皮皱厚度-0.20×血清运铁蛋白-5.80×迟发性超敏皮试反应得出PNI值,主要用来评估患者手术治疗后的复发率及死亡率风险。后来由于当时的计算公式复杂,资料的获取影响因素较大没有得到推广,1984年经日本学者Onodera et al[18]修改并验证后,根据血清白蛋白和淋巴细胞计数两项指标计算,用来评价患者营养状况和手术风险的预测指标。PNI是通过对食管癌患者术前抽取外周血进行生化及血常规检查,由血清白蛋白总量和外周血淋巴细胞计数得出。从临床意义上分析,血清白蛋白是人体总蛋白的主要蛋白质成分,是血浆的重要组成部分,维持血浆胶体渗透压,由于长期的营养摄入不足或者慢性消耗性疾病可导致其下降。淋巴细胞既可以反映营养状况又是机体免疫功能的重要参数,综合这两个指标,PNI可反映机体的营养状况和免疫功能。本研究中,PNI高低上差异均有统计学意义,这与Nozoe et al[19-20]在食管癌和胃癌中的研究发现相一致。另外,本研究显示PNI指数与肿瘤大小有关(P=0.025)。推测这可能是肿瘤越大,尤其是发生远处转移之后,消耗了大量的热量和蛋白质,再加上术前因为进食通道的梗阻而只能进食软食或者流食,进一步影响营养的摄入,机体就会处于负营养状态即分解代谢状态,大量消耗分解自身的蛋白质和脂肪,致使机体的营养状态恶化。此外,本研究还显示PNI指数和年龄密切相关(P=0.032)。而年龄较大的人,本身各个脏器功能降低,胃肠道的营养吸收、肝脏蛋白的合成能力等均下降,经受肿瘤组织的过度增长,对机体的营养过度消耗,使营养状况进一步恶化。 PNI不仅在食管鳞癌中与预后密切相关,在食管腺癌中同样证实影响患者预后。王岩 等[21]在研究中发现食管腺癌患者PNI高组和低组1年、3年、5年生存率分别是100%、85.4%、24.4%和82.3%、26.6%、0,两者之间差异有统计学意义(P<0.001)。并且对不同年龄组进行了分层分析,结果显示PNI是食管腺癌老年患者唯一的独立预后影响因素。
