不同方法制备富血小板血浆对兔脂肪干细胞增殖和成骨分化能力的影响
2018-09-05胡育瑄何家才
胡育瑄,何家才,2
富血小板血浆(platelet-rich plasma,PRP)是利用梯度离心原理从自体全血中离心获得的血小板浓缩物,在特定的物理因素或激活剂条件下能被激活并释放多种细胞因子,这些细胞因子能够促进多种细胞的增殖、迁移和分化,并参与新生血管的形成以及骨的再生;PRP被激活后呈凝胶状,可以为细胞生长提供天然支架,为组织的再生创造良好的微环境。不同的制备方法会影响PRP中血小板以及生长因子的浓度,影响其最终作用效果。脂肪干细胞(adipose-derived stem cells,ADSCs)是来源于脂肪组织的具有多种分化潜能的间充质干细胞。自体ADSCs来源丰富,取材方法简单易掌握,常作为组织工程技术中的种子细胞。该研究首先分别应用3种方法制备PRP,对比PRP产物中血小板浓度以及血小板回收率的区别;然后将PRP和ADSCs共培养,探讨PRP对ADSCs增殖和成骨分化的影响,以及PRP+ADSCs复合材料用于组织工程技术的可行性,为以后的临床应用奠定基础。
1 材料与方法
1.1实验动物与材料健康新西兰大白兔3只,兔龄4个月,雄性,体质量1.5~2 kg;CD44、CD90(美国BD Pharmingen公司);CCK-8试剂盒 (江苏碧云天生物有限公司); 油红O(美国Sigma公司); 茜素红染色液(北京百奥莱博科技有限公司); 碱性磷酸酶(alkaline phosphatase,ALP)显色试剂盒、对甲苯胺蓝(5-bromo-4-chloro-3-indolyl phosphate p-toluidine salt,BCIP)、ALP定量试剂盒(南京建成生物工程研究所); RT-PCR试剂盒(日本TaKaRa公司)。
1.2方法
1.2.1PRP的制备与分析 新西兰大白兔术前臀部肌注速眠新Ⅱ注射液(0.1 ml/kg),其体动反应消失后臀部肌注2%戊巴比妥钠(1 ml/kg)。抽取适量兔耳中央动脉血,立即注入采血管内,并以1 ∶9的比例加入抗凝剂。
1.2.1.1二次离心法制备PRP 将10 ml全血样转移到15 ml离心管,1 000 r/min离心15 min,缓慢吸取上清液及交界面下3 mm红细胞移至新的离心管内,3 000 r/min离心10 min样品分为3层,用吸管慢慢弃去3/4的上清液,保留下方的1 ml,轻轻震荡后得到未激活的PRP。
1.2.1.3Tubex改良法制备PRP 取10 ml全血注入Tubex装置内,小心拧紧装置,2 500 r/min离心10 min,拧紧分离装置后将其垂直倒置装置,3 000 r/min离心10 min,观察到血样分为3层。使用专用注射器由上向下吸取,最下面的1 ml即为PRP。
取上述全血以及3种离心方法制备的PRP各20 μl,加入血小板稀释液配成400 μl悬液,充分混匀,液体变透明后吸取15 μl 加入血细胞计数池,静置10 min 后在高倍镜下进行观察计数。将得到的结果按照以下公式进行计算,血小板富集系数:血小板富集系数(%)=PRP血小板浓度×PRP体积/(全血血小板浓度×全血血体积)×100%。
1.2.2ADSCs分离培养与鉴定
1.2.2.1ADSCs分离 动物麻醉方法同前。术区局部消毒,无菌条件下,切取兔腹股沟处的脂肪组织,放于含1%双抗的PBS中。在超净工作台内,使用无菌PBS反复冲洗组织块,在15 ml离心管中使用无菌眼科剪将组织块剪成小于1 mm的碎块,加入2倍体积的3 g/L的I型胶原酶, 37 ℃孵育箱内消化,并每隔10 min摇晃一次。消化30 min取出,向离心管内加入等体积的含10%FBS的α-MEM培养液终止消化。200目滤网过滤,1 000 r/min离心5 min,弃去上清液,用10%FBS的α-MEM重悬细胞,接种,37 ℃、5% CO2的孵育箱中培养24 h,观察细胞完全贴壁后换液,以后每3 d换液一次。细胞长至皿底80%,经胰酶消化后传代培养,取第3代细胞用于实验。
1.2.2.2流式细胞术鉴定细胞表面抗原 待第3代细胞融合率达80%~90%时,PBS洗2遍,0.25%胰酶消化,离心(1 000 r/min、5 min),PBS洗2~3遍,弃去上清液;用含3%FBS的PBS重悬,计数,调整细胞密度以1×106个/ml,每管100 μl 分装至EP管内。分别加入5 μl 的CD44-PE、CD90-FITC和PBS,其中PBS组为阴性对照,室温条件下,避光孵育1 h;用PBS洗3 遍, 1 000 r/min离心5 min,弃去上清液,加400 μl 的PBS重悬,震荡均匀,上机检测。
1.2.2.3成骨分化能力检测 ① 成骨诱导液配置: 10 mmol/L β-甘油磷酸钠,10 μmol/L地塞米松,50 mg/L 维生素C,10%FBS 的α-MEM培养基,100 U/ml 青霉素,100 U/ml链霉素;② 待第3代细胞融合率达80%~90%时,0.25%胰酶消化后铺板,第2天换成骨诱导液,之后每3 d换一次液,培养21 d;③ 茜素红染色:培养21 d后弃培养液,PBS洗2~3次,4%的多聚甲醛溶液固定10~15 min;弃去固定液,双蒸水洗3次,每次3min,每孔加1ml的茜素红染液,室温下避光染色15~20 min。双蒸水冲洗多余染色液,加入适量的PBS后在显微镜下观察拍照。
1.2.2.4成脂分化能力检测 ① 成脂诱导液配置: 0.5 mmol/L 3-异丁基-1-甲基黄嘌呤,10 mg/L胰岛素,10 μmol/L地塞米松,0.1 mmol/L 吲哚美辛,10%FBS的α-MEM 培养基,100 μg/ml链霉素,100 U/ml青霉素;② 待第3代细胞融合率达80%~90%,0.25%胰酶消化后铺板,第2天更换成脂诱导液,之后每3 d换液一次,培养21 d;③ 油红O染色:称取0.25 g油红O溶于50 ml异丙醇,加入33 ml双蒸水震荡混匀得到油红O染液。成脂诱导培养也培养21 d后,弃去各组培养液,PBS洗2~3次,4%的多聚甲醛溶液,室温下固定30 min;弃去固定液,双蒸水洗3次,每次3 min,加入1 ml的油红O染液覆盖皿底,室温下染色30 min。双蒸水冲洗多余的油红O染液,加入适量的PBS后在显微镜下观察染色情况并拍照。
1.2.3PRP对ADSCs细胞增殖能力的影响 CCK-8实验:① 细胞接种与饥饿处理:取生长状态良好的第3代细胞,0.25%胰酶消化,以1×103个/孔接种到96孔板,10%FBS培养液培养24 h,更换成无血清培养液培养24 h;② 24 h弃去各孔中原培养液,换成实验培养液培养: 将上述3种方法制备的RPR按照体积比50%溶于α-MEM 培养液(含10%FBS、100 U/ml链霉素、100 U/ml青霉素)中,经过22 μm滤网过滤后备用,并标记为PRP-2、PRP-3、PRP-Tubex及空白对照组。10%FBS的α-MEM培养液培养的为空白对照组;每组加入对应的100 μl培养液,37 ℃、5% CO2培养箱中培养;③ 分别培养24、48、72 h后进行CCK-8检测,每孔加入100 μl CCK-8, 37 ℃、5% CO2培养箱孵育4 h后,用酶标仪检测450 nm处的吸光度(optical density,OD)值,各孔OD值减去调零孔OD值即为实际吸光度。

表1 Real-time PCR 引物序列
1.2.4PRP对ADSCs成骨分化能力的影响 取生长状态良好的第3代ADSCs,0.25%胰酶消化,调整细胞浓度以2×105个/孔接种于6孔板,用含10%FBS的α-MEM培养液培养至80%~90%融合后更换培养液;实验分组为:PRP-2组、PRP-3组、PRP-Tubex组、成骨诱导组和空白对照组,其中成骨诱导组使用成骨诱导液培养,空白对照组为使用含10%FBS的α-MEM培养液培养。每3 d换一次液,培养14 d后分别进行以下检测。
本节主要分析进口Mach数对燃烧流场特性的影响规律. 喷流条件固定, 取值为Majet=1.0, Tjet=300 K, Pjet=0.96 MPa. 发动机进口气体为氧气与氮气质量分数比为0.23∶0.77的混合空气, 温度和压强分别固定为: T∞=754 K, P∞=86 kPa. 进口Mach数取值及其对应的进口处流场参数如表 2所示, 表中Q为来流质量流量, φ为化学当量比.
1.2.4.1茜素红染色 染色方法同1.2.2.3。
1.2.4.2ALP染色 ① 培养14 d后弃去各组培养液,用PBS洗2~3次,4%的多聚甲醛溶液固定30 min;弃去固定液,双蒸水漂洗3次,每次3 min; ② ALP显色液配制:按照ALP显色试剂盒说明书配制BCIP/NBT染色工作液,充分混匀,避光备用;③ 染色:每孔加入350 μl的染色液覆盖皿底,室温避光条件下,染色2 h。使用双蒸水冲洗2~3次,终止染色,加入适量的PBS后在显微镜下观察染色情况并拍照.
1.2.4.3ALP定量 分别在培养的第3、5、7、14 天进行ALP定量实验。① 细胞破碎:弃去培养液,PBS洗2~3次,每孔加350 μl 的Triton X-100,裂解30~40 min,待孔内液体变清亮后移出待测;② 显色:在96孔板内,标准孔每孔依次加入30 μl 的0.02 mg/ml标准液、50 μl的基质液和50 μl的缓冲液,测定孔每孔加入30 μl的待测样本、50 μl的基质液和50 μl的缓冲液,空白孔依次加入30 μl的双蒸水、50 μl的基质液和50 μl的缓冲液,混匀,放置于 37 ℃水浴中15 min,每孔加入150 μl的显色剂;③ 吸光度测量:上酶标仪,测定在520 nm波长处各孔的OD值;④ RT-PCR:培养72 h后终止培养提取细胞总RNA进行RT-PCR检测。使用TaKaRa MiniBEST Universal RNA Extraction Kit试剂盒提取细胞总RNA,使用PrimeScript RT Master Mix试剂盒进行逆转录。参照SYBR Premix Ex Tap TMII 说明书进行RT-PCR检测。目的基因为内参β-actin、ALP、骨成型蛋白质-2(bone morphogenetic protein,BMP-2)、成骨细胞特异性物质骨钙素(osteocalcin, OCN)和人类相关转录基因-2(Runt-related transcription factor 2, Runx2)。所有引物由大连TaKaRa公司设计合成,见表1。RT-PCR 的反应条件是:95 ℃、30 s,95 ℃、15 s,60 ℃、34 s。

2 结果
2.1血小板计数和血小板回收率3种方法制取的PRP中血小板计数结果分别如图1所示:传统二次离心法、三次离心法和Tubex法制备PRP的血小板计数值分别为(1 318.9±254.8)×109/L、(1 886.0±364.4)×109/L、(2 257.9±436.2)×109/L,血小板采集率分别为50.12%、71.67%、 85.80%,Tubex法制备的PRP中血小板含量要显著高于其余两种方法(F=46.44,P<0.05 )。
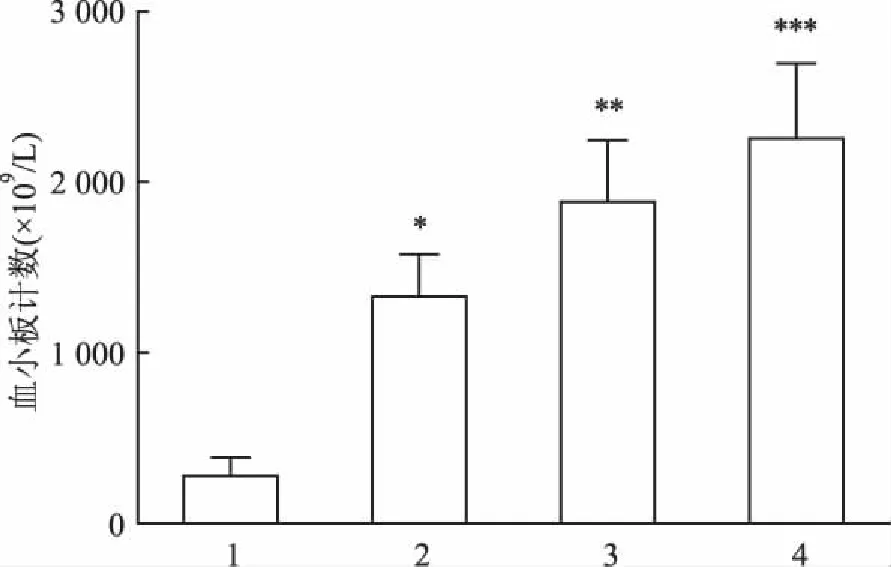
图1 不同制备方法制备的PRP和全血中的血小板计数
1:空白对照组;2:传统二次离心法;3:三次离心法;4:Tubex法;与空白对照组比较:*P<0.05,**P<0.01,***P<0.001
2.2ADSCs分离与鉴定本实验通过酶消化组织块法分离培养ADSCs,通过流式细胞仪检测细胞表面特异性标志物结果如图2A、2B所示:该细胞高表达间充质干细胞特异性表面标志物CD44和CD90,阳性率分别为99.4%和99.1%。
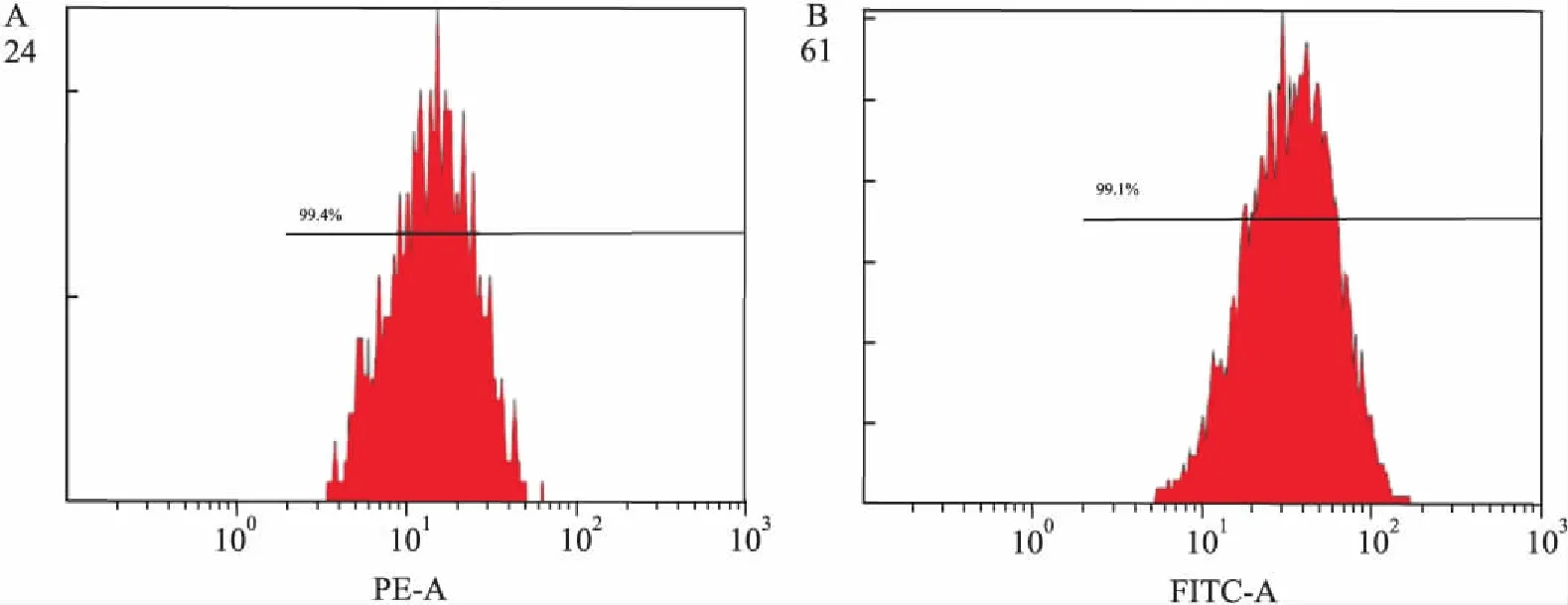
图2 流式细胞仪分析ADSCs细胞表面抗原

图3 ADSCs形态 SP×400
2.3ADSCs形态使用酶消化组织块法分离出的细胞,镜下观察:细胞界限清楚,胞质丰富,核偏大,形似成纤维细胞(图3A)。将细胞向成脂和成骨方向诱导培养21 d,油红O染色显示:镜下见红色小脂滴形成(图3B);茜素红染色显示:镜下可观察到红褐色的钙结节的形成(图3C)。
2.4PRP对ADSCs细胞增殖能力的影响将3种方法制备的PRP与ADSCs共培养24、48、72 h后,CCK-8试剂盒检测结果见图4。含有PRP培养的细胞OD值均明显高于空白对照组(P<0.05),PRP-Tubex组的细胞OD值在48 h和72 h显著高于PRP-2和PRP-3组,差异具有统计学意义(P<0.05),而PRP-2和PRP-3组的细胞OD值在48 h和72 h差异无统计学意义,因此与其他组比较,PRP-Tubex组能显著提高细胞增殖能力。
2.5PRP对ADSCs成骨分化能力的影响培养14 d后,茜素红染色结果显示:空白对照组无明显钙结节产生,成骨诱导组有明显的红褐色钙结节,含PRP的处理组红褐色钙结节的量较成骨诱导组显著增加。培养14 d后,ALP染色结果显示:空白对照组几乎未染色,成骨诱导组以及3个PRP处理组的染色程度较深,其中成骨诱导组的染色程度明显低于PRP 3个处理组。见图5。
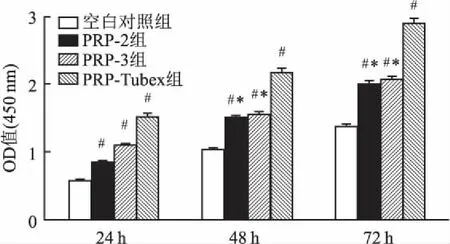
图4 不同处理后ADSCs增殖率图
与空白对照组比较:#P<0.05;与PRP-Tubex组比较:*P<0.05
ALP定量:在培养的3 d,各组细胞的ALP水平差异无统计学意义,在培养5 d后空白对照组的ALP活性最低(P<0.05)。在培养的第14天,PRP-Tubex组的ALP活性要显著高于空白对照组(P<0.05),各种处理后ADSCs的ALP活性大小为:PRP-Tubex组>PRP-3组>PRP-2组>成骨诱导组>空白对照组。见图6。

图5 ADSCs茜素红染色和ALP染色结果 SP×400
A:空白对照组;B:成骨诱导组;C:PRP-2组;D:PRP-3组;E:PRP-Tubex;1:茜素红染色;2:ALP染色

图6 ALP 定量结果

图7 RT- PCR检测相关基因表达
与空白对照组比较:#P<0.05;与成骨诱导组比较:*P<0.05
RT-PCR检测结果显示(图7),在培养的3 d后,各个PRP处理组的成骨分化标志基因Runx2、OCN、 ALP、BMP-2的的表达均显著高于空白对照组和矿化诱导组(P<0.05)。
3 讨论
自从PRP首次被发现可以在体外促进平滑肌细胞的有丝分裂之后[1],PRP内部丰富的生长因子和细胞因子逐渐被科学家揭开面纱[2-7],由于这些细胞因子能够促进多种细胞的生长和分化,有助于创伤的愈合和修复,人们更期待于将之运用于临床。
PRP制备的基本原理是利用全血中不同组分之间沉降系数的差异,通过使用梯度离心的原理分离出有效成分。在离心的过程中,离心力、离心时间以及离心次数等的差异均会对最终产品的成分和性能产生影响。采用何种方法使所得的PRP中血小板和生长因子的浓度和活性达到最大仍需探索。
本研究使用传统的二次离心法制备的PRP中血小板的浓度约为全血的5倍。采用三次离心法制备PRP中的血小板数目更多,采集率更高约为二次法的1.4倍;而使用Tubex装置制备法的血小板采集率最高,达到了85.8%,为传统二次离心法的1.7倍。为了最大限度的从全血中提取血小板,必须避免其在提取过程中的损失。而二次离心法和三次离心法均需经历多次离心和转移,这些过程造成的损失不可避免;其次,在制备PRP过程中丢弃的红细胞表面可能会黏附血小板等物质,也会造成血小板采集率的降低。Tubex装置属于密闭的,能避免样品转移所造成的损失,也能减少污染率。
在本实验中显示3种方法制备的PRP在体外激活后均能促进ADSCs的增殖。另外,PRP处理组细胞的成骨标志基因ALP、BMP-2、OCN、Runx2等的表达水平明显增高,ALP活性也明显增加,表明提高了ADSCs向成骨分化的潜能。PRP激活后可以释放血小板源性生长因子、胰岛素样生长因子、转化生长因子-β、血管内皮细胞生长因子、表皮生长因子等[7-8]。研究[9]显示20 ng/ml的血小板衍生生长因子-BB可以上调ADSCs成骨标志基因的表达,促进ADSCs的成骨分化。
使用传统的离心法制备PRP,制备过程中血样经多次离心和转移,过程中的某些刺激会提前激活PRP,导致生长因子释放,使活化的终产物中生长因子浓度偏低。特定的生长因子其浓度需要保持在稳定的水平,偏低或偏高都可能会对细胞的有丝分裂及分化造成影响[10]。所以,如何精准调控生长因子浓度对其最终效果起到了关键作用,是目前研究的难点。
在制备PRP过程中,激活剂、抗凝剂或制备温度的差异均会对血小板的采集率和生长因子的释放造成影响[11]。因此选择合适的PRP的制备方法、调控PRP中生长因子的种类、浓度以及其释放是其优化应用的主要问题。另外,还应考虑到不同个体全血中的成分及其含量的不同。本实验采用同一动物的全血样本进行3种不同制备方法,同时抗凝血剂以及激活方法及温度均一致,避免了这些可能对实验造成误差的因素[12]。不同种类的细胞因子对细胞的生命活动可以发挥协同作用,但其浓度会对作用效果产生差异。本实验只粗略设定了PRP的浓度,而关于生长因子的种类和浓度和其之间的作用机制仍需进一步探讨。
