CT及MRI灌注成像对颅内血管外皮细胞瘤和脑膜瘤的鉴别诊断价值
2018-09-01单奔柳勇赵正宇魏玲韩雷周寒松
单奔,柳勇,赵正宇,魏玲,韩雷,周寒松
(徐州医科大学附属淮安医院 影像科,江苏 淮安 223001)
血管外皮细胞瘤(hemangiopericytoma,HPC)为一类血管源性肿瘤,理论上可发生于任何含毛细血管的组织,而发生在中枢神经系统者较罕见,其在所有颅内肿瘤中比例<1%[1-2]。颅内HPC大部分起源于脑膜间质的血管外皮细胞,术前诊断主要依赖影像检查。由于同样起源于脑膜结构,其在临床和影像表现方面同脑膜瘤有很大的重叠,两者极难鉴别。
中枢神经系统HPC在国内外尚未见大样本报道,甚至大部分研究仅为个案报道,且影像学研究主要围绕常规检查和普通增强检查,缺乏客观的评估标准。本研究主要从CT及MRI灌注成像技术的角度出发,评估两者对颅内HPC和脑膜瘤鉴别诊断的价值,试图为颅内HPC术前诊断提供量化参考指标。
1 资料与方法
1.1 一般资料
选取2012年3月-2017年7月该院经手术病理证实的14例HPC患者(HPC组)和42例脑膜瘤患者(脑膜瘤组)。HPC组:男性7例,女性7例;年龄28~56岁,平均43.8岁;病程15 d~4年,平均18.3个月。脑膜瘤组:男性18例,女性24例;年龄25~75岁,平均48.5岁;病程3个月~11年,平均21.5个月。
1.2 CT检查
使用Toshiba Aquilion ONE 320排640层CT(日本东芝株式会社),扫描范围从C1椎体下缘至颅顶,扫描线与颅底平行。常规平扫后行CTP检查,具体参数:容积非螺旋扫描,扫描野(field of view,FOV)200 mm,扫描速度0.35 s/r;对比剂注射后7 s第1次扫描(80 kV,300 mA)用于计算本底,扫描开始后第11 s以1 s间隔扫描13次(80 kV,100 mA)作为动脉期,续以5 s间隔扫描5次(80 kV,100 mA)作为静脉期。对比剂选用碘普罗胺注射液370(德国拜耳医药保健有限公司,商品名优维显),剂量65 ml,注射流率5.5 ml/s。将所得容积数据包导入4D-Perfusion软件,依次选取横断面病灶侧大脑中动脉和上矢状窦中心区单点样,生成4个主要参数[脑血流量(cerebral blood flow,CBF)、脑血容量(cerebral blood volume,CBV)、平均通过时间(mean transit time,MTT)及达峰时间(time to peak,TTP)],并生成相应的灌注色阶图。
1.3 MRI检查
使用Signa HDx 1.5T超导型磁共振仪(美国GE公司),8通道相控阵头线圈,常规平扫后行磁共振灌注加权成像(perfusion weighted imaging,PWI)检查,基于动态磁敏感对比增强技术,采用梯度回波-平面回波成像T2WI序列,以肿瘤为中心覆盖整个病灶,具体参数:TE 80 ms,TR 2 000 ms,翻转角90°,带宽62.50,矩阵128×128,FOV 24 cm×24 cm,层厚10.0 mm,层间隔0.0 mm,Nex=1。PWI扫描完成后,行轴位、矢状及冠状3个方位的SE T1WI增强扫描。对比剂选择钆喷酸葡胺注射液(德国拜耳先灵医药股份有限公司,商品名马根维显),剂量0.1 mmol/kg,注射流率4 ml/s。将采集到的原始数据传送到Functool软件,计算构建CBV伪彩图像。
1.4 兴趣区的选择与指标测量
选择灌注检查横断面肿瘤最大层面,测量肿瘤实质部分周围区和中心区共3~5个兴趣区(region of interest,ROI),计算各参数平均值。ROI半径2~4 mm圆形,外周区ROI最外缘放置距离肿瘤实质最外缘3~5 mm,ROI的放置要避开坏死、囊变及钙化区域,尽量选择非血管最强灌注区。CTP检查记录参数包括CBF、CBV、MTT及TTP 4个参数,PWI检查记录参数为区域CBV(regional CBV,rCBV)。为消除个体脑血流差异,同时测量病灶ROI对侧正常脑白质相应的参数作为对照,注意避开血管,计算两者比值(病灶/对照)分别记录为RCBF、RCBV、RMTT、RTTP及RrCBV。
1.5 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用χ2检验或Fisher的确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
分别有7例HPC及25例脑膜瘤患者行CT平扫及CTP检查,7例HPC及17例脑膜瘤患者行MRI平扫及PWI检查。HPC组男女比为1∶1(7/7),平均年龄(43.8±17.5)岁;脑膜瘤组男女比为1.0∶1.3(18/24),平均年龄(48.5±20.1)岁。14例HPC均呈单发且位于脑外,其中12例位于幕上(发生于大脑凸面者7例、偏一侧大脑镰旁者5例),另2例发生于单侧桥小脑脚区。42例脑膜瘤亦均为单发且位于脑外,其中35例位于幕上(大脑凸面及大脑镰旁者分别为19、16例),幕下者7例(4例位于桥小脑脚,1例位于鞍上,2例位于小脑幕旁)。HPC肿瘤最大径为(4.3±2.6)cm,脑膜瘤为(4.8±2.9)cm。两组肿瘤最大径比较,差异无统计学意义(t=0.645,P=0.520);两组性别比、年龄分布及肿瘤位置分布比较,差异无统计学意义(P>0.05)。
2.2 两组影像形态学特征比较
颅内HPC较脑膜瘤更易呈分叶状生长,并更加表现出呈窄基底生长的倾向,而在其他诸多纳入分析的形态特征比较,差异无统计学意义(P>0.05),提示两者在影像形态学方面具有非常大的重叠空间。见表1。
2.3 两组相对灌注参数比较
2种肿瘤实质部分均较对侧正常脑白质高灌注,瘤内坏死囊变者灌注不均匀,瘤周水肿区表现为相对低灌注(见图1C~F、1J,图2C~F、2J)。CTP检查中HPC组RCBF及RCBV高于脑膜瘤组,提示前者血供及瘤内血流储备较后者更加丰富;而RMTT和RTTP比较,差异无统计学意(P>0.05),说明两者肿瘤实质总体血流动力特征无差异。PWI同CTP一致, HPC组RrCBV高于脑膜瘤组。见表2。

表1 两组影像形态学特征比较

图1 颅内HPC的影像学表现
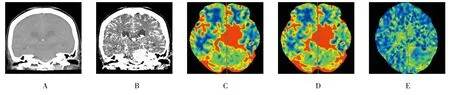

图2 颅内meningioma的影像学表现
表2 两组相对灌注参数比较 (±s)
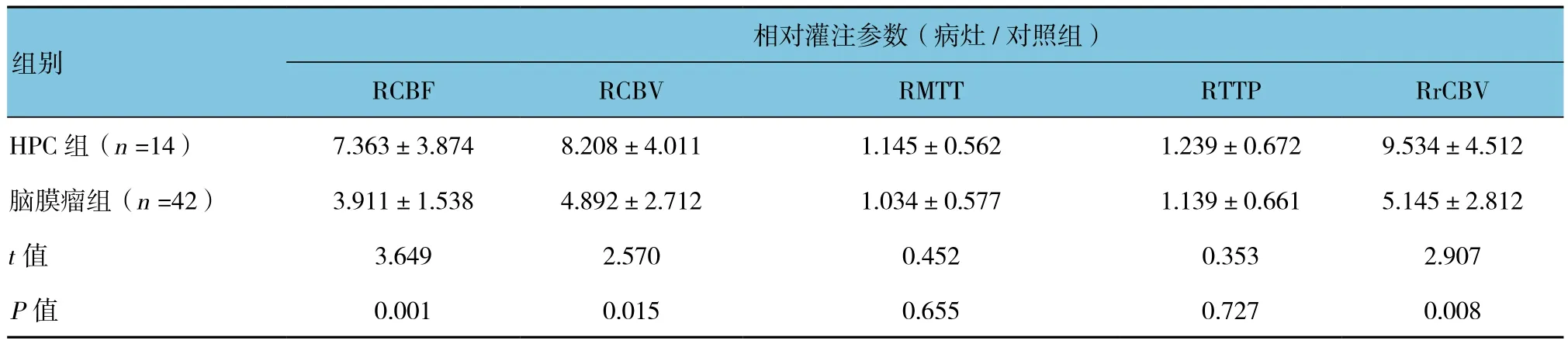
表2 两组相对灌注参数比较 (±s)
相对灌注参数(病灶/对照组)RCBF RCBV RMTT RTTP RrCBV HPC 组(n =14) 7.363±3.874 8.208±4.011 1.145±0.562 1.239±0.672 9.534±4.512脑膜瘤组(n =42) 3.911±1.538 4.892±2.712 1.034±0.577 1.139±0.661 5.145±2.812 t值 3.649 2.570 0.452 0.353 2.907 P值 0.001 0.015 0.655 0.727 0.008组别
3 讨论
脑膜瘤是颅内原发肿瘤中最常见的类型,约占30%[3]。其起源于蛛网膜颗粒帽状细胞,与硬脑膜结构关系密切,好发于50岁左右的女性[4],常生长缓慢、预后良好。而颅内HPC较脑膜瘤发生率更低,较罕见。目前报道的颅内HPC绝大部分起源于脑膜间质的毛细血管外皮细胞(Zimmerman细胞),鲜有发生于脑实质内者[5]报道,肿瘤好发于35~55岁男性,常表现不同程度的侵袭性,远处转移及治疗后原位复发的几率都很高[6]。两者均可见于颅内脑外各个部位,以幕上大脑镰旁多见[7-9]。目前对两者鉴别的金标准仍是病理免疫组织化学技术,本研究所有HPC与脑膜瘤波形蛋白均呈阳性,表明肿瘤来源于脑膜间质,而上皮膜抗原在HPC内均阴性、脑膜瘤中均阳性,表明HPC不含有脑膜上皮来源,与既往研究一致[5-7,10]。两种肿瘤均首选手术切除治疗,尤其是HPC更应尽量做到全切。但HPC常拥有颈内外动脉双重血供,较脑膜瘤血供更为丰富,手术时往往引发汹涌性出血,易导致患者术中休克或死亡[6,11]。
颅内HPC瘤体形态多不规则、呈较明显的分叶状生长,提示肿瘤生长更为快速及具有侵袭性。潘锋等研究[12]表明,波浪分叶状生长可作为鉴别颅内HPC和脑膜瘤的重要指标,本研究发现,HPC分叶状生长发生率较脑膜瘤高,与其研究一致;另一方面,脑膜瘤内砂粒体结构较常见,宏观上更易表现为钙化。蓝胜勇等认为,肿瘤内出现钙化可作为颅内HPC排除性诊断的CT特征[6],但是本研究发现一例HPC肿瘤中心区有斑点状钙化,与潘锋、郑红伟等人研究[12-13]一致,说明该结论并不准确,瘤内钙化并非脑膜瘤所特有。HPC生长快、侵袭力高,一般呈相对窄基底凸向颅内,形成“蘑菇”状,瘤内常可见坏死区,且肿瘤紧邻骨质一般表现为骨质破坏而不是增生,脑膜瘤则相反。有学者发现,瘤内坏死囊变、临近骨质增生亦可作为区分两者的特征[14],但在本研究这几个指标的均无差异,可能与HPC病例较少及MRI能够发现较多脑膜瘤内亦有细微囊变坏死区有关。
CTP及MRI PWI成像技术基本原理是通过引入外源性对比剂,使用不同设备对兴趣区进行追踪,获得时间-密度/信号曲线,通过不同的数学算法计算出局部血流动力学参数。两种灌注技术均具有无创、快速、准确、敏感及定量的优点,已广泛的应用于缺血性病变早期诊断、肿瘤术前分级及各种疾病疗效评估等领域,成为当今影像学界研究一大热点。本组HPC及脑膜瘤实质的CBF、CBV均较对侧正常脑白质升高,呈高灌注改变,瘤内囊变坏死区及瘤周水肿带呈相对低灌注,肿瘤实质部分MTT、TTP较对侧正常脑白质无差异,与既往研究符合[15-16]。目前应用灌注成像技术对脑膜瘤开展的研究已有较多报道,但对HPC的研究尚不充分,且部分学者得到的数据相差甚大[15-18],可能与灌注模型及ROI选区规则不同有关。基于本组的灌注模型及选区规则下,CTP所得颅内HPC相对灌注参数RCBF及RCBV均高于脑膜瘤,与部分学者较为一致[16-18],PWI所得的RrCBV前者亦高于后者,且该数值与CTP所得RCBV较为一致。其一方面表明两种灌注成像技术鉴别颅内HPC及脑膜瘤的效能基本一致;另一方面,两者灌注参数之间的差异也证实颅内HPC较脑膜瘤血供更加丰富,在临床工作中应当认清这一点。尽管HPC病例较少,但是CTP和PWI所得灌注数据较为接近,也从另一角度证实本研究结果的可信。本研究不足之处在于HPC发病率极低,所得结论仍建立在小样本研究的基础之上,后续工作中有必要搜集更多的样本,以建立更加完善的用于颅内HPC诊断的灌注检查模型。
综上所述,灌注成像技术能为鉴别颅内HPC和脑膜瘤提供更加丰富且重要的依据。对于颅内脑外肿瘤,如其与硬脑膜关系密切、呈分叶状,且按本模型进行CTP或PWI检查时肿瘤实质CBV及CBF较对侧正常脑白质呈更加升高,尤其是接近或者超过后者十倍应考虑到HPC的可能,神经外科医师手术前应进行更加充分的准备。
