NO对盐胁迫下长春花种子萌发和幼苗生理代谢的影响
2018-09-01赵晓菊张丽霞满秀玲
赵晓菊 张丽霞 满秀玲
(1.大庆师范学院生物工程学院,大庆 163712; 2.东北林业大学林学院,哈尔滨 150040)
盐是限制植物生长发育的主要因子,盐胁迫一定程度影响种子萌发和幼苗生长,破坏植物体内生物膜的结构,影响代谢过程[1]。为抵御盐胁迫的伤害,植物会产生一系列生理生化改变[2],如提高次生代谢产物等,有研究发现盐胁迫会促进长春花(Catharanthusroseus)生物碱合成[3],这将进一步扩大盐碱地种植和海水灌溉的实施空间。
长春花为夹竹桃科(Apocynaceae)长春花属(Catharanthus)植物,因体内含有长春碱(vinblastine)、长春新碱(vincristine)等130种生物碱类,是国际上研究和应用最多的抗癌植物[4~5]。目前长春花中生物碱类主要是从天然植株中提取,且主要通过外界胁迫促进其生物合成[6],但胁迫往往会抑制植株生长,造成生物碱提高幅度不大,所以在胁迫的同时添加一种缓解物质,对于长春花生物碱提取具有生产意义。
一氧化氮(nitric oxide,NO)作为一种重要的信号分子,在植物体内主要通过一氧化氮合酶(nitric oxide synthase,NOS)和硝酸还原酶(nitrate reductase,NR)催化形成[7~8],参与植物种子萌发、生长、发育等过程,尤其对非生物胁迫的响应方面具有重要的调节作用[9~11]。国内外对NO作为防御响应中的关键信使缓解植物受到盐胁迫的应用报道很多,如NO可缓解小麦种子萌发过程中盐胁迫的伤害作用[12],低浓度NO处理能延缓水稻在盐胁迫和高温胁迫下叶片叶绿素的降解,维持光系统的高活性[13],外源NO可减缓盐胁迫对黄瓜根系氧化酶系统的伤害[14]。长春花是重要的抗癌植物之一,体内药用生物碱与植株耐盐性密切相关,鉴于此,本实验以药用植物长春花为研究材料,研究了外施不同浓度的NO供体硝普钠(sodium nitroprusside,SPN)对盐胁迫下长春花萌发与生长的影响,以期为长春花的盐碱地种植和海水浇灌提供参考,并为进一步研究NO信号缓解长春花耐盐性奠定基础。
1 材料与方法
1.1 试材及处理
供试长春花种子由东北林业大学森林植物生态学教育部重点实验室提供。选取饱满一致的粉红花长春花种子,用3%的NaClO溶液浸泡5 min后,用去离子水洗净、吸干,将固定数量的种子放入垫有脱脂棉直径为9 cm的洁净培养皿中,按表1设置7组,每组3个重复。在光照培养箱(ZPW-400,China)内进行吸涨萌发,培养条件:光照时间(日/夜12 h/12 h),温度(日/夜25℃/18℃),湿度为80%。
长春花幼苗的培养选取颗粒饱满的长春花种子,用10%的NaClO消毒后,均匀播种于育苗盆中,保持适当湿润的环境,待小苗长出真叶后选取长势一致的长春花幼苗,移栽入装有蛭石下部具孔,透气性良好的育苗盆(10 cm×10 cm)中,将长春花幼苗置于人工气候箱中进行培养,培养条件:光照时间(日/夜12 h/12 h),温度(日/夜25℃/18℃),湿度为60%,定期浇灌1/2的Hogland’s营养液(pH=6.0)。
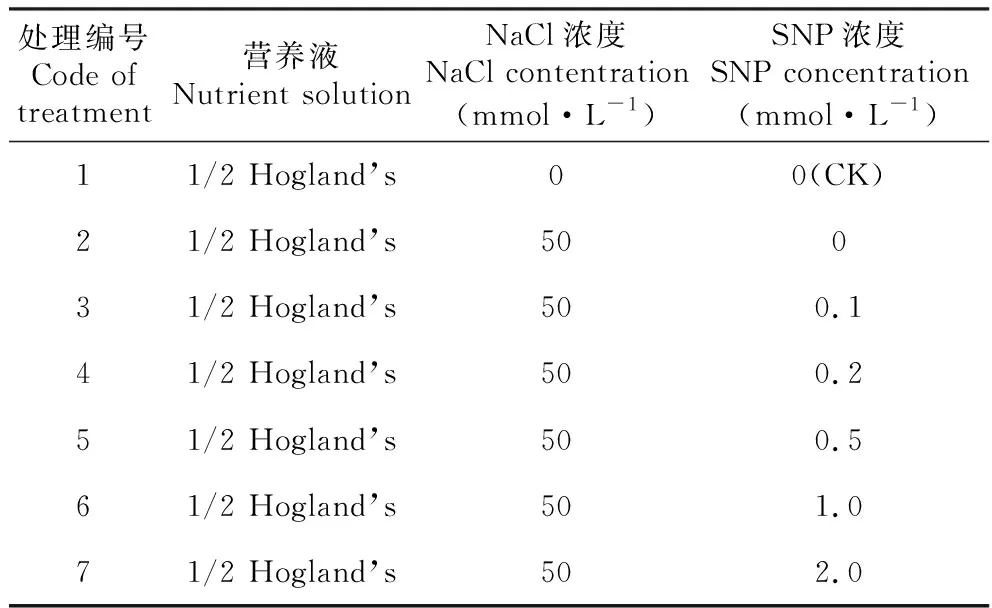
表1 外源硝普钠处理方案
待幼苗生长出木质部后,随机挑选相同生长时期幼苗,以正常条件作为对照用CK表示,在50 mmol·L-1NaCl溶液中,加入0.05、0.1、0.5、1.0、2.0 mmol·L-1SNP进行处理,连续5天每天上午九点取样测定NR活性动态变化;测定0、2、4、6、24 h内脯氨酸(Proline,Pro)含量变化;处理15 d后的丙二醛(malondialdehyde,MDA)含量变化,每次测量3次平行重复。
1.2 方法
1.2.1 种子萌发实验方法
长春花种子置于光照培养箱培养后每隔24 h观察记录每个培养皿中种子萌发数,第7 d时将培养皿里的长春花种子用蒸馏水冲洗,将种子表面的水分用吸水纸吸干,测量种子的根长、芽长,分别计算出发芽率、发芽势和发芽指数。
发芽率=7 d内供试种子的发芽数÷供试种子数×100%
(1)
发芽势=3 d内供试种子的发芽数÷供试种子数×100%
(2)
发芽指数(GI)=∑Gt/Dt
(3)
式中:Gt为在t日的发芽数;Dt为发芽天数。
活力指数(VI)=GI×S
(4)
式中:GI为发芽指数;S为芽的长度。
1.2.2 生理指标测定
参照张志良等的方法[15],准确称量长春花植株叶片鲜重,充分混合后,叶片中MDA含量的测定采用硫代巴比妥酸法测定,以μmol·g-1FW表示MDA含量;Pro采用磺基水杨酸法,以μg·g-1FW表示Pro含量,NR采用活体法测定(标准曲线),以μg·g-1·h-1表示NR活性。
1.3 数据处理
采用Microsoft Excel 2010和SPSS 17.0进行数据统计和方差分析,并运用Duncan’s检验法进行多重比较。应用Graph Pad Prism 5.0对试验数据统计结果进行作图。
2 结果与分析
2.1 外源NO对盐胁迫下长春花种子萌发的影响

图1 SNP对盐胁迫下长春花种子发芽参数的影响 图中不同字母表示差异达到5%显著水平,下同。Fig.1 The effects of SNP on germination parameters of seeds in Catharanthus roseus under NaCl stress Different letters above the bars mean significant difference at 5% level,the same as below.
如图1所示,50 mmol·L-1NaCl胁迫下,长春花种子发芽势、发芽率和发芽指数均低于对照组,添加0.1 mmol·L-1SNP处理后均高于NaCl胁迫下,可见低浓度SNP可缓解NaCl胁迫对种子萌发的抑制作用,随着SNP浓度的不断加大,缓解作用降低,甚至一定浓度起到了抑制作用。长春花种子发芽率是对照组与盐胁迫中加入0.1和0.5 mmol·L-1SNP无差异显著性,说明盐胁迫中加入适当低浓度的SNP可恢复发芽率到正常状态,加入2.0 mmol·L-1SNP时发芽率比单独盐胁迫还低,证实高浓度SNP抑制种子的萌发。发芽势是50 mmol·L-1NaCl胁迫和加入不同浓度的SNP均显著低于对照组,低浓度SNP(0.1 mmol·L-1)可有效提高发芽势,而高浓度SNP(1.0和2.0 mmol·L-1)比单独盐胁迫发芽势还低。整体上长春花种子的发芽指数随SNP浓度的升高而降低,盐胁迫下低浓度SNP有一定缓解作用。
如图2所示,在盐胁迫下长春花芽长、根长明显低于对照组,加入0.1 mmol·L-1SNP芽长、根长与对照组无显著差异,大于0.5 mmol·L-1SNP处理下明显抑制芽和根的长度。
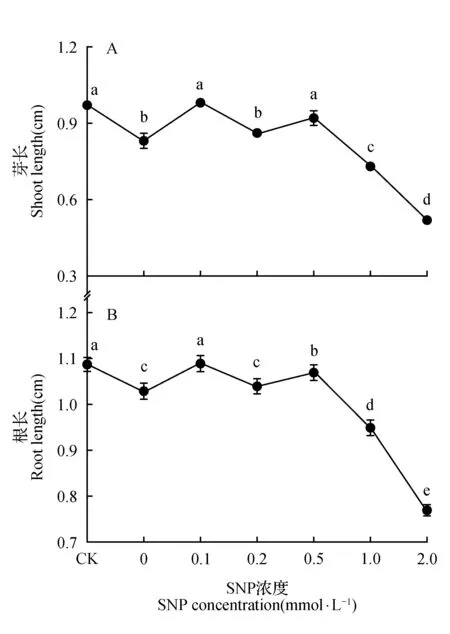
图2 SNP对盐胁迫下长春花种子根长、芽长的影响Fig.2 The effects of SNP on shoot and root length in C.roseus seeds under NaCl stress
活力指数变化趋势整体上同发芽指数一致,与对照相组比,盐胁迫下长春花种子活力指数明显降低,在盐胁迫下种子活力指数整体趋势是随SNP浓度的升高而降低,当SNP浓度为0.1和0.5 mmol·L-1时,长春花种子活力指数高于50 mmol·L-1NaCl胁迫组,起到有效缓解作用(表2)。
表2SNP对盐胁迫下长春花种子的活力指数影响
Table2TheeffectsofSNPonseedvigorindexinC.roseusunderNaClstress

SNP浓度SNP content(mmol·L-1)发芽指数Germination index(%)芽长Root length(cm)活力指数Vigor indexCK(1/2 Hogland’s)43.38±1.15a0.97±0.012a42.11±1.62aST(50mmoL·L-1 NaCl)35.63±1.73b0.83±0.029b29.67±2.47cST+0.136.13±1.15b0.98±0.0058a35.42±1.34bST+0.227.37±1.15d0.86±0.012b23.56±1.31dST+0.533.88±0.577c0.92±0.029a31.20±1.51cST+1.026.57±0.577d0.73±0.017c19.42±0.882eST+2.023.13±0.577e0.52±0.012d12.04±0.567f
注:不同字母表示不同处理间差异显著(P<0.05)。
Note:Different letters indicate the significant difference among different treatment(P<0.05).
2.2 外源NO对盐胁迫下长春花幼苗NR活性的影响
由图3可知,分别在1~5 d同一时间测定的NR活性都呈先上升后下降的趋势,均在0.5 mmol·L-1SNP下达到最高值,NR活性在107.63~132.62 μg·g-1·h-1,小于0.5 mmol·L-1SNP处理下,随着浓度的升高,NR活性增强,大于0.5 mmol·L-1SNP后随着浓度升高NR活性降低。

图3 SNP对盐胁迫下长春花叶片内NR活性的影响Fig.3 The effects of SNP on NR in C.roseus seedlings under NaCl stress
测量NR活性随着外源NO作用时间的延长NR活性先升高(1 d<2 d<3 d<4 d)后下降(4 d>5 d),各SNP浓度下NR活性均在第4 d时达到最高值,第5 d比第4 d略有下降也相对较高。
在50 mmol·L-1NaCl胁迫下5 d内测定的NR活性无差异显著性,平均值为71.654 μg·g-1·h-1,而施加SNP后NR活性均高于盐胁迫下,在0~0.5 mmol·L-1SNP对盐胁迫伤害NR活性缓解作用尤为显著,1.0~2.0 mmol·L-1SNP对缓解盐胁迫作用下降。
2.3 外源NO对盐胁迫下长春花幼苗Pro含量变化的影响
由图4可知,0 h(指刚施加SNP后)和24 h对比分析(即间隔一天的同一时间段),在50 mmol·L-1NaCl胁迫(SNP浓度为0时)下,Pro含量由43.125~49.533 μg·g-1FW,上升了14.85%;50 mmol·L-1NaCl+0.05 mmol·L-1SNP处理下,Pro含量由54.154~51.975 μg·g-1FW,下降了4.02%;50 mmol·L-1NaCl+0.1 mmol·L-1SNP处理下,Pro含量由49.933~52.875 μg·g-1FW,上升了5.89%;50 mmol·L-1NaCl+0.5、1.0、2.0 mmol·L-1SNP处理,差异不显著。说明0.1 mmol·L-1SNP对50 mmol·L-1NaCl盐胁迫下的长春花幼苗在24 h内即有显著缓解作用,而浓度大于0.1的缓解效果不明显或无效果。在所有测量中2 h下Pro含量最低,可能原因是外界处理后脯氨酸含量均迅速上升,在2 h略有缓和后再次上升,是植物对外界反应的一种应激性。

图4 SNP对盐胁迫下长春花内Pro含量的影响Fig.4 The effects of different contents of SNP on soluble pro content in C.roseus seedlings under NaCl stress
2.4 外源NO对盐胁迫下长春花幼苗MDA含量变化的影响
50 mmol·L-1NaCl单独处理时(SNP为0),长春花叶片MDA含量约为0.100 3 μmol·g-1FW,显著高于未经盐胁迫处理的(对照组)0.086 35 μmol·g-1FW,增加了16.15%。与50 mmol·L-1NaCl胁迫相比,0.1~1.0 mmol·L-1SNP处理均可降低盐胁迫下MDA含量,2.0 mmol·L-1SNP与之无显著差异,其中1.0 mmol·L-1SNP含量较低为0.0791 μmol·g-1FW,与NaCl单独处理相比降低了20.57%,差异显著。当SNP浓度高于0.2 mmol·L-1后,MDA的含量整体趋势随着SNP浓度的升高而增大(图5)。

图5 不同浓度SNP对盐胁迫下长春花幼苗MDA含量的影响Fig.5 The effects of different contents of SNP on MDA content in C.roseus seedlings under NaCl stress
3 讨论
盐胁迫损害植物细胞的正常代谢过程,尤其是发芽期和幼苗期最为敏感[16]。植物细胞中的NO具有双重作用:低浓度的NO能够促进植物的生长与发育,提高植物的抗逆性;而高浓度的NO则对植物细胞有毒害作用。在对非生物胁迫的反应中,NO能够减轻活性氧对植物细胞的伤害,并和其他的信号分子结合,共同调节胁迫响应基因的表达,SNP作为NO供体,0.5 mmol·L-1SNP处理2 h约能生成2.0 μmol·L-1的NO[17]。本实验在SNP处理对盐胁迫下长春花幼苗NR活性和Pro含量的变化研究基础上,参考NO对盐胁迫下冰叶日中花种子萌发设定范围[18],研究了0.1、0.2、0.5、1.0和2.0 mmol·L-1SNP处理对盐胁迫下长春花种子萌发的影响,研究结果表明50 mmol·L-1NaCl抑制种子发芽,影响种子的发芽率、发芽指数及活力指数,低浓度的SNP处理对盐胁迫下长春花种子萌发具有明显的保护作用,缓解盐胁迫对种子细胞膜修复的抑制作用,可明显提高种子的萌发率;大于0.5 mmol·L-1SNP会加重盐胁迫伤害,使盐胁迫下长春花种子发芽率、发芽势、发芽指数、活力指数等降低,证实高浓度的SNP抑制植物种子萌发。
长春花作为一种抗癌药用植物,促进其体内具有药效活性的生物碱类合成事关民生,也是栽培长春花的首要意义。已有研究表明,50 mmol·L-1NaCl处理对长春花吲哚生物碱代谢的促进作用最大[4],所以本实验选取浓度为50 mmol·L-1NaCl作为盐胁迫处理,并且针对不同生理指标变化的特性,选取不同时间段进行研究,如自然条件下NR活性在上午九点较强,研究了5 d内每天九点的NR活性动态变化;植株内Pro含量变化较为迅速,研究了处理后24 h内的动态变化;MDA作为脂质过氧化的产物之一,研究了处理15 d后MDA含量变化,从不同角度揭示NO对盐胁迫下长春花幼苗生理代谢的影响。
NR作为氮同化代谢的关键酶和限速酶,催化NO3-到NO2-,也是植物体内促进形成NO的催化酶之一,与植物氮同化能力密切相关,对植物的生长起着至关重要的作用[19]。该酶对盐胁迫很敏感,盐胁迫使得NR活性下降,叶片内体内NO3-积累,而NO2-下降,含氮化合物的代谢紊乱[20]。本实验中施加SNP后的NR活性均高于盐胁迫组,与樊怀福等对黄瓜幼苗的研究相一致[21],由此可知,外源NO可以有效提高NR活性来缓解盐胁迫对植物生长造成的不良影响,其中0~0.5 mmol·L-1缓解作用显著,1.0~2.0 mmol·L-1SNP缓解作用下降,这与低浓度NO促进植株生长提高抗逆性,高浓度抑制生长的相机理一致。对盐胁迫下长春花幼苗施加SNP后,NR活性在1~4 d呈逐渐上升趋势,第5 d也相对较高,对于用海水浇灌或者盐碱土栽培的长春花,可选择0.1~0.5 mmol·L-1SNP来促进氮代谢,并且在浇灌后的第5 d开始进行采收。
盐胁迫下,植物合成一些小分子有机物质以增强其渗透调节能力,改善水分状况。Pro作为一种重要的渗透调节物和抗氧化物质,在盐胁迫下含量会有所积累,避免细胞造成氨中毒。外源NO促进了低温胁迫下黑麦草Pro的积累来提高抗寒性[22],本研究结果表明0.1 mmol·L-1SNP促进了NaCl胁迫下长春花叶片Pro含量积累,该SNP浓度与NO缓解盐胁迫下番茄幼苗显著增加Pro含量研究相一致[23]。因此,低浓度NO促进Pro积累,是缓解盐胁迫下长春花幼苗伤害的重要原因之一。
MDA含量多少是脂质过氧化作用强弱的一个重要指标,盐胁迫下MDA含量增多,与膜透性增加显著相关。细胞中MDA含量的高低反映了细胞氧化损伤的程度,本实验研究结果表明SNP处理降低盐胁迫导致长春花叶片MDA含量的上升,对盐胁迫下长春花具有保护作用。Mata等报道了NO对干旱迫引起的小麦幼苗的氧化胁迫具有缓解效应[24],是由于活性氧(ROS)水平的提高诱发了脂质过氧化链式反应,导致细胞膜受到破坏,而NO可直接或间接清除ROS,或降低ROS的产生,中断氧化胁迫减轻细胞膜损伤有关。
综上所述,低浓度的NO可有效缓解盐胁迫对长春花种子萌发的影响,减轻对幼苗的伤害。NO对盐胁迫的调节作用在植物体内是一个非常复杂的生理生化过程,本试验从几个生理指标方面探讨NO对盐胁迫下长春花幼苗的影响,还应进一步研究NO对盐胁迫下长春花生物碱代谢的影响,从生物量积累和代谢响应两个角度探索提高长春花生物碱产量。
