NaCl对大菱鲆肌原纤维蛋白特性的影响
2018-08-31李德阳侯雅文黄美琪姜鹏飞张晓芳董秀萍祁立波
李德阳,侯雅文,黄 颖,黄美琪,姜鹏飞,张晓芳,董秀萍,*,祁立波,*
大菱鲆,俗称“多宝鱼”,为硬骨鱼纲、鲽形目、菱鲆属、深海冷水性鱼类,原产于欧洲,1992年引入我国,是世界上鲆鲽类主要养殖鱼种之一[1]。大菱鲆因其肉质细腻、入口爽滑鲜美、鱼骨刺较少、营养丰富而深受广大消费者的青睐[2]。2015年,我国海水养殖鱼类中,鲆鱼产量位居第2,为13.18万 t[3]。近年来,大菱鲆养殖产业发展迅猛,在我国北方沿海地域已形成规模化产业,养鱼方式已提升到工业化水平,但目前市场上大菱鲆的加工产品仍然很少,以鲜活食用为主的消费方式已经逐渐成为大菱鲆产业发展的瓶颈。对大菱鲆进行深加工,丰富其加工品类,已成为产业从业人员重点关注的问题之一[4]。影响鱼肉口感和品质的主要是肌肉蛋白质,肌原纤维蛋白是肌肉蛋白质的主要组分,其属于盐溶性蛋白[5]。溶解度、乳化性、化学作用力、流变学特性和蛋白结构的改变,会对肌原纤维蛋白的理化特性和加工特性产生直接影响。食盐是肉类加工必不可少的辅料,其主要成分为NaCl,能有效提高离子强度,有利于肌原纤维蛋白的提取[6]。NaCl可降低肌原纤维蛋白的等电点,使其在通常的pH值范围内带有更多的净电荷,增强肌原纤维蛋白的溶解性,从而改善肌原纤维蛋白的加工特性[7]。有报道称,肌原纤维蛋白热诱导凝胶的蒸煮损失随离子强度的增强而下降,且含0.6 mol/L NaCl的肌原纤维蛋白有着最高的储能模量(G’)[8]。蛋白质分子的活性巯基含量随NaCl浓度的增大呈逐渐上升趋势,但当NaCl浓度增大到一定程度,活性巯基含量的变化不明显。在低离子强度时,肌原纤维蛋白的分子间氢键和表面疏水性呈上升趋势[9]。此外,盐离子浓度的改变会引起肌原纤维蛋白溶液中各种蛋白质分子组成的变化。通过影响肌原纤维蛋白中不同种类蛋白相对含量来间接影响蛋白质之间的相互作用力。随着盐离子浓度的升高,副肌球蛋白及肌球蛋白相对含量增加较快,球蛋白相对比例增加,使得体系趋于有序性[10]。综上,NaCl会影响肌原纤维蛋白的理化特性和加工特性。
本实验研究不同NaCl浓度下大菱鲆肌原纤维蛋白溶解度、乳化性、化学作用力(离子键、氢键、疏水相互作用)、巯基含量、蛋白质二级结构和流变学特性的变化,旨在明确NaCl对大菱鲆肌原纤维蛋白功能特性的影响,为大菱鲆鱼肉腌制产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活大菱鲆(Scophthatmus maximus L.),购买于辽宁省大连市长兴水产市场(产地:大连旅顺),质量为1.3~1.5 kg/条,体长25~30 cm/条。使用装满碎冰的保温箱运送至实验室,敲击头部致死,去皮取肉。
实验所用试剂均为分析纯。
1.2 仪器与设备
T25数显匀浆机 德国IKA公司; CF16RX II冷冻离心机 日本Hitachi公司;Infinite200 NANO酶标定量测试仪 瑞士Tecan公司;UV-5200紫外-可见分光光度计 中国上海元析有限公司;Discovery HR-1流变仪美国TA仪器有限公司;MOS-450多功能圆二色光谱仪法国Bio-Logic公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取及不同NaCl浓度蛋白溶液的制备
肌原纤维蛋白的提取参照Sun Fengyuan等[11]的方法,并作稍许修改。将大菱鲆鱼肉切碎,然后放入绞肉机中绞成鱼糜,称取6 g鱼糜于80 mL离心管中,将离心管放入冰盒待用。向样品中加入30 mL冰冷(4 ℃)的0.05 mol/L KCl-20 mmol/L Tris-maleate(pH 7.0)缓冲液,用KCl-Tris-maleate缓冲液淋洗刀头,8 000 r/min匀浆,20 s×3,中间间隔1 min,放回冰盒冷却,加入剩余30 mL(共60 mL)0.05 mol/L KCl-20 mmol/L Tris-maleate(pH 7.0)缓冲液淋洗刀头。4 ℃、10 000×g离心10 min,弃去上清液(水溶性蛋白)。重复一次上述匀浆和离心过程。向沉淀中加入30 mL冰冷(4 ℃)0.6 mol/L KCl溶液,用KCl淋洗刀头,在15 000 r/min匀浆,20 s×3,中间间隔1 min,放回冰盒冷却,匀浆后加入剩余30 mL(共60 mL)0.6 mol/L KCl溶液淋洗刀头。4 ℃、10 000 r/min离心20 min,取上清液(盐溶性蛋白)。量取10 mL上清液,用40 mL冰冷的超纯水稀释(得絮状物),10 000×g离心10 min,得到沉淀,即为纯化的肌原纤维蛋白。将其放于4 ℃层析柜中保存,待用。
称取一定质量的上述得到的肌原纤维蛋白,分别溶于NaCl浓度为0.1、0.2、0.3、0.4、0.5、0.6 mol/L的磷酸盐缓冲液中(50 mmol/L Na2HPO4/NaH2PO4,pH 6.5),根据需要配制成不同浓度的肌原纤维蛋白溶液,于4 ℃冷库中保存,待用。
1.3.2 溶解度的测定
参照Naresh等[12]的方法,稍加改动。将不同NaCl浓度的肌原纤维蛋白样品稀释至0.5 mg/mL,每个质量浓度样品取5 mL。4 ℃、8 000 r/min离心10 min。取上层清液以及不同NaCl浓度的肌原纤维蛋白样品各1 mL,并以磷酸盐缓冲液(50 mmol/L Na2HPO4/NaH2PO4,pH 6.5)为空白组,分别加入4 mL G250考马斯亮蓝染色液,振荡、混匀。于紫外-可见分光光度计595 nm波长处测定样品的吸光度,每个样品重复测定3 次。根据吸光度计算离心前后蛋白质质量浓度的变化。溶解度按照公式(1)计算。

式中:ρ1为离心前的蛋白质质量浓度/(mg/mL);ρ2为离心后上清液中蛋白质质量浓度/(mg/mL)。
1.3.3 乳化性的测定
参照Li Yuanyuan等[13]的方法。将不同NaCl浓度的肌原纤维蛋白样品稀释至5 mg/mL,各取3 mL蛋白样品,加入10 mL大豆色拉油,15 000 r/min匀浆60 s,立即于烧杯底部取样品60 μL,用提前配制好的0.1 g/100 mL 十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液将其稀释100 倍,剧烈振荡后立即于紫外-可见分光光度计500 nm波长处测定各样品吸光度A0,以未加入蛋白的SDS溶液作对照组。室温放置10 min,再用相同的方法测定吸光度A10,每个样品重复测定3 次。乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)分别按公式(2)、(3)计算:

式中:dil为稀释倍数;A为乳化液的吸光度;C为样品质量浓度/(g/mL);φ为乳化液中油相的比例(0.25);A0为0 min乳化液的吸光度;A10为10 min后的吸光度。
1.3.4 化学作用力的测定
参照刘海梅等[14]的方法。将不同NaCl浓度的肌原纤维蛋白样品稀释至5 mg/mL,各取2 mL蛋白样品(4 组平行),分别与10 mL的0.05 mol/L NaCl溶液(SA)、0.6 mol/L NaCl溶液(SB)、0.6 mol/L NaCl和1.5 mol/L尿素混合溶液(SC)、0.6 mol/L NaCl和8 mol/L尿素混合溶液(SD)混合。振荡均匀后,放于4 ℃层析柜中静置1 h。4 ℃、10 000×g离心20 min。用考马斯亮蓝比色法测定上清液中蛋白质的质量浓度。以溶解于SB溶液与SA溶液中蛋白质含量之差表示离子键含量;以溶解于SC溶液与SB溶液中蛋白质含量之差表示氢键的含量;以溶解于SD溶液与SC溶液中蛋白质含量之差表示疏水性相互作用的大小。
1.3.5 总巯基和活性巯基含量的测定
参照Zhang Ziye等[15]的方法,并稍加改动。总巯基含量测定:将不同NaCl浓度的肌原纤维蛋白样品稀释至5 mg/mL,各取1.5 mL蛋白样液悬浮于10.0 mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,8 mol/L尿素,pH 8.0);活性巯基含量测定:取1.5 mL 5 mg/mL不同NaCl浓度的蛋白样液悬浮于10.0 mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,pH 8.0);将以上处理样品分别加50 μL Ellman试剂(4 mg 5,5’-二硫基双-2-硝基苯甲酸(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)溶解于1 mL的Tris-甘氨酸缓冲液中),剧烈振荡后在(25±1)℃条件下水浴反应1 h,12 000×g离心10 min,同时以不加DTNB的为对照,取上清液在412 nm波长处测定吸光度,按公式(4)计算总巯基、活性巯基含量。

式中:A为412 nm波长处的吸光度;ρ为样品的蛋白质质量浓度/(mg/mL)。
1.3.6 蛋白质二级结构的测定
参照Zhang Rui等[16]的方法,并稍加改动。取少量溶于不同NaCl浓度溶液中的肌原纤维蛋白用相对应的磷酸盐缓冲液稀释至0.25 mg/mL,装于光路长度为0.2 cm的比色皿中,扫描波段为190~250 nm,扫描速率为50 nm/min,温度为25 ℃。每个样品重复扫描3 次,以相对应蛋白缓冲液作为空白,通过差减扣除缓冲液信号。蛋白质的4 种二级结构通过CDpro软件和CONTINLL程序计算而得,使用的参考蛋白为SMP56,取蛋白平均残基浓度为110 g/mol,计算波长范围为190~250 nm。
1.3.7 肌原纤维蛋白流变学特性的测定
参照吴菊清等[9]的方法,并做一些修改。用不同NaCl浓度的磷酸盐缓冲溶液将提取的肌原纤维蛋白样品配制成质量浓度为3 g/100mL的蛋白样液,采用动态流变仪的锥型板进行测定。分别将不同NaCl浓度的实验组上样于两板之间,调节两板之间的距离为1 mm,轻轻除去气泡和四周过量的样品。实验条件:温度扫描应变为1%,测试频率为1 rad/s,程序降温至20 ℃,恒温5 min,之后按1 ℃/min升温至60 ℃,然后以同样速率降至20 ℃。
1.4 数据分析
本实验中溶解度、乳化性、巯基测定为3 次独立重复实验,化学作用力测定为4 次独立重复实验,数据结果为 ±s。所有数据处理过程显著性分析均采用软件SPSS Statistics 20.0进行分析,采用Origin 8.5软件进行作图。
2 结果与分析
2.1 NaCl对大菱鲆肌原纤维蛋白溶解度的影响

图1 NaCl对肌原纤维蛋白溶解度的影响Fig. 1 Effect of NaCl concentration on solubility of MP
由图1可知,随着NaCl浓度逐渐提高,肌原纤维蛋白溶胶的溶解度随之不断增大,当NaCl浓度为0.1、0.2 mol/L时,蛋白溶解度最小,两者溶解度差异并不明显,均显著低于0.3、0.4、0.5、0.6 mol/L(P<0.05)。当NaCl浓度从0.3 mol/L增大到0.6 mol/L时,肌原纤维蛋白溶解度显著增大(P<0.05),其中NaCl的浓度为0.6 mol/L的实验组,对肌原纤维蛋白溶解度影响最大,溶解度能达到93.49%。李明清[17]研究了不同浓度盐类对鲤鱼肌原纤维蛋白的溶解性影响,结果显示:当NaCl浓度为0.1 mol/L时,只有4%肌原纤维蛋白溶解;当NaCl浓度达到0.6 mol/L时,对肌原纤维蛋白的溶解度影响最大,溶解度达到90%,这与本研究所得到的趋势一致。出现这种变化可能是因为当溶液中NaCl浓度增大时,蛋白质周围静电荷数量增加,电荷之间的静电作用使蛋白质与溶剂间相互作用增强,促使更多蛋白溶解,导致溶解度增大。
2.2 NaCl对大菱鲆肌原纤维蛋白乳化性的影响

图2 NaCl对肌原纤维蛋白EAI(A)和ESI(B)的影响Fig. 2 Effect of NaCl on EAI (A) and ESI (B) of MP
由图2A可知,随着NaCl浓度逐渐增大,大菱鲆肌原纤维蛋白EAI呈上升的趋势。NaCl浓度为0.1、0.2 mol/L的实验组其肌原纤维蛋白的EAI值达到1.4 m2/g左右,两者之间虽有差异但不显著(P>0.05)。说明离子强度低于0.2 mol/L时,随着NaCl浓度的增加并不能使肌原纤维蛋白的乳化能力得到明显改善。NaCl浓度为0.3 mol/L实验组EAI值为2.8 m2/g,显著高于浓度为0.1、0.2 mol/L的实验组(P<0.05)。0.4、0.5、0.6 mol/L EAI值达到3.3 m2/g左右,三者EAI值虽有差异但不显著,且均显著高于0.1、0.2、0.3 mol/L的实验组。本实验以NaCl浓度为0.6 mol/L实验组EAI值最大,说明此浓度下大菱鲆肌原纤维蛋白的EAI最强,能乳化的油量最多。这与吴菊清等[9]所得到的结果一致。由图2B可知,随着NaCl浓度逐渐增加,肌原纤维蛋白的ESI不断增大。NaCl浓度为0.1 mol/L的实验组肌原纤维蛋白的ESI最差,ESI为27.63 min,0.6 mol/L实验组的ESI最好,ESI为68.33 min。产生上述结果的原因可能是随着离子强度的增大,盐和蛋白质的相互作用增强,蛋白质的水化作用增大,溶解度大大上升,使得蛋白更容易向脂肪球表面靠拢,蛋白迅速移到油水界面形成界面膜参与乳化,进而提高EAI[18];对ESI而言,低离子强度时,可移动离子的屏蔽作用可以降低蛋白质之间的静电排斥[19],高离子强度时,由于增强了带静负电荷的肌球蛋白分子间的静电排斥作用[20],使得乳滴之间不易聚集和合并。因此,ESI随着离子强度的提高而呈增强趋势。
2.3 NaCl对大菱鲆肌原纤维蛋白化学作用力的影响
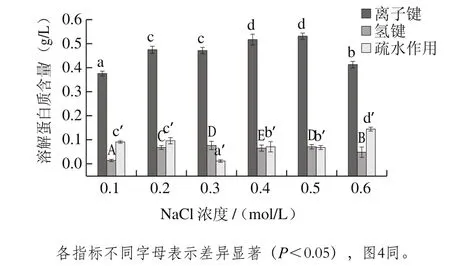
图3 NaCl浓度对肌原纤维蛋白化学作用力的影响Fig. 3 Effect of NaCl concentration on chemical forces of MP
离子浓度的改变会引起肌原纤维蛋白溶液中各种蛋白质分子组成的变化[10]。由图3可知,大菱鲆肌原纤维蛋白间的离子键会随着NaCl浓度的逐渐增高而呈先上升后下降的趋势。NaCl浓度从0.1 mol/L增加到0.5 mol/L时,离子键的含量逐渐增高。这可能是由于随着NaCl浓度增大蛋白溶解度增大,使聚集态蛋白分子分散开,促进了离子键的形成。浓度为0.2、0.3 mol/L的实验组离子键大小差异不显著,但均高于0.1 mol/L实验组。浓度为0.4、0.5 mol/L的实验组离子键大小差异不明显,但均高于浓度为0.1、0.2、0.3 mol/L实验组,浓度为0.5 mol/L的实验组离子键最大,随着盐离子浓度的继续增大,蛋白分子表面电荷分布情况发生改变,对离子键开始产生抑制作用[21]。因此,当NaCl浓度增大到0.6 mol/L时,离子键含量显著下降(P<0.05)。对氢键含量而言,大菱鲆肌原纤维蛋白中氢键的含量随着NaCl浓度的增加呈先上升后下降的趋势。NaCl浓度为0.1、0.2、0.3、0.4 mol/L的实验组氢键含量显著上升(P<0.05),NaCl浓度为0.5、0.6 mol/L的实验组呈下降趋势,且有显著差异(P<0.05)。浓度为0.3、0.5 mol/L的实验组氢键含量虽有差异但不显著。浓度为0.4 mol/L的实验组氢键含量达到最高。吴菊清等[9]研究离子强度对猪肉肌原纤维蛋白影响时发现,随着离子强度的不断增大,氢键含量先减少然后缓慢增加,接着又出现减少的趋势。由此可见,NaCl浓度的变化对大菱鲆和猪肉肌原纤维蛋白氢键有相似的影响。随着NaCl浓度逐渐增大,大菱鲆肌原纤维蛋白疏水性相互作用呈先下降后上升的趋势。NaCl浓度为0.1、0.2 mol/L的实验组蛋白质疏水相互作用虽有差异但不显著。NaCl浓度为0.3 mol/L时疏水相互作用显著下降(P<0.05),低于0.1、0.2 mol/L的实验组。NaCl浓度从0.3 mol/L上升到0.6 mol/L时,蛋白的疏水相互作用呈上升趋势,浓度为0.4、0.5 mol/L的实验组疏水相互作用差异不显著,但均明显高于0.3 mol/L、低于0.6 mol/L实验组。以0.6 mol/L的实验组疏水相互作用达到最大。这可能是由于随着NaCl浓度的增大,肌原纤维蛋白分子内部结构发生改变[22],由图3可知,离子键和氢键等含量增加促进了蛋白质与水的相互作用使疏水相互作用降低,但随着NaCl浓度的继续增加离子键、氢键的含量受到抑制,这时疏水相互作用呈增大趋势。
综合上述结果可知,随着NaCl浓度的增加离子键、氢键、疏水相互作用的含量均发生变化,可见离子强度促进肌原纤维蛋白分子空间结构发生改变。
2.4 NaCl对大菱鲆肌原纤维蛋白活性巯基和总巯基的影响
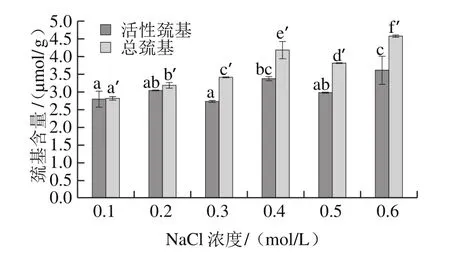
图4 NaCl对肌原纤维蛋白活性巯基和总巯基的影响Fig. 4 Effects of NaCl concentration on active and total sulfydryl contents of MP
由图4可知,肌原纤维蛋白中巯基含量丰富,随着NaCl浓度的增加,肌原纤维蛋白总巯基和活性巯基的含量均呈上升趋势。这一结果与曾淑薇等[23]研究发现,随着磷酸盐添加量的增加草鱼肌原纤维蛋白中活性巯基和总巯基含量均增加趋势一致。这可能是由于NaCl浓度逐渐增大使蛋白分子展开,二硫键断裂形成巯基暴露出来,促使活性巯基和总巯基含量均增加。魏朝贵等[9]在研究猪肉肌原纤维蛋白性质时则发现,随着NaCl浓度的增加,猪肉肌原纤维蛋白活性巯基数先增加然后趋于稳定,总巯基数几乎没有变化。可见,NaCl对鱼肉肌原纤维蛋白巯基含量的影响比猪肉大。随着NaCl浓度的增加大菱鲆肌原纤维蛋白溶解度显著增加,使部分包埋在蛋白分子内部的巯基暴露出来,从而增加活性巯基含量。其中浓度为0.6 mol/L的实验组活性巯基含量最高。
2.5 NaCl对大菱鲆肌原纤维蛋白二级结构的影响
随着NaCl浓度的升高,蛋白质分子内的氢键逐步被破坏,蛋白质分子结构会呈现由螺旋向折叠转化的趋势[24]。
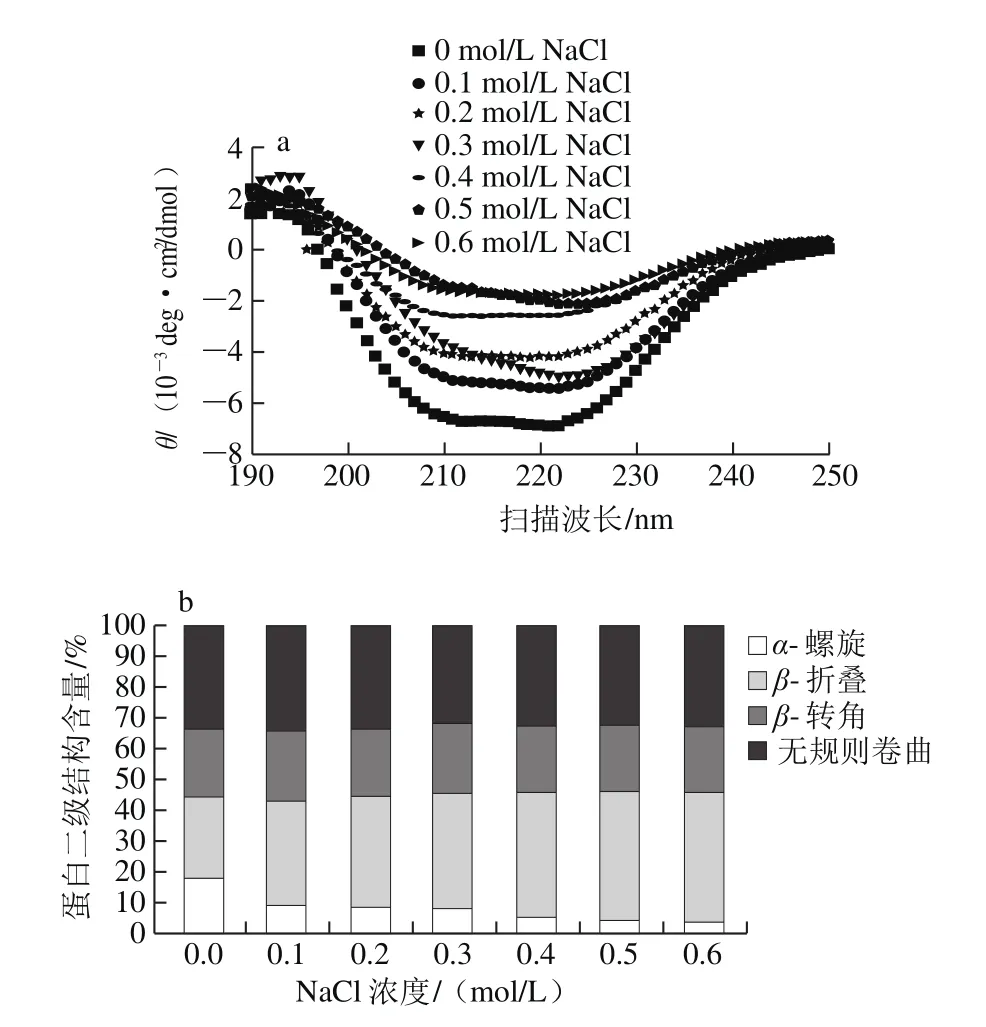
图5 NaCl对肌原纤维蛋白的CD谱图(a)和二级结构相对含量(b)的影响Fig. 5 Effect of NaCl concentration on CD spectrum (a) and relative contents of secondary structures (b) of MP
由图5a所示,CD谱在192 nm波长处出现一个正的肩缝,222 nm波长处出现一个负的肩峰,是α-螺旋结构的特征峰。在195 nm处出现一个正的肩峰,216 nm出现一个负的肩峰,是β-折叠结构的特征峰[25-26]。当盐离子浓度增加,208 nm和222 nm波长处的负极摩尔椭圆度θ降低,表明α-螺旋结构的丢失,可能形成了其他二级结构。由图5b可以看出,随着NaCl浓度的变化,对肌原纤维蛋白影响最大的是α-螺旋和β-折叠这两种二级结构,而β-转角和无规则卷曲并无明显变化。α-螺旋的相对含量由17.9%降至4.1%,降低了4.4 倍,而β-折叠的相对含量由26.2%增加至41.5%,增加了1.6 倍。可见,NaCl对大菱鲆肌原纤维蛋白二级结构的影响,主要是α-螺旋转化成了β-折叠。Kang Zhuangli等[27]发现提高猪肉糜中NaCl添加量,β-折叠含量有升高的趋势,这与本研究所得的结果一致。NaCl增加促进α-螺旋结构解折叠,形成β-折叠结构。而β-折叠结构是蛋白质集聚和形成良好凝胶的基础结构,增加肉糜体系中β-折叠的含量,有助于改善肉制品的质构特性和保水性[28]。
2.6 NaCl对大菱鲆肌原纤维流变学特性的影响

图6 NaCl对肌原纤维蛋白G’的影响Fig. 6 Effect of NaCl concentration on storage modulus (G’) of MP
由图6可知,NaCl浓度为0.1、0.2、0.3 mol/L的实验组,在28 ℃之前,G’出现阶段式下降,然后又呈阶段性上升趋势。即在28 ℃之前,大菱鲆肌原纤维蛋白随着温度升高蛋白的弹性呈阶段性下降,对于0.4、0.5、0.6 mol/L并没有观察到这种现象。这是因为肌原纤维蛋白为盐溶性蛋白,在低NaCl浓度下,肌原纤维蛋白处于不溶解的纤丝状态,在加热的过程中不能形成凝胶网络结构,弹性值极小,因此G’变化不太稳定。但当随着NaCl浓度增大,其溶解度随之增大,蛋白分子间相互吸引作用增强,G’增大。NaCl浓度为0.1、0.2、0.4、0.5、0.6 mol/L的实验组,随着温度的逐渐升高(20~60 ℃),大菱鲆肌原纤维蛋白G’的变化大致可分为3 个阶段:20~40 ℃凝胶预备区、40~45 ℃凝胶弱化区;45~60 ℃凝胶加强区。G’在40 ℃之前缓慢增加,此时部分肌球蛋白开始变性,肌球蛋白的长链相互螺旋、交织。
当温度达到40 ℃时,G’达到峰值,即此时含有不同浓度NaCl的肌原纤维蛋白储能(弹性)模量达到最大,随后开始下降。这是由于肌球蛋白的轻链部分开始变性,部分肌球蛋白尾部解链,导致蛋白的黏性和流动性增强[29]。低温加热条件下蛋白质分子相互作用增强,使其弹性变大。温度到达45 ℃时,G’降至最小值并迅速上升,蛋白质发生交联的数量增多,形成具有一定强度的凝胶网络。此时肌球蛋白与肌动蛋白发生不可逆的相互结合、交叉连接,肌球蛋白分子内部结构发生巨大改变,使弹性不断增大而黏性趋于稳定,即弹性在黏弹性体系中占主导地位[30]。本实验中大菱鲆肌原纤维蛋白G’的突变点(45 ℃)比已研究的其他物种肌原纤维蛋白变性温度偏低,这可能是由于肉的种类不同,大菱鲆肉质鲜嫩对温度变化较敏感。
3 结 论
大菱鲆肌原纤维蛋白随着介质NaCl浓度的改变,其理化特性、蛋白二级结构和流变学特性均发生不同程度变化。随着NaCl浓度增加,肌原纤维蛋白α-螺旋结构含量逐渐下降,β-折叠含量逐渐增加。NaCl浓度为0.6 mol/L时,大菱鲆肌原纤维蛋白的溶解度、EAI、ESI、总巯基和活性巯基含量、G’都高于其他实验组。综合各项指标,浓度为0.6 mol/L时,大菱鲆肌原纤维蛋白能够保持较好的特性。因此,适当提高大菱鲆肌原纤维蛋白体系中的NaCl浓度,可以起到改善肌原纤维蛋白功能特性的作用,但如何将其应用于产品加工与肉质改良还需进一步研究。
