紫草素上调RIP1和RIP3表达诱导量引发肺腺癌A549细胞程序性坏死的机制
2018-08-31张海鹏高丽娜张凯峰刘超英
张海鹏 高丽娜 隋 雨 张凯峰 刘超英
(吉林大学第一医院呼吸科,吉林 长春 130000)
非小细胞肺癌(NSCLC)占肺癌的80%,而肺腺癌占NSCLC的50%〔1~3〕。肺癌的诊断率逐年提高,但肺癌患者的5年生存率却未见显著提高〔3〕,原因之一是肺癌对传统化疗药物的耐药越来越严重〔4〕。故寻求新的通路来诱导肺癌细胞坏死迫在眉睫。而程序性坏死的出现〔5~7〕,为肺癌的治疗开辟了新的窗口,程序性坏死以形成受体相互作用蛋白酶(RIP)1和RIP3组成的坏死体为核心来诱导细胞程序性坏死〔8,9〕。紫草素(shikonin)是提取于紫草根部的萘醌类化合物〔10〕。研究证实紫草素具有诱导肿瘤细胞程序性坏死作用〔8,11~14〕,但紫草素对人肺腺癌细胞A549的作用尚无文献报道,本研究探讨紫草素对人肺腺癌A549细胞的作用并阐明其机制。
1 材料与方法
1.1主要试剂 紫草素,RIP1的特异性抑制剂Nec-1(necrostatin-1)和抗氧化抑制剂N-乙酰半胱氨酸(NAC)(N-acetyl-L-cysteine)购自Sigma公司。 RIP3的特异性抑制剂GSK(GSK-872)购自Calbiochem公司。将紫草素溶解于磷酸盐缓冲液(PBS)中,使其储存浓度为50 mmol/L。抗RIP1抗体、抗RIP3抗体和抗(MLKL)抗体购自Abcam公司。 β-actin抗体购自Santa Cruz公司。 其他试剂购自Sigma公司,Annexin V-异硫氰酸荧光素(FITC)试剂盒购自Invitrogen公司。
1.2细胞来源 人肺腺癌细胞(A549)来自中国科学院上海细胞生物学研究所(中国上海)。
1.3细胞系和细胞活力测定 将A549在补充有10%胎牛血清、2 mmol/L谷氨酰胺、100 U/ml青霉素和100 mg/ml链霉素的DMEM培养基中培养,并在37℃和5%CO2潮湿环境中维持。 实验中使用对数中期的细胞。将A549(7×104个细胞/孔)接种于96孔微量培养板上培养24 h,然后用10 μmol/L的紫草素处理24 h。 使用MTT法测定570 nm吸光度,细胞存活力=A549细胞吸光度/对照组细胞吸光度。
1.4通过Annexin V/碘化丙啶(PI)检测细胞死亡方式 细胞死亡方式的探寻是以Annexin V/PI 双染色法为基础的〔15〕。收集不同浓度紫草素处理24 h的A549。 然后,用Annexin V-FITC试剂盒评估细胞死亡形式。 将收集的细胞用磷酸盐缓冲液(PBS)洗涤两次,重悬于400 ml 1×结合缓冲液(10 mmol/L HEPES/NaOH,140 mmol/L NaCl,2.5 mmol/L CaCl2,pH7.4)。将细胞(100 μl)转移至含有5 μl Annexin V-FITC和10 μl PI的5 ml培养管中,然后在室温下避光孵育15 min。每个管中加入1×结合缓冲液后,通过流式细胞术分析染色的细胞。 使用CELLquest软件分析细胞死亡率。 通过每管收集20 000个细胞进行数据采集,并确定每个实验条件下活细胞和死细胞的数量。
1.5Western印迹检测蛋白表达 用刮刀收集后通过离心收集A549在4℃以1 000 r/min离心10 min以获得上清液。 使用Bio-Rad蛋白质试剂盒测定蛋白质含量。将等量的蛋白质在10%聚丙烯酰胺(SDS)凝胶上电泳并转移到聚偏氟乙烯(PVDF)膜(Millipore,Billerica,MA,USA)。 在室温下用磷酸盐吐温缓冲液(PBST)中的3%牛血清白蛋白封闭膜30 min,然后在4℃用抗RIP1(1∶1 000)、抗RIP3(1∶1 000)、抗MLKL(1∶1 000)抗体、抗β-actin(1∶1 500)抗体孵育。与辣根过氧化物酶缀合的山羊抗兔IgG(1∶2 000)孵育后,洗涤印迹,并在具有增强化学发光的Kodak X-omat LS膜(Eastman Kodak Company,NewHaven,CT)上显现免疫反应性蛋白质(Amersham Biosciences,Piscataway NJ)。使用柯达ID图像分析软件进行密度测量。
1.6测量细胞内活性氧(ROS) 将A549细胞(7×104个/孔)接种于96孔微量培养板上并培养24 h,然后用目标化合物处理24 h。 使用氧化还原敏感染料2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针评估细胞内ROS水平。 将所有实验细胞在PBS中洗涤两次,并用20 mmol/L DCFH-DA在黑暗中染色30 min。细胞用1%Triton X-100溶解后,在485 nm的波长下测量荧光,使用荧光光谱仪(HTS7000,Perkin Elmer,Boston,MA)的发射波长为530 nm。ROS水平以对照的百分比表示。
1.7统计分析 采用SPSS19.0进行One-way ANOVA分析。
2 结 果
2.1紫草素对A549细胞活性抑制 相比于对照组(0 μmol/L),用紫草素处理的A549细胞存活率明显下降(P<0.001),2、4、8、16 μmol/L的紫草素作用24 h后,肺腺癌A549细胞的生存率分别为(94.84±2.08)%、(87.98±1.93)%、(62.79±2.46)%、(26.36±2.83)%;紫草素浓度梯度下RIP1和RIP3蛋白水平变化见图1;实验结果表明紫草素抑制A549细胞活性与浓度有关。基于以上数据,确定的紫草素半数致死量浓度(IC50)为10.5 μmol/L。选择10 μmol/L为药物浓度。
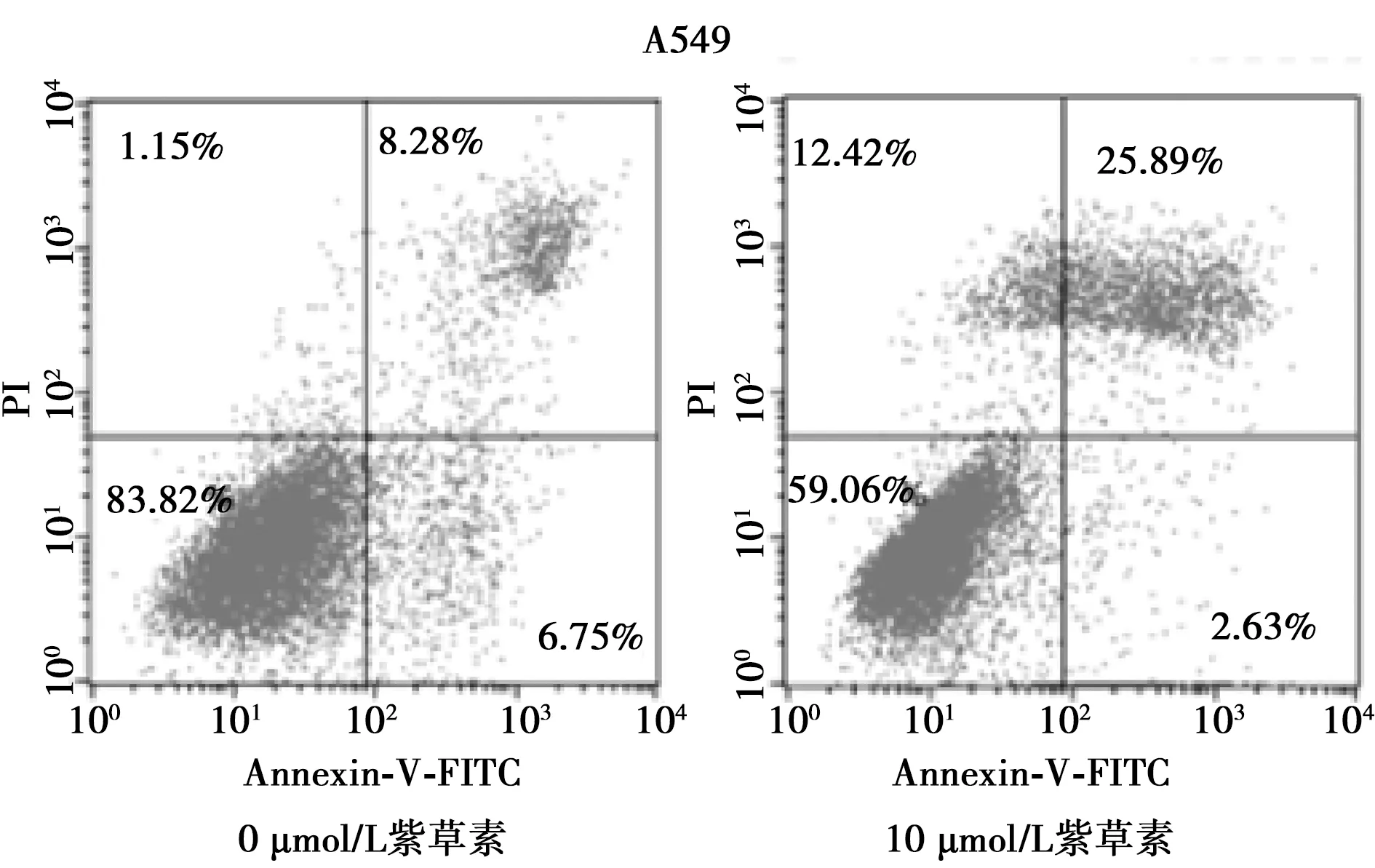
图1 0、10 μmol/L紫草素作用后A549细胞变化
2.2紫草素以坏死的方式诱导A549细胞死亡 紫草素预先处理A549细胞,然后经Annexin V/PI 双染色法染色,最后流式细胞学结果为:活细胞(即Annexin V-/PI-)的数量明显下降(P<0.001);凋亡细胞(Annexin V+/PI-)未见明显变化(P=0.178);但表现为Annexin V+/PI+和Annexin V-/PI+的坏死细胞数量较对照组明显增加(P<0.001)(图2)。与对照组(死亡率为0)相比,单加Nec-1组中肺腺癌A549细胞活性未见明显变化,细胞死亡率为3.00%±0.64%;而在5 μmol/L紫草素组,该细胞活性受到抑制,细胞死亡率为24.72%±2.50%,而同时用150 μmol/L Nec-1预处理后的5 μmol/L紫草素组中,上述细胞的活性恢复,细胞死亡率为15.25%±2.77%;10 μmol/L紫草素组细胞的死亡率为76.34%±2.76%;而在150 μmol/L Nec-1预处理后,10 μmol/L紫草素组的细胞死亡率为65.51%±0.78%。与对照组(死亡率为0)相比,单加Gsk组中肺腺癌A549细胞活性未见明显变化,细胞死亡率为2.96%±0.32%;而在5 μmol/L紫草素组,该细胞活性受到抑制,细胞死亡率为25.35%±1.39%,150 μmol/L Gsk预处理后的5 μmol/L紫草素组中,上述细胞的活性恢复,细胞死亡率为16.44%±1.87%;10 μmol/L紫草素组细胞的死亡率为76.62%±0.77%;而在150 μmol/L Gsk预处理后的10 μmol/L紫草素组细胞死亡率为65.86%±1.46%。
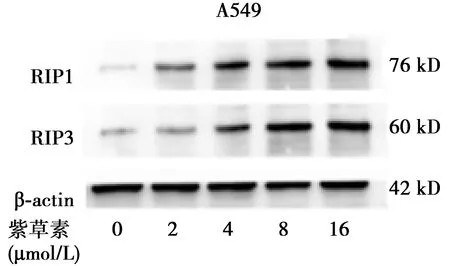
图2 紫草素浓度梯度下肺腺癌细胞RIP1、RIP3蛋白表达
2.3紫草素作用下A549细胞中RIP1和RIP3高表达 A549细胞死亡与RIP1和RIP3表达增加相关。蛋白电泳显示,紫草素预加工后的A549细胞中,RIP1和RIP3表达量显著提高(图3)。但应用Nec-1(150 μmol/L)预处理肺腺癌A549细胞,MTT法表明实验组中Nec-1明显地解除了紫草素对于肺腺癌A549的活性抑制,且蛋白电泳也支持上述结果。GSK(5 μmol/L)预处理细胞后,也得到类似的结果(图3)。
2.4紫草素通过RIP1/RIP3来影响A549细胞ROS水平 使用DCFH-DA作为探针来检测紫草素处理后A549细胞ROS水平较对照明显升高(P<0.001)。应用NAC后,A549细胞内ROS水平下降显著(P<0.001)。同样使用Nec-1及GSK后也具有相近结果(图4)。无论单独应用Nec-1、GSK或NAC后,A549细胞中ROS较对照组均无明显变化(均为1);而在5 μmol/L紫草素处理后ROS水平升高,为150.44±3.469 4,同时Nec-1、GSK及NAC处理后ROS浓度明显升高,分别为133.33±3.511 9、135.00±4.582 6和130.67±7.767 5;10 μmol/L紫草素处理后ROS水平升高,为231.67±2.081 7,同时Nec-1、GSK及NAC处理后ROS浓度明显升高,分别为197.00±3.000 0、213.00±1.732 0和183.67±2.516 6。混合谱系激酶结构域样蛋白(MLKL)参与ROS产生中,故MLKL蛋白水平变化随ROS变化。故RIP1和RIP3与ROS表达有关(图4)。
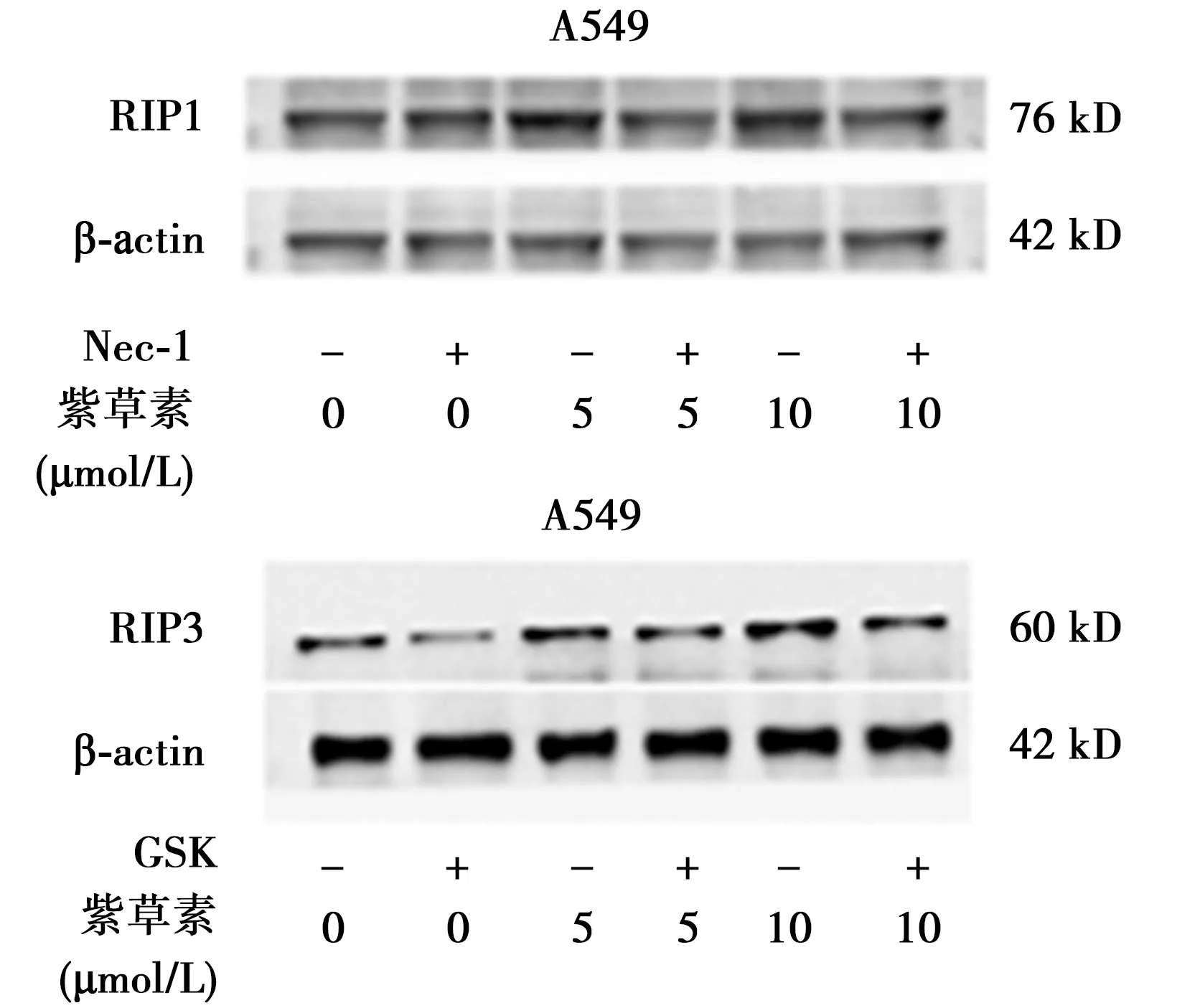
图3 紫草素对A549细胞RIP1、RIP3蛋白表达的影响
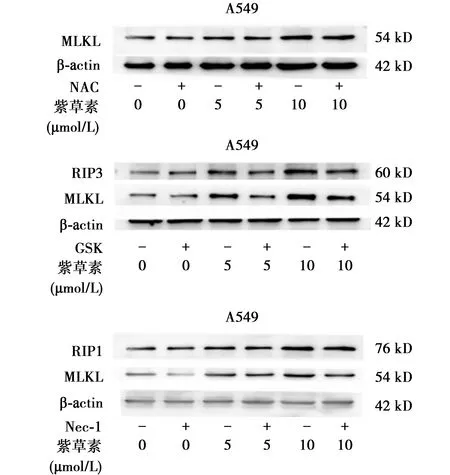
图4 紫草素通过RIP1/RIP3来影响A549细胞MLKL、RIP1、RIP3蛋白表达水平
3 讨 论
Huang等〔8〕认为紫草素使RIP1表达量升高而使胶质瘤细胞死亡。Chen等〔12〕考虑紫草素诱导的RIP3变化在胰腺癌细胞的程序性坏死中发挥主要的作用。Fu等〔11〕证明紫草素致使结直肠癌细胞依赖RIP1和RIP3发生程序性坏死。
本研究表明:紫草素对于A549细胞具有杀伤作用,且与紫草素浓度有关,随着其浓度升高,RIP1和RIP3的表达量增多。但其诱导肿瘤细胞死亡机制尚有争议。Chen等〔12〕认为凋亡是紫草素诱导胰腺癌细胞死亡的方式;而在脑胶质瘤细胞及结直肠癌细胞里则主要以程序性坏死方式死亡〔8,11〕。这意味着紫草素可能通过不同的途径在不同的肿瘤细胞中起作用。本文结果表明,A549细胞是以坏死为主要死亡形式;这与之前的报道一致〔13〕。
本文结果表明,程序性坏死的特异性抑制剂解除了紫草素的抑制作用,这一证据也支持紫草素诱导的坏死为程序性坏死。同时结合程序性坏死的特点:①形成由RIP1和RIP3组成的坏死体〔9〕;②坏死是其主要的形态学特征〔8〕,可见紫草素作用下的A549细胞发生了程序性坏死。
虽然RIP1和RIP3参与程序性坏死,但其下游信号仍然不清楚。Kim等〔13〕认为抑制自噬可以增强紫草素对A549细胞的杀伤作用,故自噬也可能是程序性坏死的下游通路。研究证明RIP1和RIP3均与ROS的产生相关〔16,17〕。而MLKL能够调节线粒体的功能参与ROS 的表达〔18〕。本文结果证实紫草素诱导RIP1和RIP3表达量升高导致A549细胞内ROS异常表达,打破细胞内氧化还原平衡,最终导致细胞死亡。
综上,紫草素具有杀伤肺腺癌细胞的作用,且RIP1和RIP3可视为肺腺癌的靶向蛋白之一,这为肺腺癌的治疗提供了新的理论依据。
