右归丸能启动小鼠胚胎干细胞1B10和D3的生殖分化
2018-08-31向俊蓓刘绵学谢林峰
向俊蓓 刘绵学 谢林峰 万 谦
(四川护理职业学院,四川 成都 610000)
补肾中药复方右归丸是由金匮肾气丸减去“三泻”(泽泻、 茯苓、丹皮),加鹿角胶、菟丝子、杜仲、枸杞子、当归而成,具有温补肾阳作用。现代研究发现右归丸能增强机体免疫功能、保护实验性肾阳虚动物的重要脏器、调节性激素含量、抗衰老、调节环核苷酸含量、调节血浆肾素活性和醛固酮含量〔1〕。补肾中药单体齐墩果酸能够在体外诱导多种胚胎干细胞向生殖细胞方向的分化〔2,3〕,右归丸中的山茱萸含有一定量的齐墩果酸,且右归丸同为补肾中药,提示其可能也有此诱导作用。本文拟分析右归丸对干细胞分化的影响。
1 材料与方法
1.1实验动物及细胞株 20只清洁级SD大鼠,体重180~220 g,雌雄各10只,合格证号:SCXK(川)2008-19,使用许可证号:SYXK(川)2008-100。小鼠胚胎干细胞1B10来源于四川大学华西校区,小鼠胚胎干细胞D3购自中国科学院上海细胞库。
1.2药品和试剂 右归丸(批号1013451)购自北京同仁堂,药准字号为Z23020593(北京),DMEM高糖培养液(批号20130401)、胎牛血清(FBS)(批号20130405)、细胞培养用双抗(青霉素和链霉素)(批号20130315)、磷酸缓冲液(PBS)(批号20130505)、细胞消化用胰蛋白酶(批号20130408)均购自成都哈里公司;非必需氨基酸(NEAA)(批号:03985 K11)、β-巯基乙醇(β-ME)(批号:862986)由美国Gibco公司生产;白血病抑制因子(LIF)(批号:1993949)由美国Millipore公司生产;普通细胞6孔培养板(批号:04718601)和超低吸附培养6孔板(批号:10312041)由美国Corning公司生产;RNA提取试剂盒Tri Reagent(批号:4071)由美国Molecular Research Center公司生产;cDNA合成试剂盒(批号:00128824)由Fermentas公司生产;Sybr Green Qpcr试剂盒(批号:14128600)由Roche公司生产。
1.3仪器 中国优普公司制造的纯水机(UPR-I-10T);美国Thermo Scientific公司制造的CO2细胞培养箱(3111);中国苏州净化公司制造的超净工作台(SW-CJ-2FD);中国Anke公司制造的50 ml离心机(TDL-40B);美国Thermo公司制造的高速台式冷冻离心机(Legend Micro 17R);Leica公司制造的倒置显微镜(DMI3000B);Bio-Rad公司制造的定量PCR仪(CFX96)。
1.4培养小鼠胚胎干细胞 使用小鼠胚胎成纤维细胞NIH3T3培养1B10和D3的饲养层细胞。用DMEM高糖培养液培养NIH3T3,DMEM高糖培养液成分:10% FBS、100 U/ml盘尼西林、0.1 mg/ml 链霉素。培养干细胞的DMEM高糖培养液成分:17% FBS、100 U/ml 盘尼西林、0.1 mg/ml 链霉素、0.1 mmol/L NEAA、0.1 mmol/L β-ME、1 000 U/ml LIF。培养孔中的NIH3T3生长到90%汇合度时,加入丝裂霉素C,至终浓度为10 μg/ml。放入细胞培养箱中孵育3 h,之后用无菌PBS清洗细胞5次,加入适量的干细胞培养液,接种干细胞至培养孔,每天更换培养液,4~7 d后培养完成。
1.5诱导拟胚体(EB)的形成 诱导EB形成的培养液:DMEM高糖培养液,17% FBS、100 U/ml 盘尼西林、0.1 mg/ml 链霉素、0.1 mmol/L NEAA、0.1 mmol/L β-ME。加入胰蛋白酶消化细胞;将培养板放入细胞培养箱中孵育3 min;吹打细胞呈单细胞状态;温浴细胞混合液,利用差速贴壁法分离饲养层细胞NIH3T3和干细胞;收集混合液静置后的上清液(大部分悬浮细胞为干细胞),移入超低吸附培养板;24 h后,可观察到悬浮的类圆形诱导EB形成,收集所有EB待用。
1.6制备右归丸大鼠含药血清(YGW-RS)及空白血清(RBS) 取20只SD大鼠,适应性饲养1 w后,随机分为空白组和含药组每组10只。含药组灌服液化后的右归丸,剂量均为5.0 g/kg,给药容量均为20 ml/kg,空白组灌服蒸馏水。给药后30、60、90 min 分别眼底静脉丛取血,静置2 h,3 000 r/min离心10 min,分离每组不同时间段的血清,混匀每组3个时间段的血清,过滤除菌备用。
1.7用右归丸大鼠含药血清干预干细胞形成的诱导EB 将收集到的EB移入普通细胞培养板。24 h内EB贴壁并生长;24 h后,对相应的培养孔中分别加入YGW-RS和RBS,血清终浓度为4.5%(V/V),不加入任何血清的培养孔做空白对照(BCC)。干预72 h后,对比细胞形态的变化。
1.8实时荧光定量PCR(qPCR)分析 贴壁的EB被干预72 h后,提取各孔的总RNA,合成cDNA,以cDNA为模板进行qPCR分析,目标基因为11种与生殖分化相关的基因,Oct-4正向:CGGAAGAGAAAG CGAACTAGCA,反向:TGATTGGCGATGTGAGTGA TC;GDF-9正向:TGCTTTGCCTGGCTGTGTT,反向:TCTACAGGCAGCAGCAAGGA;Stra8正向:TGCCACCTGCAA CTCAGAAA,反向:CTGGTTCCTGGTTTAATGGAGTGT;SCP3正向:ATCTGGGAAGCCACCTTTGG,反向:CTGGAGCCTTTTCATCAGCAA;Mvh正向:CAAAGGAACA ACGCCAAACC,反向:TTGCCCAACAGCGACAAAC;ZP1正向:TCGAGCCTGGCTTTGAATACA,反向:CAA ACCGGTTCCCAAATTCAT;ZP2正向:CTCTCTTCACTCAAGCTGACCTTCT,反向:AAACCCATCCTGTGCACACA;ZP3正向:CCGGGTGTCCGTGGATAC,反向:CGA GGGTCGTGGAGTAGGAA;Itga6正向:GACATGAAGT CCGCGCATCT,反向:TGCCACCCATCTGCATT;Itgb1正向:TCCAAATAAGGAGTCTGAAACCATT,反向:GGA TGCCATGGCTTTGACA;TP2正向:CATCCGTGCACTCT CGACACT,反向:CCTCCTGACGGCCTTTCTCT;以GA PDH作为内参基因,GAPDH正向:GGCAAATTCA ACGGCACAGT,反向:GCCTCACCCCATTTGATGTT。
1.9统计学分析 应用SPSS19.0软件进行t检验。
2 结 果
2.1干细胞的生长和EB形成 1B10和D3分别在饲养层细胞NIH3T3上形成了类似“鸟巢”状的克隆,说明两种干细胞生长正常;两种干细胞都形成了类圆形的EB,说明EB形成正常,见图1。
2.2右归丸对贴壁生长EB的干预 干预后,1B10的EB贴壁生长后除了被RBS细胞干预的更细碎外,其余被干预的细胞形态相近。D3的EB贴壁生长后被各药物干预后的细胞形态相近,见图2。
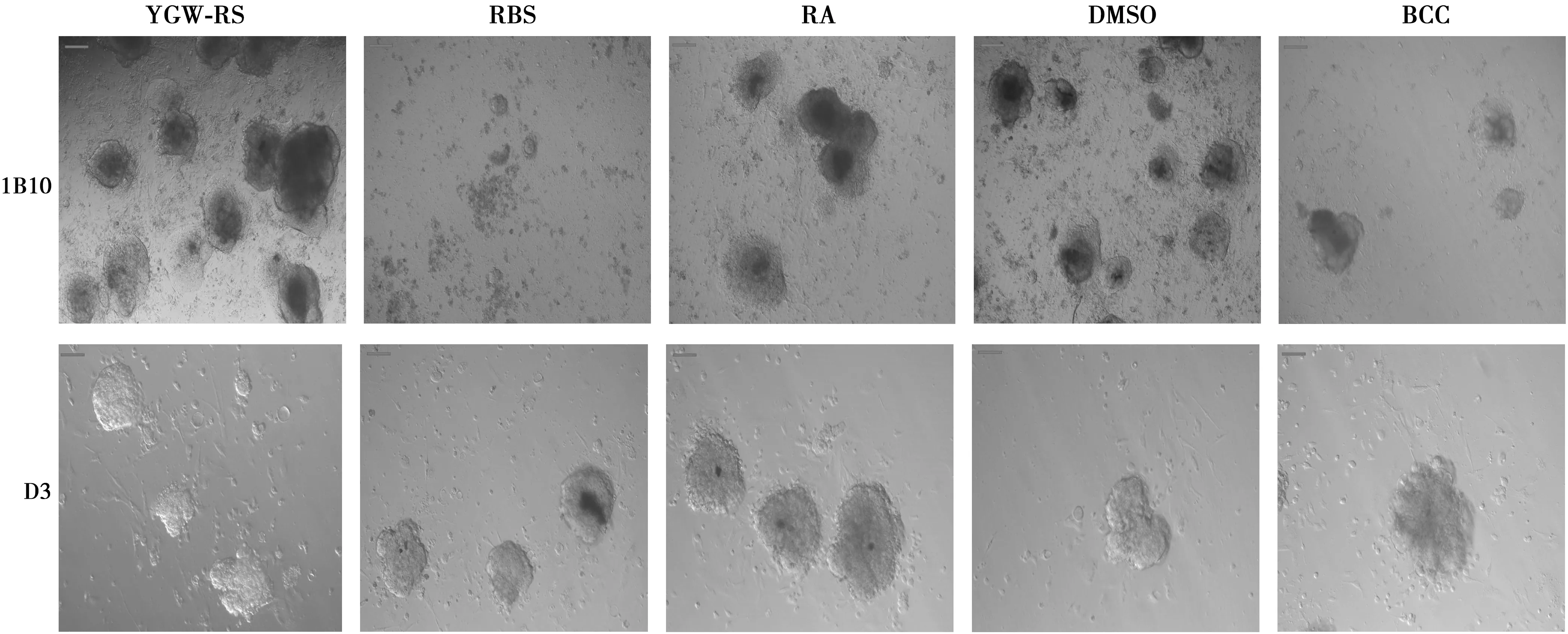
图2 干预后1B10、D3的EB贴壁生长后细胞形态(标尺=100 μm)
2.3YGW-RS对1B10和D3生殖分化的影响 对于1B10,RA显著上调Stra8、Mvh、ZP1、ZP2表达,显著下调SCP3、ZP3、Oct-4表达(P<0.05);对于D3,RA显著上调Stra8表达,显著下调Oct-4、GDF-9、SCP3、Mvh、ZP3、Itga6表达(P<0.05);对于1B10,YGW-RS显著上调Oct-4、SCP3、Mvh、ZP1、ZP2、ZP3、Itga6表达,显著下调Stra8表达(P<0.05);对于D3,YGW-RS显著上调Oct-4、GDF-9、Stra8、ZP2、TP2表达(P<0.05),见表1,表2。
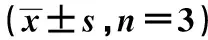
表1 RA对1B10、D3生殖分化标志基因转录表达的影响
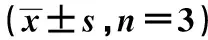
表2 YGW-RS对1B10、D3生殖分化标志基因转录表达的影响
3 讨 论
胚胎干细胞已有被成功诱导分化为生殖细胞的报道,甚至利用分化出的生殖细胞完成了受精、形成胚胎等过程〔4,5〕,而且,胚胎干细胞的多能性高于成体干细胞,理论上对右归丸可能的促分化作用更敏感。
Oct-4对于保持干细胞的多能性很重要,过低或者过高的Oct-4将导致干细胞分化〔6,7〕。GDF-9 是向雌性生殖细胞分化的早期标记基因〔8〕。Stra8是向雄性和雌性生殖细胞分化的共同的早期标记基因〔9〕。SCP3 是减数分裂的早期标记基因〔10〕。Mvh是向雌性生殖细胞和雄性生殖细胞分化的早期标记基因〔11〕。ZP1、ZP2和ZP3是卵子细胞形成的标记基因〔12〕。Itga6、Itgb1和TP2 是精子细胞形成的标记基因〔4,5〕。
本研究说明右归丸启动了1B10的雌性生殖分化,同时启动了D3的雄性和雌性生殖分化;RA启动了1B10的雄性生殖分化,RA不能启动D3的生殖分化。补肾中药复方右归丸能启动所考察的两种干细胞的生殖分化,而且表现出的诱导作用的普遍性高于公认的生殖分化诱导物RA,右归丸可能具有启动干细胞生殖分化的能力。
