CHFR、CDKN2A甲基化在食管鳞癌KYSE150、KYSE180细胞系放射抵抗中的作用
2018-08-31梅新宇解明然吴显宁
梅新宇 程 民 王 亮 解明然 吴显宁
(中国科学技术大学附属第一医院 安徽省立医院胸外科,安徽 合肥 230001)
目前世界上食管癌死亡率占所有肿瘤死亡率第六位〔1,2〕,亚洲国家主要病理类型为鳞状细胞癌〔3〕。DNA甲基化为重要的表观遗传学改变,指的是腺嘌呤(A)或者胞嘧啶(C)的碱基在DNA甲基转移酶作用下与甲基发生共价结合的现象〔4〕。抑癌基因甲基化会致抑癌基因表达缺失或抑制,导致肿瘤发生,而食管鳞癌中多种调控细胞凋亡、细胞周期和细胞信号转导的抑癌基因甲基化也是食管鳞癌形成的原因之一〔5,6〕。放射治疗是临床食管鳞癌治疗的重要组成部分,放射抵抗是放疗失败或肿瘤局部复发的重要原因〔7,8〕。本研究旨在探讨CHFR/CDKN2A抑癌基因的DNA甲基化在放射抵抗中的生物学意义。
1 材料与方法
1.1主要试剂与仪器 食管鳞癌细胞系(KYSE150细胞、KYSE180细胞,中科院上海细胞库),RPMI1640 培养基(Thermo scientific公司),胎牛血清(天杭生物科技公司),胰蛋白酶(Solarbio),二甲基亚砜(Sigma)及75%乙醇;实验仪器包括超净工作台、CO2恒温细胞培养箱、倒置显微镜、电泳仪、流式细胞仪、超低温冰箱、荧光定量PCR仪、平底型 96 孔培养板及PyroMark Q96 ID焦磷酸测序仪等。
1.2细胞辐照实验 将存放有食管鳞癌KYSE150,KYSE180的细胞冻存管取出,复苏后进行传代培养,将在对数生长期生长的KYSE150,KYSE180细胞制作为细胞悬液,以每孔1×105个细胞分别种在6孔板中,待观察见细胞贴壁并状态良好时,将细胞贴壁生长至 80%且处于对数生长期的KYSE150,KYSE180细胞分别给予高能量 X 线(室温下条件下由 Varian CX直线加速器 6 MV-X 线分别给予8 Gy 的 X 线照射。源距离标本100 cm,照射野为 20 cm×20 cm,吸收剂量率为 1.50 Gy/min)。照射后,立即将其制成单细胞悬液(以0.25%胰蛋白酶消化并获得单细胞悬液后计数),按照1 d、3 d、5 d、7 d 分为 4 组,平均接种于25 cm培养瓶中,将细胞置入 37℃、5%的 CO2培养箱中培养,适当添加培养液,及时换培养液,直至放射抵抗的细胞克隆在细胞凋亡、坏死后形成。
1.3KYSE150,KYSE180细胞及KYSE150-8 Gy和KYSE180-8 Gy细胞DNA提取及甲基化测序 细胞系样本DNA提取,并经亚硫酸盐处理转化后,采用PyroMark Assay design2.0针对CDKN2A和CHFR基因启动子CpG岛设计PCR引物和测序引物(设计结果:CDKN2A,正义:TTGAGGAGAGGGGGAGAGTAGGT,反义:CAAACCCTCTACCCACCTAAAT。CHFR,正义:GGGGAGGGGTTAGAGGTTTTTG,反义:TTCCCCCTCCCTTCTACCCCAACA)。按PyroMark PCR Kit试剂盒(德国,Qiagen)说明书要求完成焦磷酸测序前的PCR扩增反应。反应体系为:去离子水6 μl,混合物12.5 μl,上游引物2 μl,下游引物2 μl,CoralLoad Concentrate 2.5 μl,共25 μl。反应条件如下:①95℃条件下预变性15 min;②94℃条件变性30 s;③56℃条件退火30 s;④72℃条件延伸30 s;⑤PCR在以上条件循环45次;⑥72℃温度延伸10 min。DNA扩增后将碱基、酶及底物加入容器并置入Q96或Q24仪器,在酶标版的每根管中准备预备好的微珠预混液,打开CpG软件进行焦磷酸测序。
1.4KYSE150,KYSE180细胞及KYSE150-8 Gy和KYSE180-8 Gy细胞mRNA提取与检测 采用氯仿处理样本,提取样本总RNA;按序加入RT反应的混合物,预留一个RT反应的量;取14 μl RT反应的混合物加入每根Ep管中,充分混匀后短暂离心,收集产物;37℃,孵育50 min,70℃,RT反应15 min后终止反应,产物进行实时定量PCR 反应。
1.5放射抵抗细胞系与原始细胞系细胞增殖实验 KYSE150、KYSE150-8 Gy、KYSE180及KYSE180-8 Gy细胞起始接种浓度为1×105/瓶,分别于1,3,5,7 d消化后计数,配对比较细胞系增殖能力。
1.6统计学分析 采用t检验。
2 结 果
2.1食管鳞癌细胞系甲基化程度 KYSE150细胞中CHFR基因甲基化程度为42.33%,放射抵抗细胞系KYSE150-8 Gy细胞中甲基化发生率为75.22%,放射抵抗细胞系CHFR基因甲基化发生率显著高于原始细胞系(P<0.05);而在KYSE180细胞系和放射抵抗细胞克隆KYSE150-8 Gy细胞系中发生率分别为7.36%和25.93%,放射抵抗细胞系CHFR基因甲基化发生率显著高于原始细胞系(P<0.05)。
食管鳞癌细胞系KYSE150细胞中CDKN2A基因甲基化程度为54.59%,放射抵抗细胞系KYSE150-8 Gy细胞中甲基化发生率为85.22%,放射抵抗细胞系CDKN2A基因甲基化发生率显著高于原始细胞系(P<0.05);而在KYSE180细胞系和放射抵抗细胞克隆KYSE150-8 Gy 细胞系中发生率分别为12.68%和36.96%,放射抵抗细胞系CDKN2A基因甲基化发生率显著高于原始细胞系(P<0.05)。
2.2CDKN2A及CHFR基因mRNA表达 放射抵抗的KYSE150-8 Gy,KYSE180-8 Gy细胞系中CDKN2A基因mRNA(10.070±0.026,0.122±0.072)及CHFR基因mRNA的表达(0.167±0.096,0.219±0.124)显著低于原始的KYSE150,KYSE180细胞系(1.000,1.000,1.000,1.000)(P<0.05)。
2.3细胞增殖 KYSE150-8 Gy,KYSE180-8 Gy细胞系增殖能力显著高于KYSE150,KYSE180细胞系(P<0.05)。见图1。
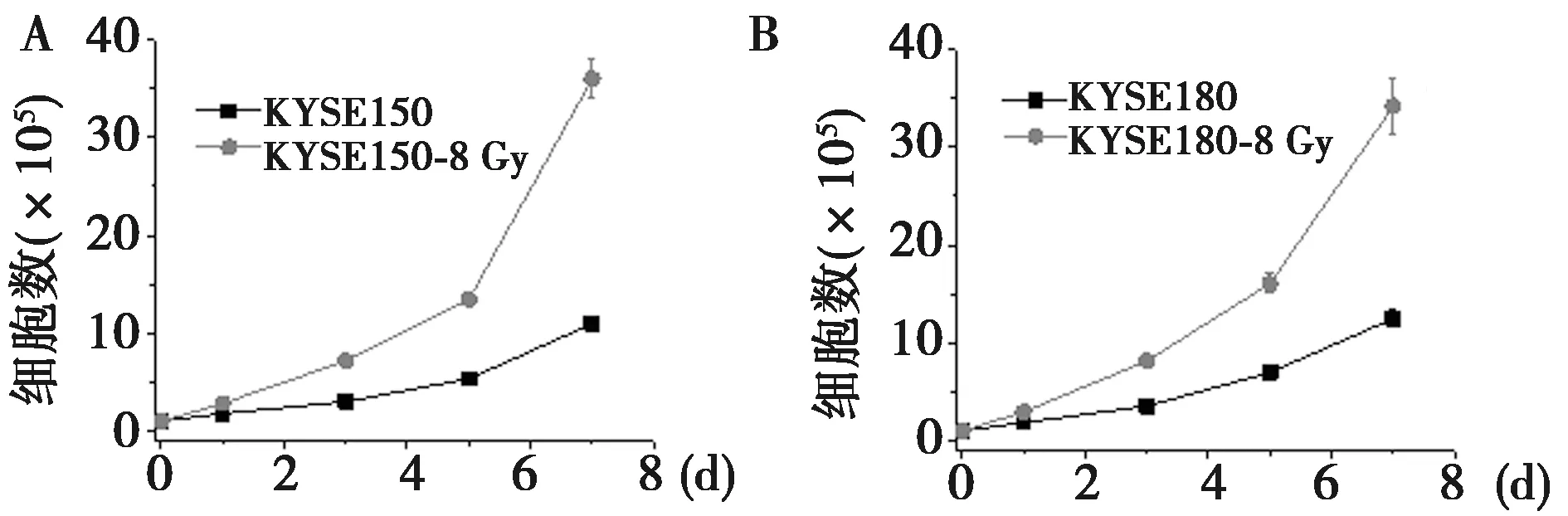
图1 KYSE150、KYSE150-8 Gy、KYSE180及KYSE180-8 Gy细胞的增殖情况
3 讨 论
放射治疗是临床食管鳞癌综合治疗的重要手段,影响食管鳞癌放射疗效的主要因素有鳞癌组织对放射线的敏感程度及癌组织对射线的耐受程度。其中放射抵抗是导致放疗失败(无效)或癌肿复发的重要原因〔7,8〕。目前在对肠癌、胃癌、乳腺癌、头颈鳞癌的研究〔9,10〕发现,对发生甲基化改变的基因进行去甲基化处理可以增强肿瘤细胞在射线治疗时的细胞毒作用,增加对射线的敏感,减少放射抵抗。食管鳞癌抑癌基因CHFR及CDKN2A的DNA甲基化具有较高的发生率。Shibata 等〔11〕检测了 15 个食管癌细胞系,其中TE5、TE6、TE9 和 TE14 细胞系的CHFR mRNA表达缺失。Morioka等〔12〕研究了38 例原发食管癌肿瘤组织,发现其中23.7%(9例)发生了甲基化,而食管正常组织中均未测到甲基化发生;CDKN2A基因启动子区异常甲基化在食管两种主要病理类型即鳞状细胞癌和腺癌中也有比较高的发生频率〔13,14〕。放射抵抗的细胞系中CHFR及CDKN2A基因甲基化可能是导致食管鳞癌放射抵抗重要原因,抑癌基因失活后所致的mRNA低表达导致抑癌基因蛋白产物的缺失,继而失去了对鳞癌细胞的抑制作用,使肿瘤的损伤修复与抗凋亡能力增强从而发挥了抗放射作用,这可能是导致食管鳞癌放射抵抗的机制之一。本文说明放射抵抗的食管鳞癌细胞具有更为恶性的生物学行为。因此,抑癌基因CHFR及CDKN2A甲基化削弱了其生物学功能,对其进行检测和干预有助于临床预测食管鳞癌的生物学行为、放射敏感性及放射抵抗特性,也为后续食管鳞癌放射增敏方法研究奠定基础。
