人食管鳞癌细胞球细胞的干细胞特性研究
2018-08-30李秋实王飒王文强慕晓玲
李秋实 王飒 ,王文强 ,慕晓玲
(1石河子大学医学院/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832000;2河南大学第一附属医院放射科,河南 开封,475000)
食管癌是目前世界范围内最常见的六大恶性肿瘤之一,其发病率在中国最高[1]。肿瘤干细胞(Cancer stem cells,CSC s)的研究,对肿瘤的临床诊断和治疗有着重要意义,食管肿瘤干细胞的分离和鉴定是研究食管癌靶向治疗的重要途径。本课题组黄燕燕[2]。通过无血清成球培养法获得食管癌Eca109细胞球并观察了其干细胞特性及p75NTR表达情况,推测细胞球中p75NTR核表达阳性的球细胞有可能是食管癌干细胞。但是细胞球细胞都是干细胞,还是仍然是异质性细胞群,未发现相关报道。
本研究从人食管癌细胞株Eca109细胞中分离培养出不同代次的细胞球细胞,观察p75NTR和Ki67的表达,并对其增殖和侵袭能力进行分析,为进一步证实细胞球细胞是癌干细胞以及p75NTR核阳性表达的球细胞是食管癌干细胞提供依据。
1 材料与方法
1.1 材料
人食管鳞癌细胞系Eca109细胞 (中国科学院上海细胞库);DMEM/F12无血清培养基、高糖DMEM培养基、胎牛血清和胰酶 (GBICO公司);B27(Invitrogen公司),兔抗人p75NTR、Ki67单克隆抗体(abcom公司);山羊抗鼠IgG-FITC二抗、山羊抗兔IgG-TRITC二抗(北京中杉金桥生物技术有限公司);Cell Counting Kit-8(日本同仁化学研究所CCK-8试剂盒);1.2 μm孔径 Matrigel Matrix基质胶 (BD公司);24 孔 Tanswell小室 (Millipore公司);LSM-510 激光共聚焦显微镜(德国CarlZeiss公司)。
1.2 方法
选取对数生长期的食管癌Eca109细胞用于实验,细胞用含10%胎牛血清的高糖DMEM培养基培养,在37℃、5%CO2培养箱内培养。显微镜下观察细胞密度达80%以上时,即可传代。
1.2.1 细胞球细胞的获得
选用添加有B27(1∶50)的无血清培养基DMEM/F12,选用对数生长期的食管癌鳞癌Eca109细胞,消化、离心,加入无血清DMEM/F12培养基稀释成1×105/mL的单细胞悬液种入培养瓶中,37℃,5%CO2培养箱中培养,待食管癌Eca109细胞形成连接紧密、体积较大的悬浮的细胞球时,再次进行传代。将实验所需代次细胞球移入含10%胎牛血清的高糖DMEM培养基中培养,这样有血清和无血清交替培养3次。取仍能在有血清高糖DMEM培养基中贴壁的细胞用于实验。观察实验所需代次细胞球细胞的成球数量并计算成球率。
1.2.2 荧光免疫细胞化学检测p75NTR、Ki67的表达
取对数生长期的细胞,消化、离心,用含10%胎牛血清的高糖DMEM培养基重悬,制成8×103/mL单细胞悬液,种入预先准备好的盖玻片上,置于37℃,5%CO2培养箱中培养24 h。取出盖玻片,4%的多聚甲醛固定20 min。1×PBS冲洗后滴加山羊封闭液37℃封闭30 min,加入一抗后4℃孵育过夜。次日,37℃复温30 min,滴加荧光二抗室温孵育2 h,最后抗荧光淬灭封片剂封片。采用激光共聚焦显微镜来观察着色部位及荧光强度。
1.2.3 CCK8法测细胞增殖情况
将对数生长期的细胞进行消化、离心,稀释成1×105/mL的单细胞悬液,在96孔板中每孔接种100 μL稀释好的细胞悬液,设空白对照组,在37℃、5%CO2培养箱中培养24 h后,每孔加10 μL CCK8液,培养2 h。在酶联免疫检测仪上450 nm波长处检测各孔的吸光度值(OD值),记录结果进行统计,并描绘其生长曲线。
1.2.4 Transwell细胞侵袭实验
Matrigel基质胶用无血清高糖DMEM培养基按1∶8稀释包被Transwell小室底部膜的上室面,4℃过夜风干;37℃预温无血清高糖DMEM培养基30 min,用无血清高糖DMEM培养基调整细胞密度为1×105/mL,上室加100 μL细胞悬液,下室加入600 μL含20%FBS的高糖DMEM培养基,放入37℃、5%CO2培养箱继续培养48 h;使用棉签轻轻擦拭,擦去上室内的细胞和基质胶,在4%的多聚甲醛中固定20 min,风干,结晶紫染色30 min,用光学显微镜观察计数(每个小室随机选取5个200×视野的细胞)。
1.2.5 统计学方法
2 结果
2.1 不同代次细胞球的特点
将食管癌Eca109细胞接种于添加B27的无血清DMEM/F12培养基中悬浮培养,至第8~11天获得一定数量又大又圆的细胞球。收集生长良好的细胞球,打散、离心制成单细胞悬液进行传代培养,仍能得到一定数量的细胞球。如此循环得到第2代直至第9代干细胞球样细胞(图1)。同时,观察并记录每代细胞球形成的时间及细胞球的大小,我们发现不同代次细胞球形成的时间均在8~11 d,细胞球的大小也无显著性差异(P>0.05)。但是第1代、3代、5代细胞球形成的数量随代数的增长依次递增(P<0.05),而第5代、7代、9代的细胞球形成数量差异不明显(P>0.05)(图2)。
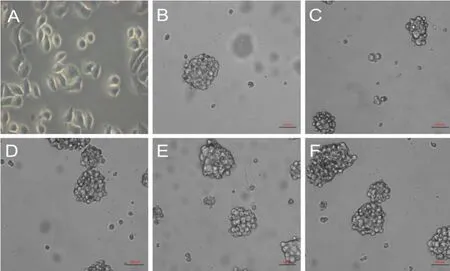
图1 食管癌Eca109细胞球的形态Fig.1 The shape of cell sphere from the esophageal
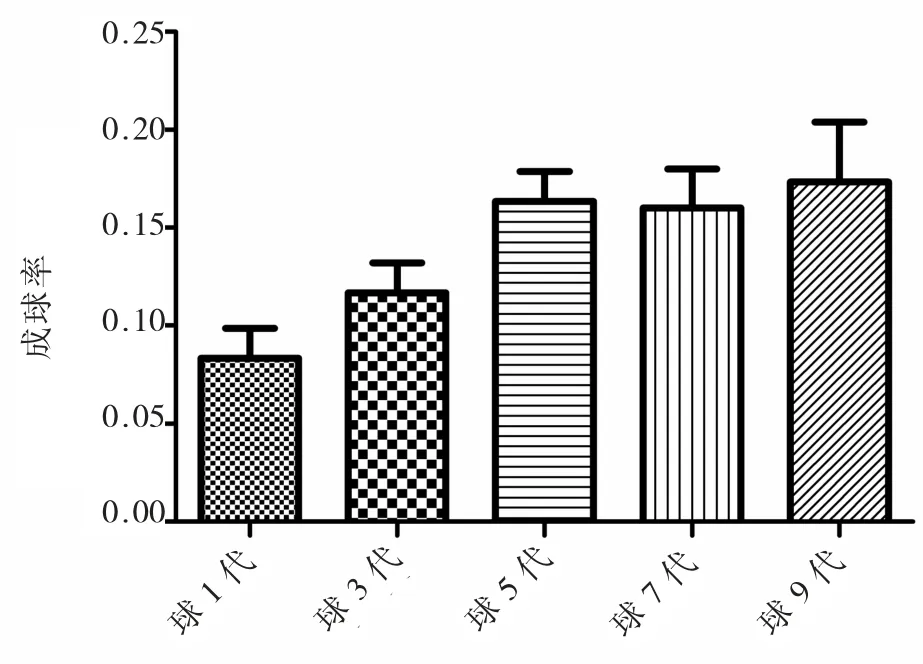
图2 不同代次细胞球细胞成球能力Fig.2 The spheres formation in different passages cells mammospheres
2.2 不同代次细胞球细胞表达p75NTR和Ki67情况
采用细胞免疫荧光法检测食管癌Eca109贴壁细胞和不同代次食管癌Eca109细胞球细胞中干细胞标记物P75NTR、Ki67的定位表达。两种蛋白在细胞上均有表达,Ki67在食管癌Eca109细胞和不同代次细胞球细胞中都定位于细胞核。其中p75NTR在食管癌Eca109贴壁细胞中荧光大部分定位于细胞浆,小部分定位于细胞核 (图3A~3D)。在第1代、3代、5代细胞球细胞中荧光定位于细胞核的数量随代数的增长依次递增(图 3E~3P)。第5代、7代、9代所有细胞均是p75NTR核阳性表达(图3M~3X)。
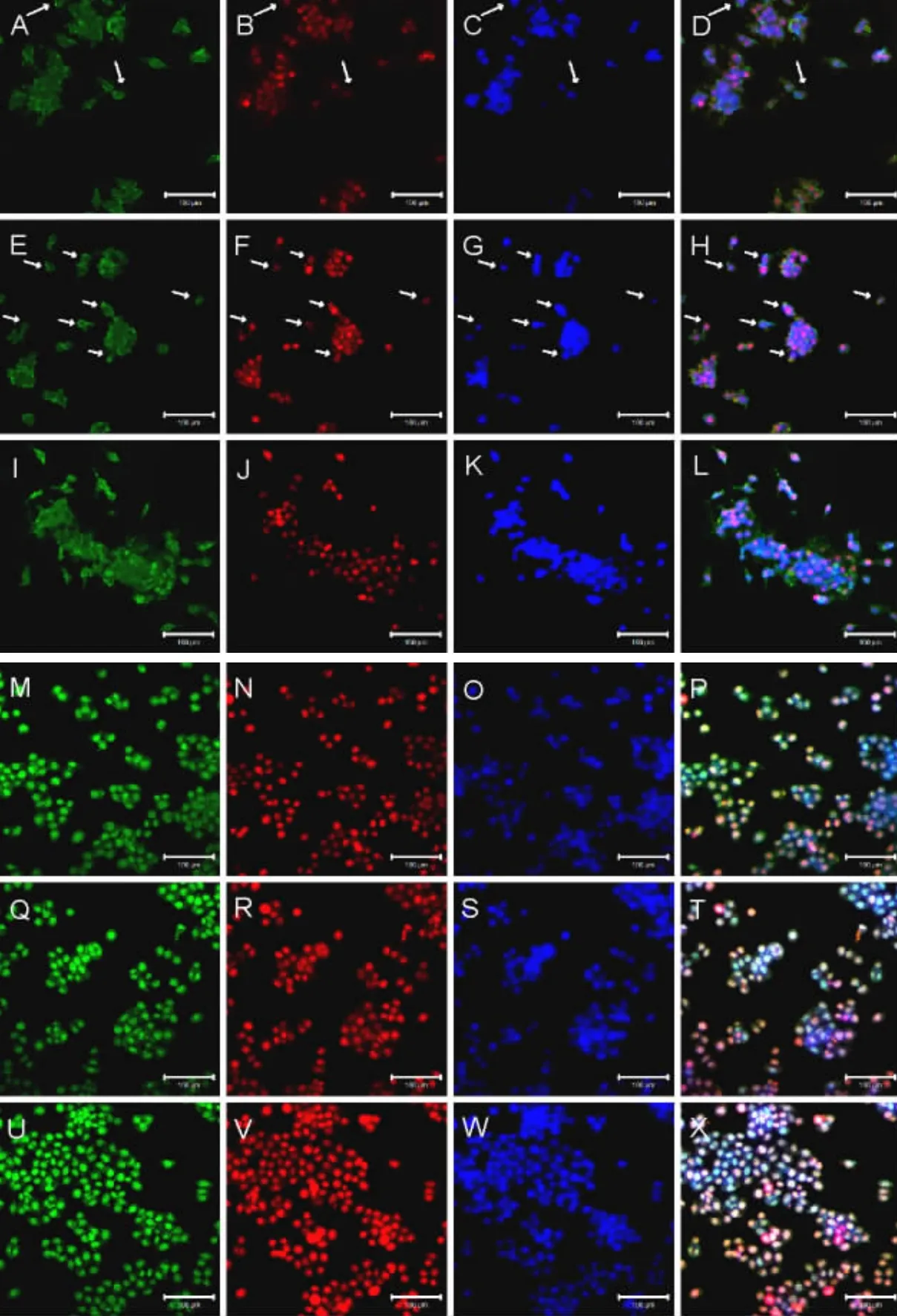
图3 Eca109细胞、不同代数Eca109细胞球p75NTR(绿)、Ki67(红)、DAPI(蓝)的表达(×200)Fig.3 Expression of p75NTR(green)、Ki67(red)and DAPI(blue)in different passages cells mammospheres(×200)
2.3 不同代次细胞球细胞增殖能力
与食管癌Eca109贴壁细胞相比,不同代次食管癌Eca109细胞球具有更强的增殖能力(P<0.05),随着食管癌Eca109细胞球代数的增长,细胞球第1代,3代,5代细胞的增殖能力依次递增(P<0.05),但是第5代之后的增殖能力并无显著差异(P>0.05)(图4)。
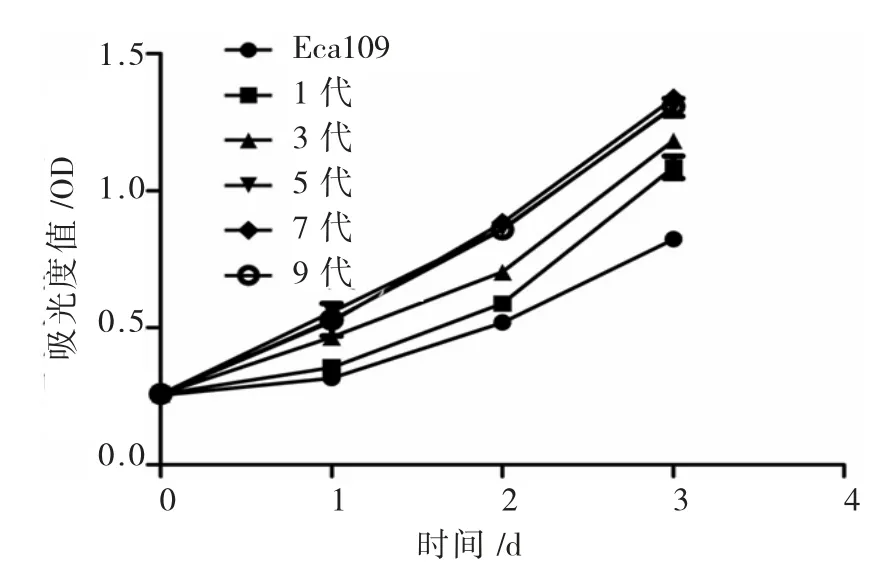
图4 Eca109细胞、不同代数Eca109细胞球增殖情况Fig.4 Cell proliferation in different passages cells mammospheres
2.4 不同代次细胞球细胞的侵袭能力
细胞侵袭能力的大小与穿过Matrigel基质胶到达滤膜的细胞数成正比,结果见(图5,图6)。
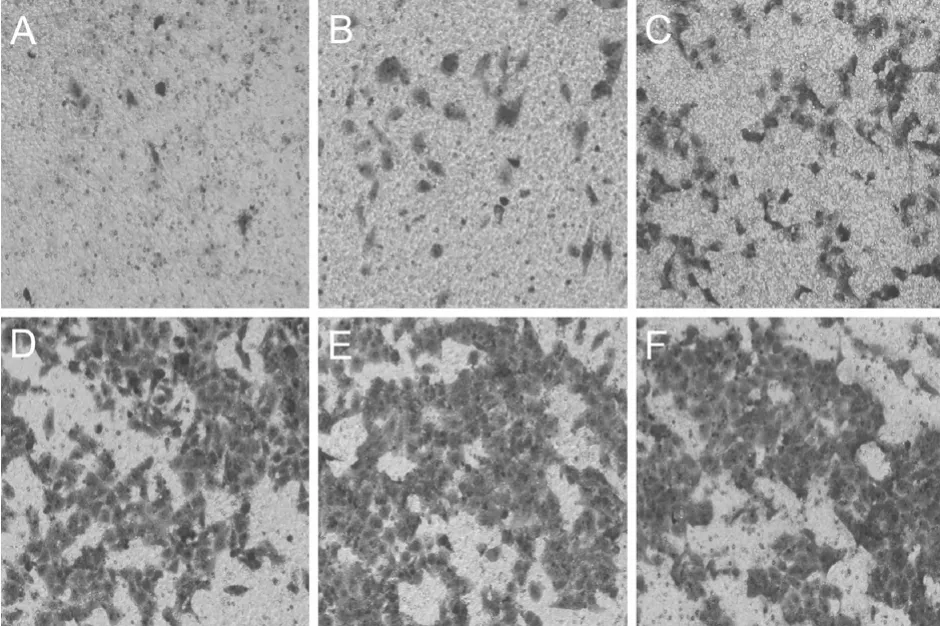
图5 不同代数Eca109细胞球Transwell侵袭能力Fig.5 Different passage cell mammospheres Transwell invasion assay
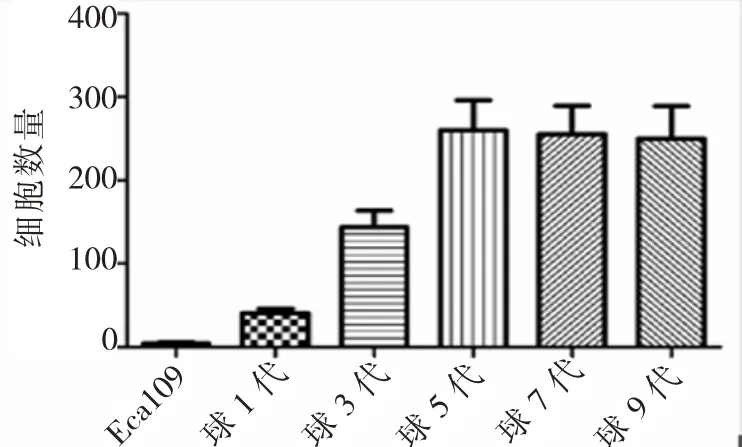
图6 不同代数Eca109细胞球Transwell侵袭能力统计结果Fig.6 The statistical results of different passage cell mammospheres Transwell invasion assay
不同代次细胞球的穿膜细胞数量均显著多于食管癌Eca109贴壁细胞(P<0.05),随着食管癌Eca109细胞球代数的增长,穿膜的细胞数量依次递增,但是食管癌Eca109细胞球第5代之后穿膜的细胞数量并无显著差异(P>0.05)。
3 讨论
已有研究结果表明,多种肿瘤细胞系中存在肿瘤干细胞。人们发现,肿瘤干细胞具有很强的分化和增殖能力,并与肿瘤的增殖、侵袭转移等过程密切相关[3-9]。肿瘤干细胞对肿瘤的研究具有重要的意义。迄今为止,人们已从多种实体肿瘤中分离并鉴定出了肿瘤干细胞,包括白血病[10]、脑肿瘤[11]、肺癌[12]、乳腺癌[13]、恶性黑素瘤[14]、前列腺癌[15]等,但对食管癌干细胞的分离鉴定尚待研究。
广泛应用的增殖细胞标记物Ki67是反映细胞增殖的指标,是一种与细胞增殖相关的核抗原[16]。Ki67在细胞的静止期不表达,仅表达在细胞的增殖阶段,Ki67高表达的细胞具有较强的增殖能力,可以促使肿瘤的发生。在多种癌前病变及肿瘤中Ki67的表达异常与多种肿瘤的增殖、浸润、转移潜能密切相关。
p75NTR,是分子量为75Da的蛋白受体,是Ⅰ型跨膜TNF超家族成员。Okumura[17]于2003年研究发现,p75NTR阳性细胞可能是食管上皮干细胞,正常食管上皮p75NTR阳性表达的细胞具有干细胞特性。随后,人们发现将食管癌中p75NTR的表达下调,会出现癌细胞的增殖抑制或凋亡。这些研究提示我们,食管癌细胞中p75NTR阳性表达的细胞相比p75NTR阴性表达的细胞可能富集更多的肿瘤干细胞。本课题组许健[18]用三氧化二砷对食管癌TE-1细胞进行诱导发现,食管癌TE-1细胞中p75NTR核表达阳性的细胞减少,认为p75NTR核表达阳性的食管癌细胞可能是食管癌干细胞。黄燕燕[2]通过无血清成球培养法获得食管癌Eca109细胞球并观察了其干细胞特性及p75NTR表达情况,结果表明细胞球中p75NTR核表达阳性的细胞可能为食管癌干细胞。
当前对食管癌干细胞的研究,还处于早期阶段。能够获得稳定的食管癌干细胞,是研究食管癌干细胞生物学机制的必备条件。本研究中,我们运用无血清培养基悬浮培养法,可以有效地富集到食管癌干细胞球样细胞,这种技术操作简便,实验重复性好[19-20]。这种方法形成的食管癌干细胞球样细胞拥有与肿瘤干细胞相似的特性。许立生[21]等研究发现,将乳腺癌MCF-7细胞球消化再传代可再形成细胞球,如此重复之后发现细胞总数可大量扩增。杨东[22]等将结肠癌干细胞球传代培养,并对比不同代次细胞球的成球率,发现结肠癌干细胞球第二代、三代的成球率明显高于第一代,第二代、第三代成球率未见明显差异。但是关于肿瘤细胞球体外更高代次的传代以及传代后其表型改变未有具体描述。为了更好地了解不同代次食管癌细胞球的表型改变,本实验用无血清培养基培养,得到第1代的食管癌干细胞球样细胞后对其进行传代,得到第2代直至第9代干细胞球样细胞,并观察每代细胞球细胞形成的时间、大小以及数量。为了更好的筛选出肿瘤干细胞,取实验用第1代、3代、5代、7代、9代的细胞球细胞,用含血清和无血清两种培养基交替培养3次,收获仍能贴壁的细胞,检测细胞特异性标志物Ki67和p75NTR的表达情况,并对其增殖、侵袭能力进行对比。
所得结果显示:每代细胞球形成的时间、大小无明显差异,但第1代、3代、5代细胞球形成的数量随代数的增长依次递增,而第5代、7代、9代的细胞球形成数量差异不明显。另外,第1代、3代、5代细胞球细胞中p75NTR核表达阳性的细胞数量随细胞球代数的增长依次递增,增殖、侵袭能力都随之相应增强;第 5代、7代、9代细胞球细胞均是p75NTR核阳性表达,同时第5代、7代、9代细胞球细胞的增殖能力、侵袭能力均未见显著差异。结合实验结果,我们发现第5代、7代、9代细胞球细胞具有更强的增殖能力、侵袭能力。
综上所述,细胞球形成实验是一个比较可靠的肿瘤干细胞评价指标,多次传代后的细胞球细胞基本完全纯化为肿瘤干细胞。我们的结果也进一步证明p75NTR核阳性表达细胞可能是食管癌干细胞。
