GDF11和维生素D对UMR106成骨样细胞增殖的影响
2018-08-30钱欢凌君曼曾莹莹曾欣李兴琳呼海燕
钱欢,凌君曼,曾莹莹,曾欣,李兴琳,呼海燕*
(成都医学院基础医学院,四川 成都,610500)
骨质疏松症作为常见的老年性疾病,目前已成为全球主要公共卫生问题之一[1]。骨质疏松症的发生与骨代谢有着密切联系。骨代谢主要是由破骨细胞介导的骨吸收和成骨细胞介导的骨形成[2],在多种代谢通路调节下共同维持骨的正常形态及功能。生长分化因子 11(growth difference factor11,GDF11)属于生长转化因子-β超家族成员,能够调节多个系统和器官如肾脏、神经系统和骨骼系统等的发育[3],也是胚胎中轴骨发育的重要调节因子[4],有文献[5]报道GDF11通过抑制PPAR-γ活性促使其蛋白泛素化(small ubiquitin-related modifier,SUMO)修饰,从而改变骨骼脆性,认为补充GDF11可以治疗老年性骨质疏松症。维生素D是维持机体健康的重要营养物质,它的活性形式为1,25(OH)2D3,在骨骼发育上起到至关重要的作用[6],主要通过1,25(OH)2D3/VDR信号[7]及OPG/RANKL系统[8]来调节成骨细胞分化,但也有学者提出BMP-2/Smads/Runx2[9-10]也是其调节途径之一。目前研究显示维生素D联合补充钙也具有预防骨质疏松的作用[11]。
虽然已知GDF11和维生素D都有治疗骨质疏松症的作用,但目前并未有GDF11和维生素D共同作用的相关实验研究报道。为此,本研究采用体外培养UMR106成骨样细胞,探讨GDF11和维生素D共同对细胞增殖以及Runx2、Osterix基因表达的影响,为骨质疏松症临床干预治疗提供新思路。
1 材料与方法
1.1 主要试剂与分组
主要试剂:维生素D(总脱钙化固醇),由四川大学魏大鹏惠赠;GDF11购自R&D systems。
实验分组:Group1:control;Group2:50 ng/mL GDF11;Group3:100 ng/mLGDF11;Group4:维生素 D;Group5:50 ng/mLGDF11+ 维生素 D;Group6:100 ng/mLGDF11+维生素D。
1.2 细胞培养
将UMR106细胞(大鼠骨肉瘤细胞株,四川大学华西口腔医学院陈雨雪教授惠赠)接种于含10%新生牛血清(四季青公司)、2%双抗(Billab公司)的DMEM高糖培养液(Gibco公司)中,置于37℃、5%CO2的恒温培养箱(上海一恒科技公司)内培养,细胞贴壁后每2 d换液1次,待细胞融合至80%~90%时使用0.25%胰蛋白酶(Sigma公司)消化,按1:2传代。
1.3 MTT法检测细胞增殖能力
将处于对数生长期的UMR106细胞消化并计数后,按5×103/孔的浓度接种于96孔板,每孔200 μL,置培养箱培养24 h,每组设8个复孔。每孔加入含药物培养液 200 μL,继续培养 24、48、72 h后,按MTT(Sigma公司)试剂说明进行操作,使用酶标仪(Bio-Rad公司)在490 nm处测吸光度(OD)值。
1.4 细胞ALP活性检测
将处于对数生长期的细胞按2×104/孔的浓度接种于24孔板中,每孔1 mL,每组5个复孔。加药分别培养24、48和72 h后,按ALP试剂盒(碧云天科技公司)操作步骤检测ALP活性:加入0.2%的Triton x-100裂解,离心取上清,取50 μL上清液加入50 μL显色底物,37℃孵育10 min,加入100 μL反应终止液终止反应,在405 nm处测OD值。使用标准品绘制标准曲线,计算碱性磷酸酶活性。
1.5 RT-PCR检测细胞Runx2 mRNA和Osterix mRNA的表达
将处于对数生长期的细胞按5×104/孔的浓度接种于6孔板中,每孔2 mL,每组4个复孔。加药分别培养24、48和72 h后,提取总RNA。按反转录试剂盒操(Takara公司)作步骤将总RNA反转录为cDNA,采用 SYBR green 染料(Takara公司)法,实时荧光定量PCR(qRT-PCR,Bio-Rad公司)检测各组细胞 Runx2及 Osterix的 mRNA表达,β-actin作为内参。反应体系为20μl,反应条件:95℃,3 min反应一个循环,95℃ 15 s,55℃ 15 s,共反应40个循环,65℃ 5 s。引物序列如下:Runx2的正向引 物 序 列 为 :5’-CCGTGTCAGCAAAACTTCTT-3’,反向引物序列为:5’-CTCACGTCGCTCATCTTGC-3’;Osterix的正向引物序列为:5’-GGACAGCCAACCCTAGCC-3’,反向引物序列为:5’-TGGAGCCACCAAACTTGC-3’;β-actin 的 正 向 引 物 序 列 为 :5’-CCCGCGAGTACAACCTTCT-3’,反向引物序列为:5’-CGTCATCCATGGCGAACT-3’,引物由成都擎科生物公司合成。反应结束后,使用溶解曲线判断特异性,将各样本的Ct值与β-actin内参基因做对照,基因相对表达量采用2-△△Ct法计算。
1.6 统计学处理
2 结果
2.1 细胞形态和数目
UMR106细胞是大鼠成骨肉瘤细胞系细胞,既具有成骨细胞的典型形态,也具有成骨细胞的生化功能[12],其活性水平较原代培养的大鼠颅骨成骨细胞高,细胞增殖周期约为20 h。
细胞培养48 h后,显微镜下观察,见大量细胞贴壁,呈铺展生长状态,细胞多呈梭形、纺锤形。加药培养24 h后,成骨细胞典型形态愈发明显,且细胞数量明显增多,呈集落生长趋势(图1)。

图1 各组细胞形态和相对数量Fig.1 Cell morphology and relative quantity in each group
2.2 GDF11和维生素D对细胞增殖的影响
GDF11和维生素D对细胞增殖的影响见图2。
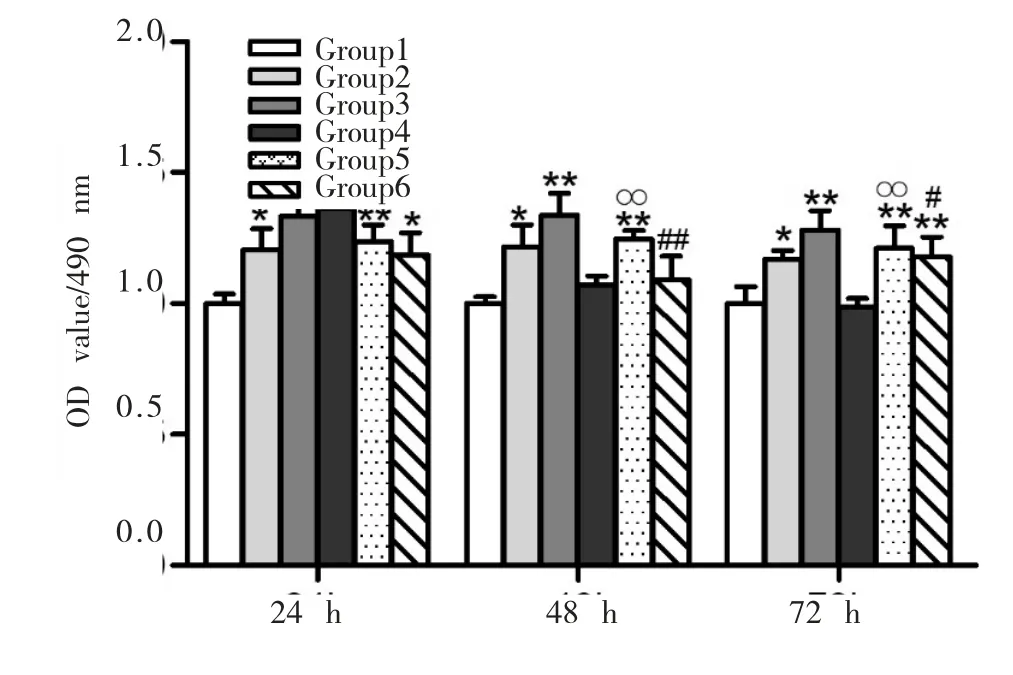
图2 GDF11和维生素D对细胞增殖的影响Fig.2 The effects of GDF11 and Vitamin D on cell proliferation
如图2A所示,细胞培养24 h后,与Control比,各组细胞增殖更为显著(P<0.05);与 Group2相比,Group5细胞增殖明显增多(P<0.01);与 Group3相比,Group6细胞增殖减少明显(P<0.01);Group4细胞增殖较 Group2、6细胞增殖更为显著(P<0.05)。培养48 h(图 2B)后,与 Control相比,Group2、3、5 细胞增殖明显增多(P<0.05),Group4、6细胞增殖无明显差异;与Group2相比,Group5细胞增殖亦明显减少(P<0.01);与 Group3相比,Group6细胞增殖明显减少(P<0.01);与 Group4 相比,Group3、5 细胞增殖明显增多(P<0.01)。培养 72 h(图 2C)后,与 Control相比,Group2、3、5 及 6 细胞增殖显著 (P<0.05),与Group2相比,Group5细胞增殖亦明显减少(P<0.01),Group4细胞增殖无明显差异;与Group3相比,Group6细胞增殖明显减少(P<0.05);与 Group4相比,其他各实验组细胞增殖明显(P<0.01)。
2.3 GDF11和维生素D对细胞ALP活性的影响
GDF11和维生素D对细胞ALP活性的影响见图3。

图3 GDF11和维生素D对细胞ALP活性的影响Fig.3 The effect of GDF11 and vitamin D on the activity of ALP in cultured cells
如图3所示,与Control相比,Group4在细胞培养 24、48和 72h后 ALP活性均无显著差异。Group2、3、5、6 ALP活性明显提高(P<0.05)。 与Group4相比,Group2、3、5、6 仅在 24、48 h ALP 活性提高有显著差异(P<0.05)。
2.4 GDF11和维生素 D对细胞 Runx2、Osterix mRNA表达的影响
GDF11和维生素D对细胞Runx2、Osterix mRNA表达的影响见图4。

图4 GDF11和维生素D对培养细胞Runx2、Osterix mRNA表达的影响Fig.4 Effects of GDF11 and vitamin D on the expression of Runx2 mRNA and Osterix mRNA in cultured cells
如图4A所示,培养24 h后,与对照组相比,Group2、3及5细胞Runx2 mRNA表达量显著提高(P<0.05),Group4、6细胞 Runx2 mRNA 表达量无明显差异。培养48 h后,与对照组相比,Group2、3及6细 胞 Runx2mRNA 表达量提高显著(P<0.05),Group4、5细胞Runx2 mRNA表达量无明显差异;与Group3相比,Group 6细胞 Runx2 mRNA表达量明显减少(P<0.01)。培养 72 h后,与对照组比,Group2、3及6细胞Runx2 mRNA表达量提高显著(P<0.05),Group4、5表达量无明显差异。
如图4B所示,培养 24 h后,与 Control比,Group2、3及6细胞Osterix mRNA表达量提高显著(P<0.05),Group4、5细胞 Osterix mRNA 表达量无明显差异;与Group2比较,Group5细胞Osterix mRNA表达量减少显著(P<0.05)。培养48 h后,与Control比,Group2、3及6细胞Osterix mRNA表达量提高显著(P<0.05),Group4、5 细胞 Osterix mRNA 表达量无显著差异。培养72 h后,与Control比,其他各组细胞Osterix mRNA表达量改变均无明显差异。
3 讨论
骨质疏松症目前已位世界常见病、多发病的第7位,是一种年龄相关的慢性疾病,其发生的主要病理机制是成骨细胞的增殖与分化受到抑制,最终导致骨量减少和骨质疏松。因此提高成骨细胞的增殖和分化是预防和治疗骨质疏松症的关键。成骨细胞主要来源于多能干细胞-骨髓间充质干细胞。当细胞高表达 Runx2和Osterix时,骨髓间充质干细胞向成骨细胞分化。Runx2是一种能够调控许多成骨相关基因(如Osterix等)转录的成骨分化特异性转录因子,可促进成骨细胞的成熟和胞外基质的分泌[13]。而Osterix是目前发现的最直接的调控骨形成的转录因子,位于Runx2的下游,它的缺失可直接使成骨细胞完全丧失骨形成能力[14]。
GDF11是近年来研究的热点抗衰老因子,与骨代谢有着密切联系。Sinha等[5]研究表明,骨质疏松症患者血浆和骨髓中的GDF11水平明显降低,补充可以增强肌肉的结构和功能。然而Weiqing Lin[15]团队则认为GDF11抑制成骨细胞分化,从而减少了骨量。我们前期实验研究发现,GDF11(50、100 ng/ml)对UMR106成骨样细胞增殖有促进作用(文章已投),说明GDF11和成骨细胞的增殖有着密切的联系。我们的实验结果表明,GDF11可通过提高Runx2、Osterix mRNA表达来促进成骨样细胞增殖和提高细胞内ALP活性,与前期实验结果一致。
维生素D是体内重要的维持钙、磷代谢稳定的一种类固醇激素,其活性代谢产物是1α,25(OH)2D3。目前研究表明大鼠服用活性维生素D3可以增加成骨细胞的数量,并提示可能与成骨细胞内存在维生素D受体有关[16]。资料显示维生素D通过OPG/RANKL信号通路对骨代谢起调节作用,维生素D促进成骨细胞的增殖[17],增殖的成骨细胞通过Runx2信号通路分泌骨保护蛋白(osteprotegerin,OPG)和破骨细胞分化因子(osteoclast differentiation factor,ODF),二者共同调节破骨细胞的形成[18],最终使成骨活动和破骨活动达到动态平衡,维持骨的正常形态和功能,实现骨重建。我们的研究结果显示,维生素D在短时间(24 h)内促进细胞增殖,但 ALP活性、Runx2 mRNA和Osterix mRNA表达增加不明显,这可能与维生素D对成骨细胞的影响与细胞的成熟程度有关[19],同时,提示维生素D对成骨细胞增殖的促进作用可能并非通过Runx2信号通路实现,与文献报道一致。但另有结果提示维生素D抑制其增殖[20]。
我们的研究结果显示,维生素D与低浓度GDF11联合应用对细胞增殖具有协同效应,而与高浓度GDF11应用,则表现为拮抗效应。GDF11均能增加ALP活性、Runx2 mRNA和Osterix mRNA表达,但与维生素D联合应用后,ALP活性、Runx2 mRNA和Osterix mRNA表达明显低于GDF11,可能是GDF11和维生素D对成骨细胞增殖的信号通路不同,且两个信号通路之间相互影响,导致Runx2 mRNA和Osterix mRNA表达减少,但具体机制尚不明确。
综上所述,GDF11可提高 Runx2、Osterix mRNA的表达,促进细胞的增殖及提高ALP活性;维生素D促进细胞增殖,可能并非通过Runx2信号通路发挥作用;维生素D影响了GDF11促进细胞增殖的作用。
