MSCs联合EPCs体外构建组织工程化血管的实验研究
2018-08-30邢立行李智伟张中洲王小义姜慧娇陈雪玲吴向未
邢立行,李智伟,张中洲,王小义,姜慧娇,陈雪玲,吴向未
(1石河子大学医学院第一附属医院肝胆外科,新疆 石河子 832008;2石河子大学医学院免疫学教研室,新疆 石河子 832002)
缺血性疾病严重影响人类的健康,目前针对此类疾病的治疗方式包括介入、溶栓、血管移植等,其中血管移植治疗效果最佳,例如冠状动脉搭桥术。然而血管移植物的来源有限,使得探索良好血管替代物成为当前研究热点。血管组织工程是利用种子细胞、支架材料制备出血管的科学,用以解决血管移植治疗中血管来源不足的问题。目前,被用于血管组织工程的种子细胞中研究最多的是间充质干细胞(MSCs)和内皮前体细胞(EPCs)[1]。Craig K 等[2-3]用MSCs作为种子细胞、Zhao Y等[4]用MSCs诱导分化得到的内皮细胞和平滑肌细胞作为种子细胞构建了组织工程化血管都得到理想效果。Quint C等[5-7]用EPCs也成功构建了组织工程化血管。Hjortnaes J等[8]首次证明在体内环境下EPCs、MSCs可联合应用于血管组织工程。本课题组研究发现共培养体系中MSCs促进EPCs增殖和血管形成[9],EPCs联合MSCs促进血管修复[10]。Gnecchi M等[11]研究发现MSCs可通过分泌bFGF在内的多种细胞因子促进血管修复及再生,bFGF能促进EPCs分化成内皮样细胞[12]。综上所述,MSCs和EPCs都可以用作血管组织工程的种子细胞,这两种细胞可互相促进增殖、分化等过程,所以本实验应用未经诱导分化成血管细胞的EPCs、MSCs体外构建组织工程化血管,通过检测CD34(血管内皮细胞特异性标记)、α-SMA(血管平滑肌细胞特异性标记)的蛋白水平探讨联合应用两种细胞是否比应用单种细胞更有利构建组织工程化血管及bFGF在构建过程中的作用。
1 材料与方法
1.1 实验动物、主要试剂及仪器
实验动物:C57BL/6小鼠,4-6周龄,购自新疆医科大学实验动物中心,雌雄不限,饲养在SPF级实验动物房,(动物合格证号为 SCXK (新)2011-0003),作为EPCs、MSCs的来源。实验试剂:低糖 DMEM、TRYPLE EXPRESS均购自 Gibco公司,EGM-2 MV购自Lonza公司,青链霉素、胎牛血清均购自Hyclong公司,聚羟基乙酸无纺布支架(PGA 5 cm×10 cm)购自上海Equl公司,0.1%Gelatin Solution明胶、鼠尾胶原、枸橼酸钠均购自北京索莱宝生物公司,Murine FGF-basic购自Peprotech公司,兔单克隆抗体[EP373Y]抗CD34、小鼠单克隆抗体 [1A4]抗alpha smooth muscle Actin购自Abcam公司,DAB显色剂、酶标山羊抗兔IgG聚合物,酶标山羊抗小鼠IgG聚合物购自中杉金桥公司。实验仪器:低速离心机(Bio-Rad公司),超净工作台(Thermo公司),荧光倒置显微镜、病理切片机(Leica公司),冰箱(海尔公司),盖玻片、载玻片(中国江苏世泰实验器材公司)。
1.2 细胞分离、培养及鉴定
小鼠骨髓来源MSCs、EPCs的分离、培养及鉴定按本实验室前期的方法[13-14]进行。将2种细胞分别培养至3代备用。
1.3 PGA支架材料的处理
将PGA剪裁成0.5 cm×0.5 cm大小,用75%酒精、紫外线消毒处理后将其移至24孔板中,吸取30 μL鼠尾胶原均匀涂抹于PGA上备用。
1.4 细胞接种及细胞、PGA复合物的培养
接种细胞分组:EPCs组、MSCs组、EPCs联合MSCs组、EPCs联合 MSCs加 bFGF(100 ng/mL)培养组。
将3代的EPCs和MSCs用配制好的低糖DMEM(LG-DMEM,1%青链霉素,10%胎牛血清)分别制成1.5×106/mL的细胞悬液,其中bFGF组用含bFGF的低糖 DMEM(LG-DMEM,1%青链霉素,10%胎牛血清,100 ng/mLbFGF)制细胞悬液,并且这一组后期均用含bFGF的DMEM制作细胞悬液及培养。EPCs组取2 mL EPCs细胞悬液,MSCs组取2 mL MSCs细胞悬液,联合组、bFGF组取EPCs和MSCs细胞悬液各1 mL共2 mL,将各组细胞悬液分别移至含PGA的孔板中。标记后移至培养箱培养。
12 h后将接种过细胞的细胞、PGA复合物移至新24孔板,按以上方法再次接种细胞,共反复接种4次后每24 h换液1次。
1.5 细胞与PGA支架材料的相容性分析
1.5.1 倒置显微镜观察
细胞、PGA复合物培养1周时在倒置显微镜下观察细胞是否贴附在PGA上,以及细胞生长状态。
1.5.2 HE染色
细胞、PGA复合物培养1周时,取出复合物并用中性福尔马林液固定;固定24 h后脱水,常规石蜡包埋,切片(切片厚4 μm),将脱蜡水化的切片依次浸入苏木素液(5 min)、酸化伊红乙醇(1 min),脱水后封片。
1.6 组织学及免疫组织化学染色
1.6.1 HE染色
培养8周的细胞、PGA复合物HE染色步骤同前。
1.6.2 免疫组织化学染色
1.6.2.1 免疫组织化学染色方法
将培养8周后的各组细胞、PGA复合物包埋蜡块,方法同前。切片后烤片2 h,二甲苯脱蜡5 min×3次;无水酒精、95%酒精、85%酒精、75%酒精梯度脱二甲苯,每次5 min。使用枸橼酸钠溶液修复抗原,高压 8 min;蒸馏水浸洗 5 min×3次;3%过氧化氢常温孵育10 min阻断内源性过氧化物酶,蒸馏水浸洗5 min×3次;滴加适量CD34(1∶100)、α-SMA(1∶100)一抗,4℃孵育过夜;次日蒸馏水浸洗5 min×3次;滴加相应二抗,37℃孵育30 min,蒸馏水浸洗5 min×3次;加DAB显色1~5 min,显微镜下观察着色情况及时用蒸馏水终止染色,苏木素复染5 min,酒精梯度脱水,二甲苯透明,晾干,中性树脂封片。
1.6.2.2 免疫组织化学染色结果判定
阳性细胞数计分:<5%为 0分;6%~25%为 1分 ;26%~50%为 2分 ;51%~75% 为 3分 ;76%~100%为4分。按染色强度计分:无着色为0分;浅棕黄色为1分;棕黄色为2分;棕褐色为3分。两项结果相乘:0~1 分为(-),2~4 分为(+),5~8 分为(++),9~12 分为(+++);(-)为阴性,(+)为弱阳性,(++~+++)为强阳性。
1.7 统计学方法
数据用 SPSS 20.0统计软件进行分析,采用均数±标准差的形式表示,多样本均数间比较,方差齐采用单因素方差分析,若方差不齐则采用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞与PGA支架材料的相容性分析
细胞、PGA复合物培养1周时,使用倒置显微镜观察到PGA支架纤维呈不规则、交错的缠绕样,大量细胞贴附在PGA支架纤维上,细胞与支架纤维的结合呈串珠状(图1A)。HE染色观察到大量未降解的紫色PGA支架纤维和少量呈紫黑色的细胞核,红色箭头所指为贴附于PGA纤维上的细胞;黑色箭头所指为PGA纤维(图1B)。以上证明MSCs、EPCs可贴附于支架纤维上并存活良好。但同一细胞、PGA复合物HE染色观察的细胞量明显少于倒置显微镜观察到的细胞量,考虑由于培养时间短,细胞与PGA支架贴附尚不够牢固,并且在HE染色的操作过程中使细胞大量脱落所致。

图1 1周时细胞与PGA相容性观察Fig.1 Observation of the compatibility between cell and PGA at 1 weeks
2.2 MSCs联合EPCs在体外培养血管的可行性分析
细胞、PGA复合物培养8周时,HE观察PGA支架纤维已接近降解,细胞数量明显增多并填充了原有支架纤维的空间。MSCs组的细胞成空泡状,细胞之间不紧密。其余组的细胞排列整齐、均匀、紧密,并可见细胞外基质样成分。组间未见明显差异(图2)。
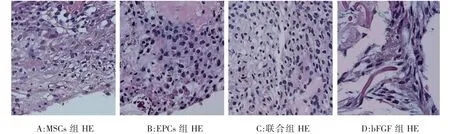
图2 8周时组织学(HE)观察(×200)Fig.2 Histology observation at 8 weeks(×200)
免疫组织化学染色结果显示:各分组α-SMA染色均为阴性,证明各分组中的干细胞都未分化成平滑肌细胞。MSCs组CD34染色为阴性,表明MSC没有或极少分化成内皮细胞。其余各组的CD34染色均为阳性(图3)。联合组的CD34染色(强阳性)评分明显高与EPCs组(弱阳性)和MSCs组(阴性),且差异有统计学意义(P<0.05)。EPCs组CD34染色评分明显高于MSCs组,且差异有统计学意义(P<0.05)(图 4)。
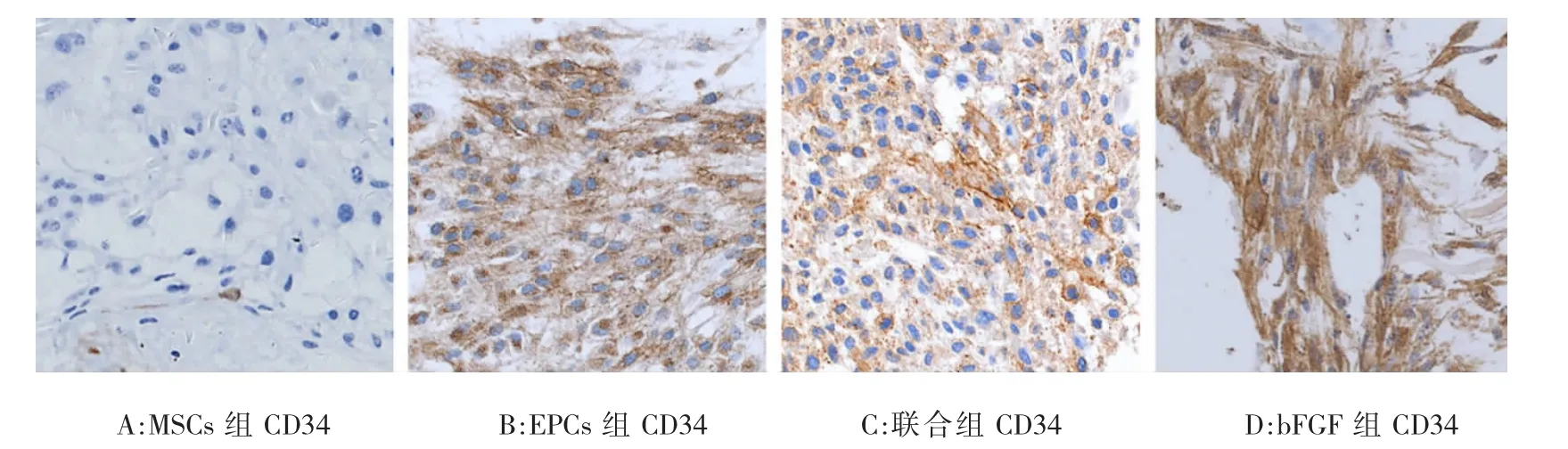
图3 8周时免疫组织化学(CD34)观察×200Fig.3 Immunohistochemistry(CD34)observation at 8 weeks(×200)
2.3 bFGF在MSCs联合EPCs体外培养血管过程中的作用
bFGF组与联合组的HE染色观察细胞增殖、PGA降解均无明显差异,免疫组织化学α-SMA染色均无着色,bFGF组的CD34染色(强阳性)评分高于联合组(强阳性),但差异没有统计学意义(P>0.05)(图 4)。
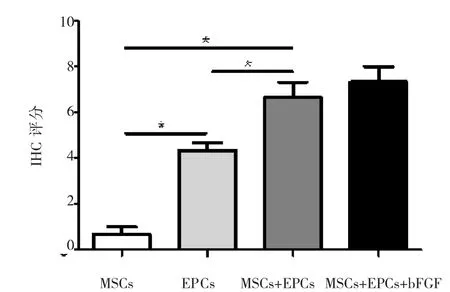
图4 8周时不同培养组的细胞、PGA复合物免疫组织化学染色(CD34)评分Fig.4 Statistical analysis of immunohistochemical staining(CD34)at 8 weeks
3 讨论
目前有许多血管组织工程的构建方法,但都离不开支架材料、种子细胞和细胞因子这三大基础。支架材料能为种子细胞及细胞分泌的细胞外基质提供支撑,并且有利于代谢。PGA支架材料对多种细胞具有亲和、支持及粘附作用,已成功应用于血管组织工程[15-16]。MSCs能分化成多种成熟细胞例如平滑肌细胞、骨细胞、软骨细胞等[17-18]。EPCs能分化成血管内皮细胞。大量研究用这两种干细胞诱导分化成的血管细胞构建组织工程化血管,使得过程复杂,并且降低了细胞的增殖能力。
为了保留种子细胞的增殖和分化能力,本实验首次应用EPCs联合MSCs在体外培养条件下构建组织工程化血管,结果证明EPCs联合MSCs培养比单种细胞培养更有利于细胞存活,并且更利于分化成内皮细胞标记阳性的细胞,即EPCs联合MSCs更利于形成血管内皮细胞。
细胞、支架材料复合物的培养环境分为静态环境和动态环境,静态环境即细胞与支架在静止状态下、没有任何外界刺激的培养条件下进行培养。动态环境分体内和体外,体外为模拟动物体内环境也称为生物反应器[19]。生物反应器即模拟体内血管的搏动和血流对血管管壁的冲刷、压力刺激[20-21],是目前较为理想培养方式。而本实验采用体外静态培养的方法,未应用力学因素刺激,可能为本实验各组细胞、PGA复合物培养后均无平滑肌细胞的重要因素。细胞因子在血管形成过程中的作用是最复杂的。现已发现近40种促血管生成因子,研究较多的有血管内皮细胞生长因子、bFGF、血管生成素和血小板衍化生长因子。bFGF具有多种生物学活性,能促进血管内皮细胞增殖,且能调节新生血管的形成。本实验中单独bFGF的应用无法达到理想的促血管生成作用,后期可尝试联合应用其他细胞因子进一步研究出理想细胞因子组合,以促进组织工程化血管的构建。
综上所述,本实验初步证明了MSCs、EPCs直接在体外联合培养构建组织工程血管可行性,但培养的血管组织不完整,无平滑肌细胞。在后期研究中可应用生物反应器培养本实验中构建的细胞、PGA复合物,并bFGF联合其他细胞因子共同应用。进一步促使EPCs联合MSCs在体外培养出既有血管内皮细胞又有血管平滑肌细胞的完整血管壁,甚至培养出完整的并具有一定强度和生长性的血管,应用于血管移植治疗,有望解决临床治疗过程中血管移植物来源不足的难题。
