快速建立CBA小鼠急性耳毒性模型的研究
2018-08-30董玉梅洪玉汪朦桂飞宋晓明杨怡谌容黄瑾杨磊
董玉梅,洪玉,汪朦,桂飞,宋晓明,杨怡,谌容,黄瑾,杨磊,*
(石河子大学医学院,新疆 石河子 832002;2杭州师范大学医学院,浙江 杭州 310000)
理想的耳毒性动物模型是研究听力损失及毛细胞再生的基础,不同物种对同一耳毒性药物的敏感性不同,甚至同一物种不同品系、不同年龄个体对同一耳毒性药物的敏感性也有很大差异[1-3],鉴于豚鼠对声音敏感性过强,造模死亡率过高,大鼠耳蜗组织结构不利于再生修复中的圆窗用药,CBA近交系小鼠个体差异小[4-5],适应性较强,购买和饲养费用低廉,繁殖率较高,在内耳的胚胎发育,解剖形态、生理稳态等方面与人类相似性非常高,逐渐成为人类耳聋研究的理想模式动物,快速建立CBA小鼠急性耳毒性模型具有巨大的潜在价值。
KM是氨基糖苷类广谱抗生素,抗菌谱和新霉素相似[6],它对耳蜗毛细胞的损伤作用研究较少,尤其是对CBA品系小鼠耳蜗基底膜毛细胞损伤方面的研究更少。Fur是一种利尿剂,可以治疗水肿性疾病也可以预防急性肾功能衰竭;然而呋塞米可引起体内水、电解质的紊乱,大剂量静脉快速注射时可引起短暂的耳鸣及听力障碍;有研究报道KM+Fur联合用药可导致耳毒性与肾毒性。因此,本研究拟通过硫酸卡那霉素联合呋塞米(KM+Fur)建立快速致聋CBA小鼠模型,通过检测ABR听力阈值的改变并结合耳蜗基底膜铺片HE染色综合观察,分析模型建立效果以及耳蜗毛细胞形态学的变化,为CBA小鼠耳蜗毛细胞损伤后再生修复,以及药物性耳聋相关性研究的治疗提供模型基础。
1 材料与方法
1.1 实验动物及分组
实验选取5-8周60只雌雄各半的健康CBA小鼠(杭州师范大学实验动物中心提供)。小鼠耳廓反应灵敏,外耳道通畅,实验前检测ABR听力阈值均正常。剪脚趾标记,随机分为空白对照组、KM+Fur后 1 d组、KM+Fur后 3 d组、KM+Fur后 7 d组、KM+Fur后 14 d组、KM+Fur后 28 d组,每组10只。
1.2 实验试剂
硫酸卡那霉素(Kanamycin sulfate,KM),呋塞米(速尿 furosemide,Fur)Sigma公司;水合氯醛;4%多聚甲醛;磷酸盐缓冲液(PBS);苏木素;伊红;无水乙醇;二甲苯;中性树脂(衢州巨化试剂有限公司)。
1.3 实验仪器与设备
听性脑干反应测试仪(美国TDT公司auditory brainstem response,ABR),解剖显微镜(Zeiss),荧光倒置显微镜(Nikon),游丝镊。
1.4 实验步骤及方法
1.4.1 药物耳聋模型的建立
本研究对CBA小鼠进行ABR阈值检测后,采取一次性皮下注射硫酸卡那霉素,半小时后腹腔注射呋塞米。硫酸卡那霉素注射剂量为1 mg/g,呋塞米注射剂量为0.5 mg/g,进行建立药物耳聋模型,空白对照组不做任何处理。
1.4.2 ABR测试
各组在给药前进行ABR阈值检测,用于排除先天聋或其他原因耳聋的动物(听力阈值>45 dB则认为该动物听力异常),在给药后各时间点进行ABR阈值检测,测试在隔音屏蔽室内用美国TDT公司听觉诱发电位仪完成。方法:动物用5%水合氯醛溶液腹腔注射(0.1 mL/10 g)麻醉后置于恒温加热垫上,记录电极置于两耳中间(颅顶处),参考电极和接地电极分别放置在给声侧耳及对侧耳部乳突处皮下,外置耳机放于小鼠耳水平处,距离10 cm,正对外耳道;刺激声为短音(click burst),刺激频率20次/秒,扫描时间为10 ms,滤波范围100~3000 Hz,叠加 1024次,从 90 dB SPL开始,每 5 dB SPL递减,直到Ⅱ波消失记录为该动物的听力阈值,分别检测每只动物左右耳听力阈值。
1.4.3 HE染色
给药后分别在不同时间进行ABR检测小鼠听力阈值,检测完成后,将小鼠用5%的水合氯醛溶液进行麻醉,麻醉后脱颈处死,取出双侧耳蜗,用4%的多聚甲醛溶液进行固定24 h,将固定好的耳蜗剖去蜗壳,取出基底膜。取好的基底膜放在载玻片上,加苏木素染色10 min。用水冲洗5~10 s,用1%的盐酸乙醇冲洗5 s。放入水或PBS中10 min返蓝。将水吸去,加伊红染色 1 min。分别用 70、75、80、85、90、95、100%(无水乙醇)的乙醇冲洗 2~5 s。二甲苯透明2~5 s,风干后用中性树胶将样本封片固定。镜下观察结果。细胞核呈蓝紫色,胞浆为淡红色。
1.5 统计学分析
首先采用F检验行样本方差齐性检验,然后采用T检验比较组间差异,以P<0.05为差异有统计学意义;ABR阈值检测数据以ABR阈值的均数表示,组间差异显著性采用SPSS22.0统计分析软件进行t检验。
2 结果
2.1 实验动物整体观察
纳入的实验小鼠为60只,随机分为6组,进行结果分析的动物为60只,实验过程中无脱失值。所有小鼠在在用药后行为表现及进食情况均正常,毛色光泽度好,未见任何中毒症状和死亡,各组小鼠用药后无强迫环绕运动、肢体外展、偏头、站立不稳等前庭功能异常现象。各组之间体重无明显差异。
2.2 建模前后ABR阈值变化
ABR检测是反映听功能的一项客观指标。小鼠听觉阈值位移(PTS)的变化,可作为本实验耳聋动物模型建立是否成功的评估依据。本研究建模前后采用自身对照,建模前先检测每组动物的左右耳听力阈值是否常,听力阈值大于45分贝的则认为该动物的听力存在问题,建立模型时则将听力存在异常的动物排除,建模时只对听力正常的动物进行给药;分别在给药后 1、3、7、14、28 d 进行样本的收集,收集样本前需进行ABR的检测,ABR检测结果表明给药后与给药前进行对比,听力阈值明显升高;建模前与建模后对比分析差异具有统计学意义(P<0.01),说明模型建立成功。
由图1可知,ABR检测的波形图在建模1 d后听力阈值明显升高,且与建模前的阈值相比较差异具有统计学意义(P<0.01);随着建模时间的延长损伤后各组之间的ABR阈值无明显变化,从功能上说明急性耳聋动物模型建立成功。
2.3 建模前后ABRⅡ波振幅的变化
小鼠一般以ABR的Ⅱ波来作为听觉反应阈值的评判标准。Ⅱ波振幅会随着声强的变化而改变,李登科[7]研究结果表明声音从低到强变化时,振幅逐渐加强。由图2可知给药后ABRⅡ波振幅显著降低,与给药前相比,差异具有统计学意义(P<0.01);而给药后各组之间进行对比,差异无统计学意义 (P>0.05)。
2.4 耳蜗基底膜HE染色铺片观察
从图3可以看出空白对照组耳蜗毛细胞的排列整齐;建模后1 d耳蜗底回毛细胞排列开始出现轻微的紊乱;建模3 d后耳蜗毛细胞排列紊乱增加;建模后7 d耳蜗毛细胞紊乱严重;建模后14 d耳蜗毛细胞已经看不出原来的排列方式;建模后28 d小鼠耳蜗毛细胞结构缺失,排列变形。由此可见,随着硫酸卡那霉素损伤时间的延长,给药后各组与空白对照组相比较外毛细胞排列越来越紊乱。
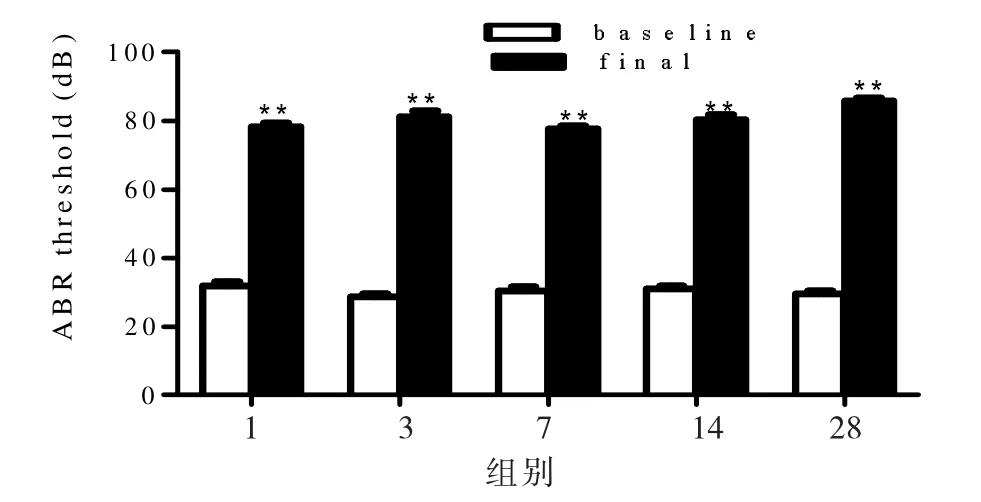
图1 建模前后ABR检测小鼠听力阈值的变化Fig.1 Changes of hearing thresholds in mice after ABR detection
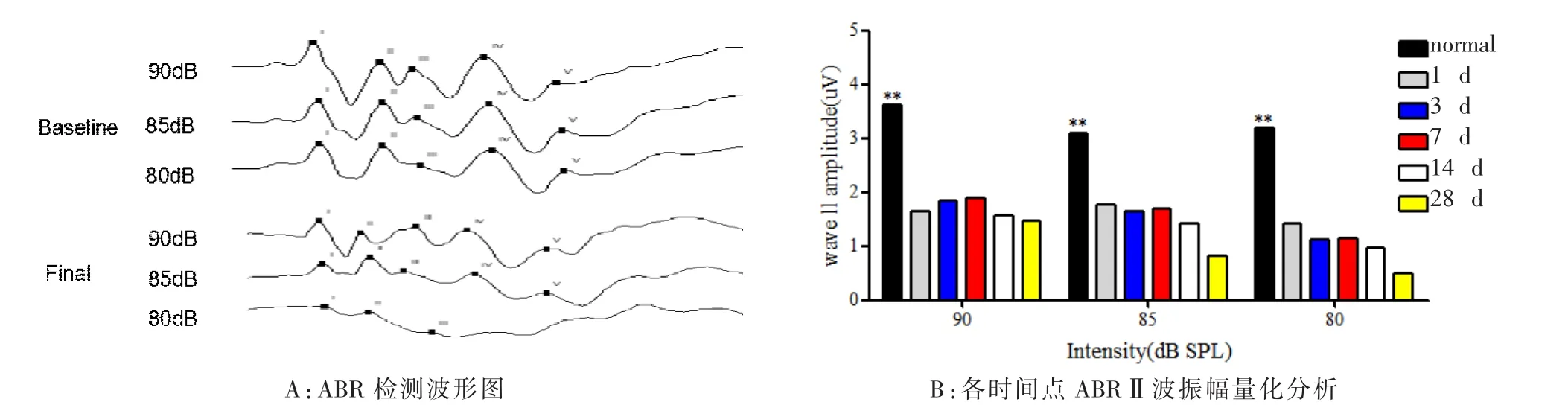
图2 ABRⅡ波振幅分析Fig.2 ABRⅡwave amplitude analysis
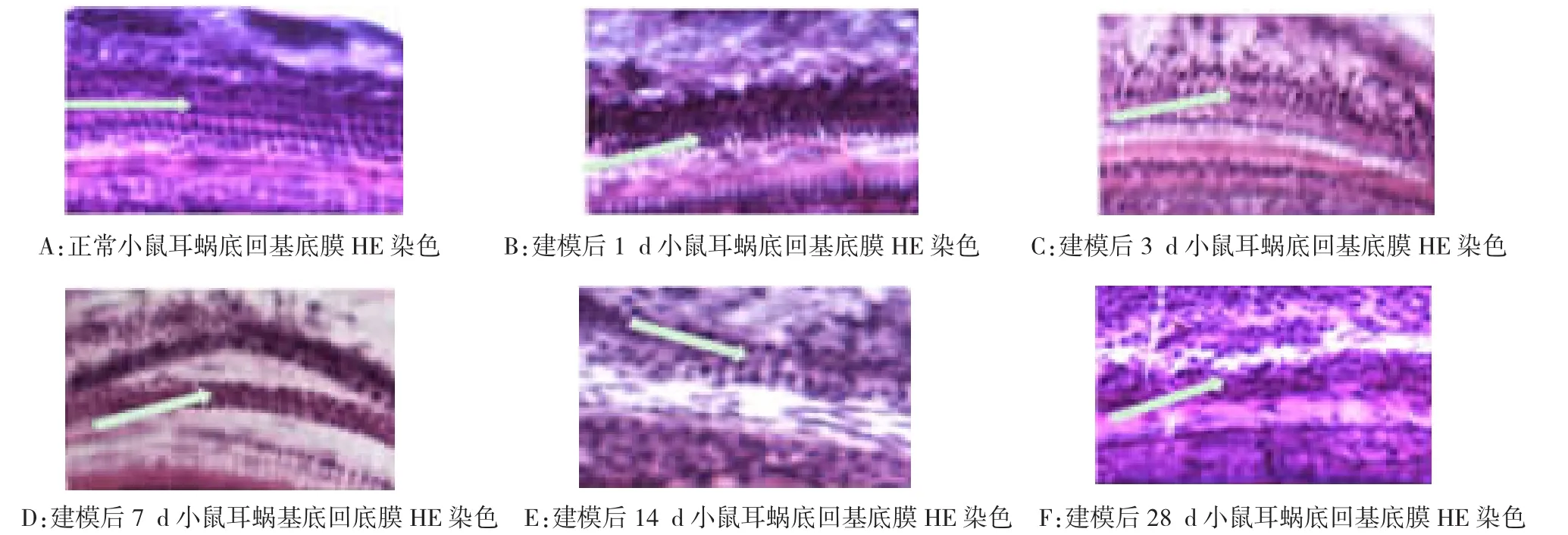
图3 观察给药后耳蜗毛细胞的形态变化HE染色Fig.3 HE staining to observe the changes of cochlear hair cells after administration
3 讨论
氨基糖苷类抗生素对耳蜗的毒性机制至今仍不完全清楚[7-8],而伴利尿剂可以促进KM进入内耳淋巴液。呋塞米或利尿酸等药物与KM联合应用时,可导致肾功能衰竭,推测其可能与伴利尿剂增强KM耳毒性的效应有关[7-8],从而导致耳蜗的功能发生不可逆的改变[9]。卡那霉素和呋塞米联合应用,可严重损伤成年豚鼠耳蜗毛细胞,耳蜗底回毛细胞受损比顶回严重[10-11]。其中外毛细胞的损伤比内毛细胞严重,而引起感音神经性聋的主要原因之一是耳蜗外毛细胞受到损伤。本研究所选用的CBA小鼠为近交系小鼠,个体差异小,降低实验过程中的误差。研究表明CBA小鼠听力阈值和潜伏期更为稳定[12],有研究用CBA小鼠进行慢性耳毒性的研究[13],但未见报道用CBA小鼠建立急性耳毒性研究模型。
本研究使用的CBA小鼠建立的KM+Fur联合用药急性药物损伤致聋模型,用自身对照的方法,减少了动物个体差异所造成的实验误差。KM和Fur联合给药1 d后小鼠的ABR阈值升高,给药后1、3、7、14、28 d组ABR阈值均高于给药前,且具有统计学差异(P<0.01);由Ⅱ波的振幅分析得出结果,给药后各组的振幅明显降低且具有统计学差异(P<0.01);HE染色结果显示,给药后1 d,外毛细胞形态基本没有改变,随着观察时间的延长,外毛细胞的排列逐渐紊乱;由ABR阈值的检测、振幅分析和HE染色的结果可以看出:本研究所建立的快速致聋CBA小鼠模型,考虑听力阈值发生改变可能是由于外毛细胞排列紊乱导致的。
综上所述,KM+Fur一次性给药,给药后1 d观察CBA小鼠ABR阈值,明显高于给药前,且给药后28 d内ABR阈值无明显变化,提示该急性损伤致聋的方法导致听力损伤是不可逆的。该方法操作简单且损伤效果明显,为药物性耳聋实验研究提供了一种简单有效的建模方法。由于本实验采用的KM+Fur剂量单一、有局限性,有待于进一步的优化。
