苯炔、喹啉及二氯甲烷三组分串联反应制备二氢喹啉衍生物
2018-08-30李志娟刘凯翦辉李文娟何林
李志娟,刘凯,翦辉,李文娟,何林*
(石河子大学化学化工学院/化工绿色过程新疆兵团重点实验室,石河子832003)
含氮杂环化合物通常具有独特的药理特性,在医药和农药方面得到了广泛的应用[1-2],并且含氮的杂环化合物比较容易进行结构修饰,是很多药物的前体化合物,因此,科研工作者不断对该类化合物进行进一步研究,以探索其在各方面的应用价值[3]。喹啉类衍生物是一种在化学分析、药物筛选等很多领域都有着重要作用的含氮杂环化合物[4],但经典的喹啉衍生物合成法,如Skraup合成法[5]、Doebner Miller合成法[6]等都是在高温、强酸等比较苛刻的条件下进行,具有一定的危险性与不实用性,并且底物适用范围较窄,所以,科研工作者一直在寻找更简单方便的方法合成此类化合物。Friedl nder合成法[7]和Ranu的微波辐照法[8]是现在应用比较广泛的合成喹啉类衍生物的方法,其中Friedl nder合成法经过一系列缩合反应得到目标产物,反应条件相对来说不太苛刻,Wang[9]和Kumar S等[10]在此基础上也进行了改进。另外,近些年来,去芳构化反应研究逐渐引起了越来越多的科研工作者的广泛兴趣,其为芳香结构的构建和功能化提供了极其有效与便捷的途径,此类反应也是合成喹啉衍生物的重要方法之一[11-12]。
苯炔是可以和各种亲核试剂反应的高活性有机中间体,近年来苯炔的合成越来越方便,常用的方法是在氟离子作用下,2-(三甲基硅基)三氟甲烷磺酸苯酯原位产生苯炔,然后它可以通过各种类型的反应生成一系列杂环化合物[13]。
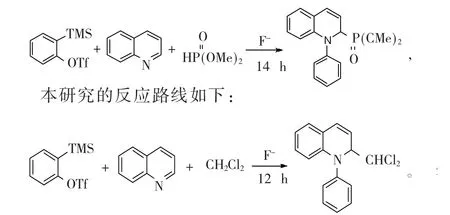
本课题组长期从事苯炔的合成,以苯炔作为主要反应物,生成含有N、O原子的杂环化合物[14-19]。在此研究的基础上,首先,假定缺电子的苯炔与富电子的喹啉发生插入的N-芳基化反应,进而生成两性离子中间体;然后与亚磷酸酯经过质子转移和亲核加成生成含氮脱芳构磷化产物[20](eq1),在条件优化时发现,当以二氯甲烷和三氯甲烷作为溶剂时,溶剂也会作为反应物参与此反应,生成氯代的杂环化合物(eq2)。本研究以2-(三甲基硅基)三氟甲烷磺酸苯酯作为苯炔前体,在二氯甲烷为溶剂的条件下与喹啉插入反应作为模型反应,进行了一系列的条件优化和底物拓展,之前研究的反应路线如下:
1 实验部分
1.1 实验仪器与试剂
1H NMR以 TMS为内标,CDCl3为溶剂,用Bruker-DMX 400型核磁共振仪测试;溶剂经过干燥处理;薄层色谱板是青岛海洋化工厂GF254硅胶板;柱层析硅胶是青岛海洋化工厂生产(200-300目);其他化学试剂均为分析纯,购买于阿拉丁化学试剂公司。
1.2 实验步骤和化合物的解构表征
1.2.1 苯炔、喹啉和二氯甲烷的三组分串联反应的一般过程
将10 mL的反应管放入红外干燥箱干燥20 min,冷却到室温后分别称取 34.9 mg(0.6 mmol)KF和 158.6 mg(0.6 mmol)18-crown-6置于该反应管中,抽真空20 min,再换氮气,如此反复3次;再在氮气的保护下加入2.0 mL无水DCM。搅拌条件下逐滴加入110 μL苯炔前体(0.45 mmol)和氮杂芳烃(0.3 mmol)。在室温下搅拌反应,TLC跟踪监测,反应结束后减压除去溶剂,剩余物通过硅胶柱层析分离得到纯净产物。
1.2.2 目标化合物的结构表征
1,2-Dihydro-1-phenyl-2-dichlormethyl-quinoline(3a)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.45-7.33(m,4H),7.26-7.20(m,1H),7.13(dd,J=7.5,1.6 Hz,1H),7.06(m,1H),6.87-6.78(m,2H),6.73(dd,J=8.2,0.9 Hz,1H),6.01(dd,J=9.6,5.3 Hz,1H),5.55(d,J=5.8 Hz,1H),4.91(m,1H)。13CNMR(100 MHz,CDCl3)δ146.1,141.1,129.8,128.8,128.7,127.4,125.2,125.1,123.0,120.1,118.4,117.4,74.2,66.9。
6-Fluoro-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3b)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.39(d,J=15.8 Hz,2H),7.31(d,J=16.0 Hz,2H),7.19(d,J=14.5 Hz,1H),6.89(dd,J=8.5,2.5 Hz,1H),6.81(d,J=15.0 Hz,2H),6.76(d,J=9.6 Hz,1H),6.10(dd,J=9.6,5.5 Hz,1H),5.51(d,J=6.5 Hz,1H),4.86-4.82(m,1H)。13CNMR(100 MHz,CDCl3)δ146.9,129.7,127.7,127.6,124.6,123.8,120.7,120.1,120.1,115.5,115.3,113.3,113.0,73.9,66.7。
6-Chloro-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3c)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.44(d,J=19.8 Hz,2H),7.35(d,J=9.8 Hz,2H),7.27(d,J=17.1 Hz,1H),7.10(d,J=2.5 Hz,1H),6.99(dd,J=8.7,2.5 Hz,1H),6.75(d,J=9.7 Hz,1H),6.60(d,J=8.7 Hz,1H),6.05(dd,J=9.7,5.3 Hz,1H),5.57(d,J=5.4 Hz,1H),4.93(m,1H)。13CNMR(100 MHz,CDCl3)δ145.4,139.9,130.0,128.5,128.0,126.8,125.8,125.5,124.6,123.9,119.4,118.1,73.9,66.9。
6-Bromo-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3d)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.58(dd,J=8.0,1.2 Hz,1H),7.42(s,2H),7.24(s,3H),7.07(s,2H),6.81(dd,J=7.4,1.6 Hz,1H),6.44-6.41(m,1H),5.80(d,J=8.3 Hz,1H),5.36(dd,J=8.3,1.6 Hz,1H)。13CNMR(100 MHz,CDCl3)δ144.6,136.2,132.7,131.2,129.5,129.3,128.4,127.4,126.5,126.3,122.7,119.4,117.9,105.8,67.5。
3-Bromo-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3e)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.35(d,J=7.0 Hz,4H),7.21(d,J=7.4 Hz,2H),7.13(d,J=8.6 Hz,3H),7.03(d,J=14.9 Hz,1H),5.66(dd,J=7.0,2.9 Hz,1H),4.98(dd,J=7.0,2.9 Hz,1H)。13CNMR(100 MHz,CDCl3)δ147.6,136.2,131.2,129.7,129.3,128.9,127.4,126.6,125.6,124.1,122.6,122.3,121.6,109.1,72.8,72.6。
4-Methyl-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3f)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.37(d,J=23.3 Hz,5H),7.19(d,J=17.1 Hz,1H),7.11(d,J=17.0 Hz,1H),6.94(m,1H),6.85(dd,J=8.1,1.1 Hz,1H),5.87(dd,J=5.6,1.4 Hz,1H),5.52(d,J=6.4 Hz,1H),4.84-4.79(m,1H),2.25-2.22(m,3H)。13CNMR(100 MHz,CDCl3)δ146.5,140.5,133.7,129.6,128.4,125.11,124.5,124.1,124.1,120.3,118.5,116.2,74.5,66.5,18.9。
4-Chloro-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3g)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.65(dd,J=7.8,1.5 Hz,1H),7.44(d,J=17.7 Hz,2H),7.36(d,J=9.8 Hz,2H),7.27(d,J=17.2 Hz,1H),7.15(d,J=17.1 Hz,1H),6.95(m,1H),6.73(dd,J=8.2,1.0 Hz,1H),6.18(d,J=5.8 Hz,1H),5.59(d,J=5.7 Hz,1H),4.95(m,1H)。13CNMR(100 MHz,CDCl3)δ145.5,130.0,129.9,125.7,125.3,125.2,121.1,120.2,117.5,115.9,73.6,67.8。
4-Bromo-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3h)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.62(dd,J=7.8,1.6 Hz,1H),7.45-7.39(m,2H),7.37-7.32(m,2H),7.30-7.22(m,1H),7.14(m,1H),6.95(m,1H),6.74(dd,J=8.2,1.1 Hz,1H),6.41(d,J=5.9 Hz,1H),5.56(d,J=6.0 Hz,1H),4.88(m,1H)。13CNMR(100 MHz,CDCl3δ145.7,141.4,130.0,129.9,127.9,125.4,124.8,122.7,122.2,120.5,120.4,118.0,73.3,68.4。
8-Chloro-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3i)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.31(d,J=15.9 Hz,3H),7.22(dd,J=7.6,1.4 Hz,1H),7.09(d,J=17.4 Hz,4H),6.84(d,J=9.3 Hz,1H),6.17(dd,J=9.3,5.9 Hz,1H),5.39(d,J=8.8 Hz,1H),4.70(dd,J=8.8,6.0 Hz,1H)。13CNMR(100 MHz,CDCl3)δ148.3,135.4,130.3,129.3,129.0,128.7,126.8,125.4,124.2,123.6,123.2,121.1,73.5,68.3。
8-Bromo-2-dichlormethyl-1-phenyl-1,2-dihydroquinoline(3j)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.49(dd,J=7.9,1.4 Hz,1H),7.28(s,2H),7.25(dd,J=7.6,1.4 Hz,1H),7.05(d,J=38.0 Hz,4H),6.81(d,J=9.3 Hz,1H),6.15(dd,J=9.3,5.9 Hz,1H),5.37(d,J=8.9 Hz,1H),4.68(dd,J=8.8,6.0Hz,1H)。13CNMR(100 MHz,CDCl3)δ148.4,133.7,129.7,129.0,126.9,126.1,124.8,123.7,123.2,121.5,73.4,68.5。
1-(3-Methoxyphenyl)-2-dichlormethyl-1,2-dihydroquinoline(3k)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.32(m,1H),7.14(dd,J=7.5,1.5 Hz,1H),7.08(m,1H),6.95(d,J=16.2 Hz,2H),6.87(d,J=14.8 Hz,1H),6.79(d,J=19.0 Hz,3H),6.02(dd,J=9.6,5.3 Hz,1H),5.57(d,J=5.9 Hz,1H),4.93(m,1H),3.83(s,3H)。13CNMR(100 MHz,CDCl3)δ160.8,147.3,130.4,128.7,128.6,127.3,123.1,120.3,118.7,117.8,117.1,110.7,110.4,74.0,66.7,55.3。
1-(2-naphthylphenyl)-2-dichlormethyl-1,2-dihydroquinoline(3l)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.85(d,J=30.0 Hz,4H),7.52(d,J=32.8 Hz,3H),7.20(dd,J=7.5,1.5 Hz,1H),7.10(d,J=17.1 Hz,1H),6.91(m,1H),6.86(d,J=9.6 Hz,1H),6.82(d,J=8.2 Hz,1H),6.07(dd,J=9.6,5.3 Hz,1H),5.64(d,J=5.9 Hz,1H),5.08-5.04(m,1H)。13CNMR(100 MHz,CDCl3)δ134.3,131.1,129.6,128.8,128.7,127.6,127.4,127.4,126.6,125.5,124.2,123.2,121.9,120.4,118.7,117.7,74.2,67.0。
1,2-Dihydro-1-phenyl-2-dichlormethyl-isoquinoline(3m)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.378(d,J=30.2 Hz,4H),7.25(q,J=7.4,6.8 Hz,4H),7.09(m,1H),6.74-6.70(m,1H),6.13(d,J=7.3 Hz,1H),5.84(d,J=8.1 Hz,1H),5.41(d,J=8.1 Hz,1H)。13CNMR(100 MHz,CDCl3)δ136.2,131.2,129.2,129.0,128.7,127.8,127.4,125.8,123.8,122.1,117.6,107.1,73.1,67.3。
6-Bromo-2-dichlormethyl-1-phenyl-1,2-dihydroisoquinoline(3n)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.58(dd,J=8.0,1.2 Hz,1H),7.42(s,2H),7.24(s,3H),7.07(s,2H),6.81(dd,J=7.4,1.6 Hz,1H),6.44-6.41(m,1H),5.80(d,J=8.3 Hz,1H),5.36(dd,J=8.3,1.6 Hz,1H)。13CNMR(100 MHz,CDCl3)δ144.6,136.2,132.7,131.2,129.5,129.3,128.4,127.4,126.5,126.3,122.7,119.4,11 7.9,105.8,67.5。
3-acetonitril-2-dichlormethyl-1-phenyl-1,2-dihydroisoquinoline(3o)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.46(s,4H),7.28(s,3H),7.03-6.64(m,3H),5.78(d,J=5.9 Hz,1H),5.57(dd,J=5.8,1.2 Hz,1H)。13CNMR(100 MHz,CDCl3)δ141.2,130.0,129.8,129.2,128.7,127.4,125.8,124.7,124.0,122.7,122.3,121.0,120.5,109.5,72.5,70.2,67.8。
1,2-Dihydro-1-phenyl-2-chloroform-quinoline(3p)。淡黄色油状物;1HNMR(400 MHz,DMSO-d6)δ7.37(d,J=17.5 Hz,4H),7.29(dd,J=7.7,1.6 Hz,1H),7.16(d,J=29.5 Hz,2H),7.10(d,J=9.6 Hz,1H),6.95(d,J=15.0 Hz,2H),6.18(dd,J=9.5,5.9 Hz,1H),5.25(dd,J=5.9,0.8 Hz,1H)。13CNMR(100 MHz,CDCl3)δ149.9,141.7,130.2,129.2 128.7,124.7,121.7,118.3,75.0。
1,2-Dihydro-1-phenyl-2-chloroform-isoquinoline(3q)。淡黄色油状物;1HNMR(400 MHz,CDCl3)δ7.52(d,J=8.8 Hz,1H),7.41(d,J=25.6 Hz,3H),7.29(d,J=26.3 Hz,4H),7.10(d,J=16.7 Hz,1H),6.83(dd,J=7.3,1.3 Hz,1H),6.17(d,J=7.4 Hz,1H),5.86(s,1H)。13CNMR(100 MHz,CDCl3)δ146.8,133.2,130.0,129.3,129.2,129.1,125.8,124.2,123.5,122.6,118.6,108.8,104.8,74.6。
2 结果与讨论
2.1 反应条件的优化
首先,以苯炔前体与喹啉在二氯甲烷中的插入反应为模型反应,进行一系列的条件优化。该反应中的溶剂又作为一种反应物参加反应,因此只需对氟源进行筛选即可。实验结果表明,当CsF与TMAF作为氟源时,该反应基本上不能进行;当TBAT和TBAF作为氟源时,该反应能很好的进行,产率分别达到75%和70%;当氟源是KF/18-C-6时,该反应产率达到86%;然后对氟源的量进行优化,发现减少或增加氟源的量,该反应的产率均有所下降(表1)。
综上所述,该反应的最优条件如下:以KF(2.0 equiv.)和 18-crown-6(2.0 equiv.)作为添加剂,喹啉(1.0 equiv.)和苯炔(1.5 equiv.)在二氯甲烷中,室温下反应12 h左右。

表1 反应条件优化aTab.1 optimization of reaction conditions
2.2 最优条件下的底物拓展
在最优反应条件下,进行了一系列底物的拓展研究。由表2可知:3位、4位及6位取代的喹啉衍生物,无论取代基是拉电子性还是供电子性,都具有较好的反应活性,产率在71%-86%之间;但当取代基在8位时,产率有所降低。上述结果表明,喹啉上取代基的电子效应对该反应的影响并不太明显,空间位阻效应可能存在一定的影响。当喹啉和3-OMe取代的苯炔和不对称萘炔参与反应时,分别获得73%和76%产率,反应产物具有很好的选择性,基本上只得到了一种构型的产物。随后,用一系列的异喹啉代替喹啉进行反应,产率在56%-73%之间。最后,将溶剂换为三氯甲烷时,喹啉、异喹啉和苯炔参与的三组分串联反应也能够发生,产率分别为69%和58%。
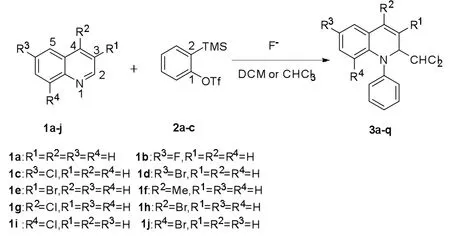
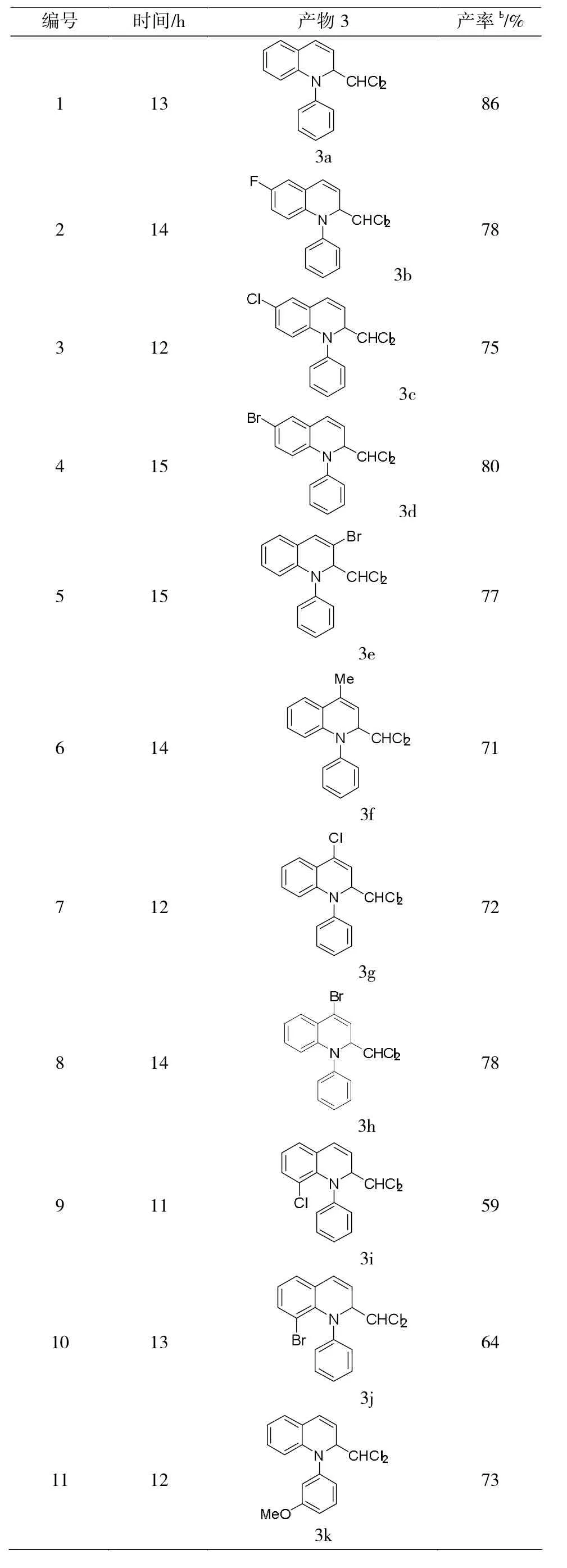
表2 底物普适性研究aTab.2 investigation of products
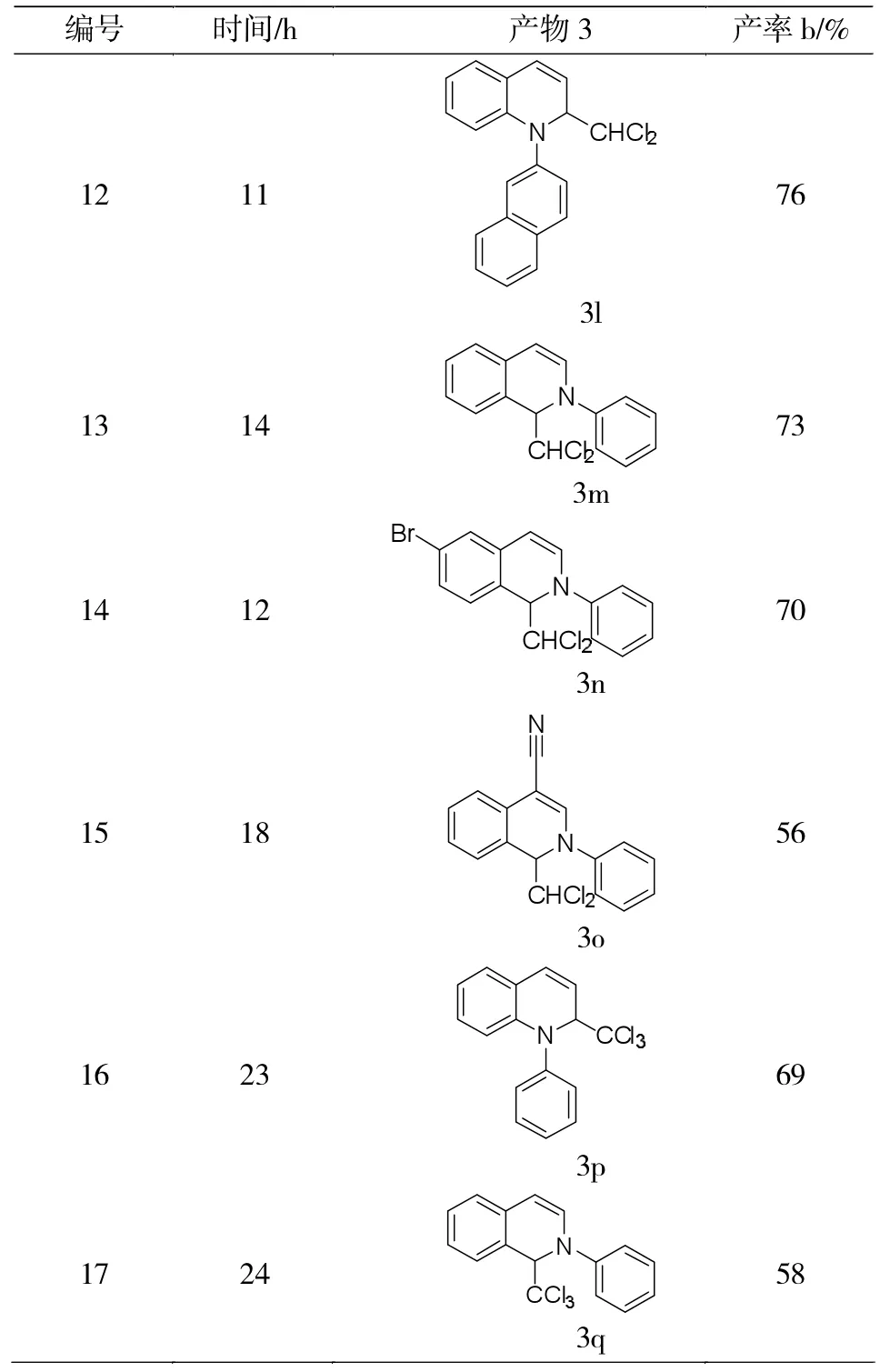
续表2
2.3 机理假设
在本研究结果的基础上,我们提出了一个可能的反应机理(图1)。首先是氟离子进攻苯炔前体原位生成苯炔,富电子的喹啉与缺电子的苯炔进行芳基化反应生成一个两性离子中间体I,然后该两性离子中间体经过质子转移和亲核加成反应生成目标产物。
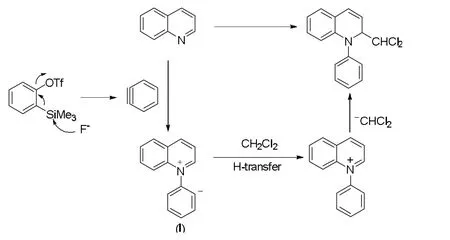
图1 可能的反应机理Fig.1 Possible mechanism of the reaction
3 结论
(1)通过实验研究,确定三组分串联反应的最优条件为:喹啉 1(1.0equiv.),苯炔前体 2(1.5equiv.),KF(2.0equiv.)和 18-crown-6(2.0equiv.),溶剂为 二氯甲烷(2 mL),反应在室温下进行,反应时间为12 h。该串联反应具有反应条件温和、副反应较少、底物适应性广等优点。
(2)在最优条件下,喹啉(或异喹啉)、苯炔与二氯甲烷(或三氯甲烷)经过三组分串联反应生成17种脱芳构氯化物,产率在56%-86%之间,反应物喹啉上取代基的电子效应对该反应没有太大的影响,但会受取代基空间位阻效应的影响。另外,该反应中的二氯甲烷(或三氯甲烷)既是溶剂,又作为反应的第三组分参与反应。
(3)通过分析提出了在氟离子作用下原位生成苯炔,然后通过质子转移和亲核加成生成一系列脱芳构氯化物的反应机理。
