上调蛋白磷酸酯酶2A水平可显著抑制宫颈癌细胞迁移*
2018-08-29申复进郑红云廖淑梅许学先
申复进 郑红云 廖淑梅 许学先
宫颈癌是最常见的妇科恶性肿瘤,全世界每年新发病例50万,中国每年新发病例超过10万,而且近年来宫颈癌的发病年龄趋向年轻化[1]。如何减少肿瘤的复发和转移,延长患者的生存期及提高其生活质量是临床需要解决的关键问题[2]。肿瘤细胞转移能力的高低与肿瘤细胞的运动性、粘连性和侵袭性以及新生血管的生成等诸多因素均密切相关,其中肿瘤细胞迁移和侵袭能力是肿瘤转移的关键[3]。
正常情况下,蛋白磷酸激酶和蛋白磷酸酯酶水平保持着动态平衡,维持细胞内信号正常转导,但这种平衡一旦被打破,如蛋白磷酸激酶活性异常增高或蛋白磷酸酯酶活性异常下降均可促进肿瘤细胞的迁移和侵袭[4]。蛋白磷酸酯酶2A(PP2A)是最重要的丝氨酸/苏氨酸蛋白磷酸酯酶,广泛参与调节细胞的生长、增殖、分化和迁移[5]。迄今已有研究表明PP2A与肺癌、结肠癌、乳腺癌、恶性黑色素瘤、前列腺癌、胰腺癌、肝癌等肿瘤密切相关[6]。以上研究提示PP2A可能在肿瘤的侵袭和转移中发挥重要作用。而PP2A参与妇科肿瘤转移的相关性研究却极少。本研究组前期研究结果表明宫颈癌患者血清和肿瘤组织中PP2A水平显著下调[7,8],本文在前期研究的基础上观察PP2A水平对Hela宫颈癌细胞迁移的作用,进一步为宫颈癌发展的分子机制及宫颈癌临床药物开发提供理论依据。
1 材料与方法
1.1 细胞、质粒、试剂和仪器
1.1.1Hela细胞来源及传代培养:Hela细胞系购自武汉大学细胞库。采用RPMI 1640细胞培养基[加入10%胎牛血清(FBS)和100单位的青链霉素],置于37℃,5% CO2培养箱进行培养。细胞2-3天换液一次,当细胞丰度达到80%左右时,弃旧的培养基,0.25%胰酶消化细胞5min,去掉胰酶,再加入新鲜的完全培养基,吸管吹打细胞,混匀,传代,取第二代细胞用于本文实验。
1.1.2质粒:野生型PP2AC (wtPP2A)和干扰PP2AC(siPP2A)质粒均由华中科技大学同济医学院神经系统重大疾病重点实验室提供[9]。
1.1.3试剂:进口胎牛血清(FBS)购自GIBCO公司;DMEM、OPTI-MEM与Lipofectamine2000均从Invitrogen公司购买;RPMI 1640 购自HyClone公司;青霉素和链霉素从TaKaRa Biotechllology公司购买;冈田酸(Okdaic Acid,OA,PP2A抑制剂)(CAS:78111-17-8,抑制剂量5-30nM/L),D-erythro-Sphingosine(DES,PP2A激动剂)(CAS:
123-78-4,最佳剂量10nM)购自CalBiochem公司。
1.1.4仪器:二氧化碳培养箱(HEAL FORCE,HF151UV,上海力康仪器有限公司)、倒置相差显微镜、普通倒置荧光显微镜、解剖镜(Olympus,日本)、双光子激光扫描共聚焦显微镜(LSM510 Carl Zeiss,德国)、高压蒸汽灭菌器(Hirayama,日本)、台式高速低温离心机(Sigma公司,美国)、恒温水浴箱(武汉科学仪器厂);恒温振荡培养摇床(武汉科学仪器厂)。
1.2 细胞培养和分组处理
将第二代状态良好的Hela细胞种植于细胞爬片中,待其生长为80%丰度时(约24h),用10μl的枪头在细胞爬片上平行划线(成井字型),造成细胞损伤裂痕模型,用过滤高压好的PBS洗一遍后更换新的条件培养基继续培养。药物干预实验分为3组,即对照组(常规方法培养,n=6)、DES组(细胞培养液中加入10nM PP2A激活剂DES,n=6)和OA组(细胞培养液中加入10nM PP2A抑制剂OA,n=6)。转染实验亦分为3组,分别为对照组(DsRed组,n=6)、wtPP2A组(n=6)和siPP2A组(n=6),每孔转染质粒0.8μg。质粒转染具体操作步骤为划痕处理前将50μl的 Opti-MEM 培养基中加入相应质粒DNA 0.8μg;另一50μl Opti-MEM 培养基中加入 2μl Lipofectamine 2000 转染试剂,超净台内静置 5min 后将两者混合混匀,超净台内室温孵育20—25min;将 100μl DNA与脂质体复合物直接加入培养孔,迅速置于37℃培养,6h后进行划痕实验。
1.3 剩余划痕宽度和细胞迁移率
药物处理组分别于划痕处理后0h、24h和48h固定细胞,质粒转染组分别于划痕处理后0h和48h于双光子激光共聚焦显微镜下观察并拍照。统计各组剩余划痕宽度,同时利用IPP软件计算划痕宽度比例(Wound Width%),Wound Width%=剩余划痕宽度/0h划痕宽度×100%,细胞迁移率=100%-Wound Width%。
1.4 统计学处理

2 结果
2.1 各药物处理组剩余划痕宽度及Hela细胞迁移率
药物处理结果发现,DES组无论是给药24h还是48h,Hela细胞迁移到划痕中央的能力均受到明显抑制,发生迁移的细胞较少;OA组给药24h时迁移的Hela细胞已占划痕区域的50%,到48h时迁移细胞已完全填充了整个划痕区域(图1)。统计学结果显示:对照组Hela细胞24h、48h的迁移比率分别为20%和65%,DES组Hela细胞24h、48h的迁移比率分别为11%和41%;而OA组Hela细胞的迁移率分别为63%和89%。见表1。

图1 各药物处理组Hela细胞迁移率(双光子激光共聚焦显微镜)

组别剩余划痕宽度(μm, x±s,n=6)0h24h48h组内F值迁移率(%)24h48h对照组245.40±5.05196.60±4.2786.40±5.342 750.7020%65%DES组246.50±5.02219.00±5.051)146.00±4.592)1 074.1011%41%OA组248.80±5.0189.30±4.112)3)26.30±3.802)3)10 037.30 63%89%组间F值1.902 374.501 677.60
注:与同组0h比较,1)P<0.05;2)P<0.01;与DES组相同时点比较,3)P<0.01
2.2 各基因转染组剩余划痕宽度及Hela细胞迁移率
wtPP2A组细胞迁移率受到抑制,而siPP2A组Hela细胞的迁移明显增强(图2)。统计学结果显示:48h时,wtPP2A组细胞的迁移比率为40%;而siPP2A组Hela细胞的迁移率为87%(表2、图2)。
3 讨论
全世界每年有25万患者死于宫颈浸润癌,大约有29%—38%的宫颈癌患者在治疗后复发。肿瘤的复发转移是导致临床宫颈癌患者死亡的主要原因。肿瘤转移是恶性肿瘤最重要的生物学特征,肿瘤细胞转移能力的高低与肿瘤细胞的运动性、粘连性和侵袭性以及新生血管的生成等诸多因素均密切相关。
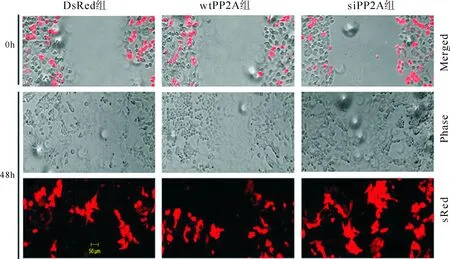
注:红色荧光蛋白表达的细胞为已成功导入质粒DNA的细胞
图2各基因转染组Hela细胞迁移率(双激光共聚焦显微镜)

表2 各基因转染组剩余划痕宽度及Hela细胞迁移率
注:与同组内转染0h比较,1)P<0.01;与wtPP2A组相同时点比较,2)P<0.01
PP2A是最重要的丝氨酸/苏氨酸蛋白磷酸酯酶,广泛参与调节细胞的生长、增殖、分化和迁移[5]。PP2A由结构亚单位A(65kD)、调节亚单位B(50-130kD)和催化亚单位C(36kD)构成的异三聚体[10],其中PP2AC亚基直接决定PP2A活性状态,C亚基表达水平越高,PP2A活性越好。本课题组前期研究表明PP2A通过调节MAPK信号通路,参与了神经胶质细胞的迁移活动[11]。在本课题组前期关于PP2A作用研究中均选择过表达或下调PP2AC亚基手段调节PP2A活性[9],本课题研究也以同样的思路,选择药物或转染的方式改变PP2A活性,观察PP2A活性变化对Hela宫颈癌细胞迁移的影响。
已有研究表明PP2A与肺癌、结肠癌、乳腺癌、恶性黑色索瘤、前列腺癌、胰腺癌、肝癌等肿瘤密切相关[11]。实验发现在小鼠的肺癌细胞(LLC)和人的鳞状细胞癌细胞(HNSCC)中,当用PP2A激活剂提高PP2A活性时,细胞穿越基底膜的能力下降,而用PP2A抑制剂抑制PP2A活性时,细胞穿越基底膜的能力增强[12]。以上研究提示PP2A可能在肿瘤的侵袭和转移中发挥重要作用。在一些肿瘤患者中,PP2A相关调节亚基活性显著下调,进一步研究证实通过抑制PP2A调节亚基活性可明显促进肿瘤细胞的迁移和侵袭。例如抑制PP2A可通过抑制Wnt/β-catenin 信号途径抑制胰腺癌细胞的生长和迁移[13],而激活PP2A则可通过调节金属蛋白酶2和9促进肝癌细胞的迁移和侵袭[14],这可能与PP2A在该肿瘤细胞中特异性激活Wnt信号途径,因激活途径不同导致结果也不同。同时亦有文献报道,EphB3通过PP2A/RACK1/Akt信号途径抑制非小细胞肺癌的迁移[15]。最新研究进展显示PP2A参与了多种肿瘤的转移过程,而PP2A参与妇科肿瘤转移的相关性研究极少。本课题组前期研究分别选取18例正常宫颈患者作为正常对照组,32例宫颈癌转移患者为患病组,采用ELISA试剂盒检测宫颈癌患者血清中PP2A表达水平,结果发现与对照组相比,患病组患者血清PP2A表达水平显著下调,约为对照组的70.5%;进一步对两组人群相应的宫颈组织分别提取组织RNA和蛋白质进行检测,发现宫颈癌转移患者组织中PP2A酶活性,PP2AC亚基基因和蛋白表达水平均显著降低,该研究结果提示PP2AC亚基可能在宫颈癌的转移过程中发挥重要作用[7,8]。
本研究结果表明,无论采用药物还是基因上调PP2A后均可明显抑制宫颈癌细胞的迁移,而抑制PP2A后则显著促进宫颈癌细胞的迁移。该研究结果提示:PP2A在宫颈癌的转移中起重要作用,该研究可为宫颈癌的发展提供新的分子机制,亦可为宫颈癌临床药物的开发提供新的靶点。
◀
