当归四逆汤对糖尿病血瘀症大鼠周围神经病变及水通道蛋白1、RhoA/ROCK信号通路的影响
2018-08-29向庆伟
向庆伟
糖尿病的发生发展是一个漫长的病理过程,血瘀症在糖尿病患者中普遍存在[1,2],研究发现,血瘀症在糖尿病并发症中约占16%[3]。血瘀症引起的微循环障碍、血黏度增高、循环灌注不足、微血栓形成等是引起周围神经病变的主要原因,可引起肢体疼痛麻木、胸痛头痛、半身不遂、舌质紫暗或有瘀斑瘀点等病理特征,且有权威研究证实血瘀症的血液高凝状态比非血瘀症者明显[4,5]。西医治疗的手段是胰岛素药物控制血糖与甲钴胺药物治疗[6]。祖国医学认为血瘀症病位在筋肉、肌肤与脉络,涉及肝、肾、脾等脏腑,以气血阴阳亏虚为本,痰瘀阻络为标,中医治疗以益气养阴、活血通络为主。水通道蛋白1(AQP1)是中医血瘀水停重要参考指标,其表达水平与组织血瘀水停关系紧密;RhoA/ROCK信号通路在体内普遍存在,参与调节体内多种细胞功能。相关研究表明[7,8],AQP1、RhoA/ROCK信号通路可能成为防治糖尿病血瘀症的药物新靶点。当归四逆汤具有回阳救逆之效,以及改善神经受损的作用。本研究旨在探究当归四逆汤是否可通过调节AQP1、RhoA/ROCK信号通路促进糖尿病血瘀症大鼠神经元恢复。
1 材料与方法
1.1 实验动物、药剂和仪器
1.1.1实验动物:健康成年雄性SD大鼠65只(6-8周龄,体重200-250g),购自北京华埠康生物技术有限公司[scxk(京)2016-0275]。在SPF系统内分笼饲养,12h循环光照,室温23±1℃、湿度50%-60%,自由摄食和饮水。饲养一周后进行实验。
1.1.2主要药物和试剂:当归四逆汤组成及剂量源于《伤寒论》:当归(批号14003095)12g、桂枝(批号14019611)9g、细辛(批号14015080)、赤芍(批号14016022)9g、通草(批号14013827)6g、灸甘草(批号14056230)6g、大枣8枚,中药饮片均来源于湖北中医院药房,由本院制剂中心煎制(将饮片置于冷水中浸泡30min,水提取3次,合并滤液,配制成含生药1mg/ml的药液,置于冰箱待用);甲钴胺片剂(卫材药业股份公司,批号20161123,使用时用蒸馏水溶解成所需浓度);STZ(链脲佐菌素,粉剂,Sigma-Aldrich,批号S0130,使用时溶于0.1mol/L、pH4.2的柠檬酸缓冲液);二水合柠檬酸钠,柠檬酸(北京中山金桥生物技术有限公司,批号20150625,20150628); AQP1抗体(Santa Cruz,批号sc-32738,使用时1∶500稀释); RhoA抗体(Abcam,批号ab54835,使用时1∶1 000稀释); ROCKI抗体(Abcam,批号ab45171,使用时1∶2 000稀释);ROCKII抗体(Abcam,批号ab66320,使用时1∶2 000稀释);β-actin抗体(Mouse 北京康贝源科技有限责任公司);二抗均为辣根过氧化物酶标记的兔抗鼠 IgG( Thermo Scientific,使用时1∶5 000稀释);强的松龙注射液(针剂,浙江仙居制药股份有限公司,批号1067227);肾上腺素注射液(针剂,北京市永康药业有限公司,批号05030141);普通鼠粮、高脂鼠粮(江苏省协同医药生物有限工程责任公司)。
1.1.3主要仪器:莱卡显微镜(型号DM1000,德国Leica);电生理记录仪(型号SLY-B,上海美普达仪器有限公司);蛋白检测仪(型号AZ1901,美国Bio-Rad);核酸检测系统(型号NSB98013,美国Thermo);Real-Time PCR 检测系统(型号CFX96)和数据处理软件(型号BD339,美国Bio-Rad);低温高速离心机(型号KL04A,湖南湘仪离心机仪器有限公司);Western blot全能转印系统(美国Bio-Rad);天平(型号FA2004B,上海平轩科学仪器有限公司);血糖仪(型号06583211001,爱尔兰Roche);血流变仪(型号0832014,德国HAAK);血脂检测仪(型号HF-800A,济南汉方医疗器械有限公司);电热鼓风干燥箱(型号101A,苏州凡贝节能电热烘箱有限公司);PVDF膜(0.22μm 北京索宝生物科技有限公司);发光成像仪(型号LAS 4000,德国Healthcare)。
1.2 复制DM血瘀症大鼠模型[9]及分组处理
1.2.1制模:留取12只SD大鼠作为正常对照组(A组)普通饲料喂养;另外53只给予高脂高糖饲料喂养60天,禁食12h后一次性腹腔注射STZ溶液(30mg/kg),72h后测定空腹血糖,其水平> 16.7mmol/L者为DM模型大鼠;继续高脂高糖饲养1周后,肌肉注射强的松龙1ml/次/天,连续13天,至第14天,一次性肌肉注射0.1%肾上腺素1ml,继续高脂高糖饲养2周后,观察大鼠出现食量、饮水量、尿量增多,体重严重下降,且皮毛无光、精神萎靡、舌面干燥少苔、空腹血糖依然高于16.7mmol/L,同时检测甘油三酯(TG)、胆固醇(TC)、低密度蛋白(LDL-C)和全血低切黏度、全血高切黏度、血浆黏度等均显著高于正常对照组,确认为DM血瘀症大鼠造模成功。本次共48只大鼠成模,另3只失败,2只死亡。
1.2.2分组及处理: 48只成模大鼠按照随机数字表法分为4组:DM血瘀症组(B组)、甲钴胺治疗组(C组)、当归四逆汤低剂量治疗组(D组)和高剂量治疗组(E组),每组12只。C组给予甲钴胺溶液灌胃(50μg/kg,1次/天)[10];D组、E组分别给予含生药1g和2g当归四逆汤灌胃,1次/天。三组每次灌胃量均为2ml;B组和A组给予等量生理盐水灌胃;均连续8周。
1.3 检测指标和方法
各组干预结束后,先行坐骨神经传导速度测定,之后断头处死大鼠,取坐骨神经和背根神经节,分别测定坐骨神经含水量、AQP1,RhoA、ROCKI/ROCKII mRNA和蛋白表达水平。
1.3.1坐骨神经传导速度(NCV)检测:各组大鼠腹腔注射硫喷妥钠麻醉后,将刺激电极置于左侧坐骨切迹,记录电极置于左踝部和左爪任意两趾间,连接电生理记录仪,记录神经干动作电位。计算NCV(m/s)=刺激电极和记录电极间距离(m)/动作电位潜伏期(s)。
1.3.2坐骨神经含水量测定:将所取大鼠单侧坐骨神经远端组织称取湿重后,置于58℃烘箱内72h称其干重。计算组织含水量[=(湿重-干重)/湿重×100%]。
1.3.3RT-PCR检测背根神经节各因子mRNA表达:取背根神经节用液氮研磨,采用Trizol法常规提取总RNA。按照HiFi-MMLV cDNA第一链合成试剂盒说明书进行反转录,引物2μl、RNA模板2μl、加RNase-Free water至15μl,65℃孵育5min后立刻冰浴,低温瞬时离心。继续向以上反应液中加入5×RT混合液4μl、HiFi-MMLV酶混合液1μl,37℃孵育40min,随后70℃保持15min终止反应。Bio-Rad CFX96实时PCR检测系统上进行RT-PCR,反应体系为25μl:正义和反义引物各1μl(各引物序列见表1),各基因模板2μl,SYBR Green PCR预混体系12.5μl(使用时注意避光),加无菌水至总体积为25μl。两步法PCR扩增程序为预变性95℃10min,随后变性95℃5s、退火/延伸30s,循环40次;AQP1、RhoA、ROCKI及ROCKII退火温度分别为60.0℃,62.0℃,57.0℃和55.0℃。每个样本设置3个复孔,以=2-△△Ct法计算各基因mRNA相对表达量。

表1 引物序列
1.3.4Western blot检测背根神经节各因子蛋白表达:取背根神经节组织,加入适量预冷的RIPA裂解液和PMSF(100∶1)裂解30min,4℃、10 000r/min离心10min,取上清使用BCA试剂盒测定蛋白质含量。SDS-page电泳及蛋白电转后,以5%脱脂奶粉溶液室温下封闭1h,Tris-HCl缓冲盐溶液(TBST)洗膜3次,每次5min;滴加相应的一抗37℃孵育1h,洗涤3次,滴加相应二抗37℃孵育1h,TBST洗涤3次后蒸馏水洗涤2min。以β-actin为内参,PVDF膜显影后使用ImageJ软件对条带灰度值进行定量分析,以目的蛋白与β-actin蛋白条带灰度比值表示该蛋白的相对表达量。
1.4 统计学处理

2 结果
2.1 模型大鼠体重、血糖、血脂、血流变等变化
DM血瘀症模型大鼠均出现“三多”症状,精神不振、皮毛无光泽、舌面干燥少苔,甚或瘀点瘀斑。同时体重明显降低,血糖、血脂、学流变指标水平明显高于对照组(P<0.01),见表2。
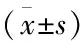
表2 DM血瘀症模型组与对照组大鼠体重、血糖、血脂及血流变指标水平比较
注:与对照组比较,1)P<0.01
2.2 各组大鼠坐骨神经传导速度和含水量比较
方差分析显示,各组大鼠传导速度组间差异不显著(P>0.05),各组大鼠坐骨神经含水量组间差异具有统计学意义(P<0.01)。B组含水量较A组显著增加(t=16.710,P<0.01),C组、D组、E组含水量均较B组显著减少(t=14.676、7.847、15.184,P<0.01),C组、E组含水量减少至与A组差异无统计学意义(t=2.034、1.526,均P>0.05)。见表3。
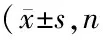
表3各组大鼠坐骨神经传导速度和含水量比较均=12)
注:与A组比较,1)P<0.01;与B组比较,2)P<0.01
2.3 各组大鼠背根神经节AQP1、RhoA、ROCKI和ROCKII mRNA表达比较
方差分析显示,各组大鼠背根神经节AQP1、RhoA 和ROCKII mRNA表达水平组间差异有统计学意义(均P<0.01),而各组ROCKI mRNA差异无统计学意义(P>0.05)。B组AQP1 mRNA表达量较A组显著增加(t=8.378,P<0.01),但RhoA 和ROCKII mRNA表达水平较A组显著降低(t=9.532、8.743,P<0.01)。C组AQP1、RhoA和ROCKII mRNA表达水平较B组明显下调或上调(t=6.998、8.095、7.528,均P<0.01),并接近于A组(t=0.170、0.171、0.409,均P>0.05)。D组AQP1 mRNA表达显著高于C组(t=5.760,P<0.01),RhoA和ROCKII mRNA表达显著低于C组(t=3.633、4.335,均P<0.01)。E组AQP1、RhoA和ROCKII mRNA表达与C组差异无统计学意义(t=0.055、0.411、1.318,均P>0.05)。见表4。
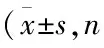
表4 各组大鼠AQP1、RhoA、ROCKI和 ROCKII mRNA表达比较均=12)
注:与A组比较,1)P<0.01;与B组比较,2)P<0.01,与C组比较,3)P<0.01
2.4 各组大鼠背根神经节AQP1、ROCKI、RhoA和 ROCKII蛋白表达比较
方差分析显示,各组大鼠背根神经节AQP1、RhoA 和ROCKII 蛋白表达水平组间比较差异有统计学意义(均P<0.01),而各组ROCKI蛋白表达差异无统计学意义(P>0.05)。B组AQP1蛋白表达较A组显著增加(t=7.009,P<0.01),而RhoA和ROCKII蛋白表达较A组显著降低(t=7.948,7.881 均P<0.01)。C组AQP1蛋白表达较B组明显降低(t=8.578,P<0.01),RhoA和ROCKII蛋白表达则较B组明显升高(t=7.760、9.996,P<0.01),且均接近A组(t=0.845、0.699、0.179,P>0.05);D组AQP1蛋白表达显著高于C组(t=9.071,P<0.01),RhoA蛋白表达显著低于C组(t=2.270,P<0.05),ROCKII蛋白表达与C组差异不明显(t=0.255,P>0.05)。E组AQP1蛋白表达低于D组(t=9.071,P<0.01),与C组相当(t=0.329,P>0.05),RhoA蛋白表达高于D组(t=2.434,P<0.05),ROCKII蛋白表达与D组接近(t=0.787,P>0.05);E组AQP1、RhoA和ROCKII蛋白表达与C组差异无统计学意义(t=0.329、0.699、1.857,P>0.05)。见图1、表5。

图1 各组大鼠背根神经节AQP1、RhoA、ROCKI和ROCKII蛋白电泳图(Western blot)
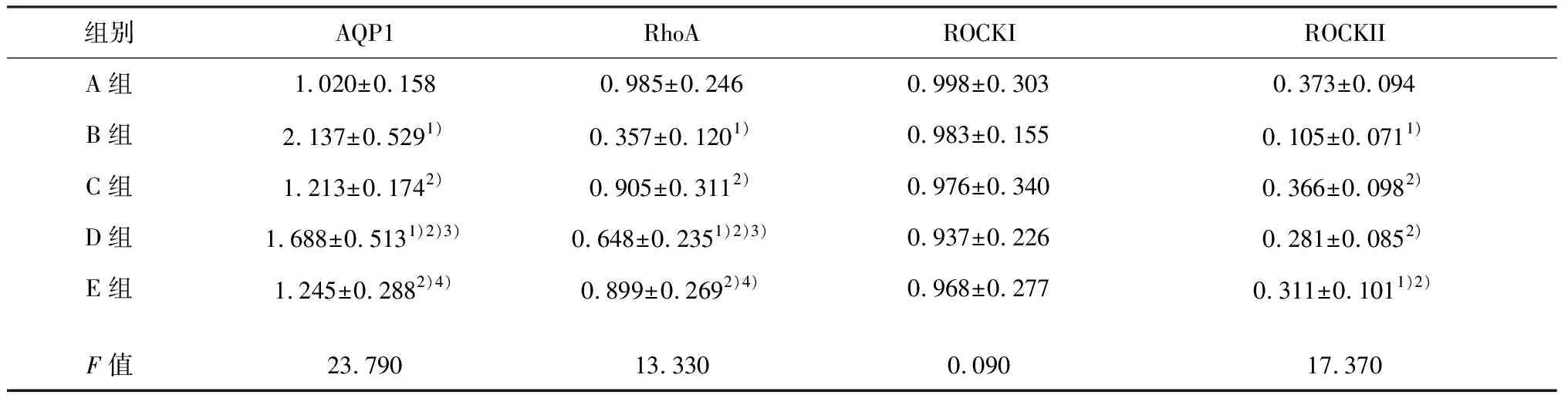
组别AQP1 RhoA ROCKI ROCKII A组1.020±0.1580.985±0.2460.998±0.3030.373±0.094B组2.137±0.5291)0.357±0.1201)0.983±0.1550.105±0.0711)C组1.213±0.1742)0.905±0.3112)0.976±0.3400.366±0.0982)D组1.688±0.5131)2)3)0.648±0.2351)2)3)0.937±0.2260.281±0.0852)E组1.245±0.2882)4)0.899±0.2692)4)0.968±0.2770.311±0.1011)2)F值23.79013.3300.09017.370
注:与A组比较,1)P<0.05;与B组比较,2)P<0.05;与C组比较,3)P<0.05;与D组比较,4)P<0.05
3 讨论
糖尿病神经病变最早出现在感觉神经纤维中,其神经变性和再生同时存在[11,12]。然而,周围神经再生在糖尿病神经病变进展中的作用及其机制尚不清楚。AQP1是中医血瘀水停重要参考指标,其表达量变化与组织血瘀水停关系紧密,与中医“活血利水”作用相关[13-15]。大量中医临床研究结果表明,当归四逆汤治疗糖尿病周围神经病变疗效明显[16,17]。
本研究发现糖尿病血瘀症模型大鼠神经传导速度显著减慢,且AQP1 mRNA及蛋白表达水平均显著增加,提示糖尿病周围神经病变的发生可能通过上调AQP1,大量水分子进入神经纤维,造成神经组织水肿,影响其代谢,最终导致其坏死;另外,本研究发现糖尿病血瘀症大鼠模型中RhoA、ROCKⅡ的mRNA及蛋白表达水平均明显下降,说明在疾病状态下,突触的延伸受到了抑制,从而造成疼痛,这与相关研究[18]结果一致,而ROCKⅠ的表达水平无明显变化,可能与ROCKⅠ并不在脑组织表达相关。RhoA/ROCK信号通路处于多种信号通路的上游,起分子开关作用,参与多种疾病的病理生理过程,如神经病变等[17]。RhoA是一种小分子G蛋白,ROCK为其下游激酶,是RhoA的效应因子。ROCK主要有ROCKⅠ和ROCKⅡ两种亚型,ROCKⅡ在脑组织高表达,而ROCKⅠ主要在肝、脾、肾等组织表达,糖尿病可导致RhoA和ROCK的表达增强[17]。
本研究发现给予当归四逆汤高剂量治疗的糖尿病大鼠,其神经水肿并未发现明显改变,AQP1表达也受到了较明显的抑制,并且与正常组和甲钴胺组相比较,RhoA/ROCK信号通路表现出明显的回调,侧面证明该药在保护糖尿病对周围神经损害中的作用。结合以往报道分析其原因,首先,当归四逆汤功能养血补血、温阳祛瘀;其次,AQP1的表达变化与组织血瘀水停关系密切。本实验发现:血瘀症可激活AQP1和RhoA/ROCK信号通路启动周围组织水液转运,出现坐骨神经水肿,反映了瘀血水停的分子基础;当归四逆汤可有效抑制AQP1的表达,同时能够调节RhoA/ROCK信号通路相关因子的表达,从而缓解血瘀症状。表明当归四逆汤缓解血瘀症符合中医“活血利水”的理论。甲钴胺是常用的治疗周围神经痛的药物[19,20],本研究给予甲钴胺治疗后,各因子表达均有明显改善,说明该药物的疗效明确,这一结果也与其它研究一致[21]。而当归四逆汤低剂量组这些指标与对照组和甲钴胺组在这些指标上均有差异,表明当归四逆汤存在一定的剂量效应关系。比较当归四逆汤高剂量与甲钴胺治疗糖尿病大鼠,两者疗效相当,说明在中医理论指导下的中药治疗法是一种安全有效的治疗方法,值得进一步研究推广。由于本实验未进行可能作用靶点的具体机制性研究,因此,这部分将是后续的工作要点。
综上所述,当归四逆汤能够治疗糖尿病周围神经系统损伤,同时抑制AQP1表达,减少神经水肿引起的缺氧性损伤,并调节RhoA/ROCK信号通路相关因子的表达,其具体的治疗作用可能与抑制水肿、增强突出延伸有关,为今后临床研究提供一定依据,也为糖尿病周围神经损伤的靶向治疗提供了新的研究方向。
◀