神经干细胞提取及培养方法的体会
2018-08-29吴增董贤慧李媛靳晓飞周晓红高维娟
吴增,董贤慧,李媛,靳晓飞,周晓红,高维娟△
神经干细胞(neural stem cells,NSCs)是神经系统的始祖细胞,具有自我更新与分化的能力,通过对称性分裂产生两个完全相同的NSCs,通过非对称性分裂分化为其他细胞(神经元、少突胶质细胞和星形胶质细胞)。NSCs作为一种特殊的干细胞,具有独特的生物学特性(分化性、迁移性、趋化性和低免疫原性),因此NSCs移植在治疗神经系统疾病中具有良好前景。开展NSCs移植的前提是获得活力和稳定性均较高的种子细胞,而NSCs较其他细胞更加脆弱,对外界环境的变化非常敏感,所以提取NSCs的技术操作应十分精细,并全面把控体外培养NSCs的影响因素。基于诸多研究者的培养经验,本课题组经过长期实践,筛选并建立了一套完善、实用、可靠的NSCs提取及体外培养方法,现报告如下。
1 主要材料和仪器
1.1 实验动物 健康清洁级SD孕鼠,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016−0011。
1.2 主要试剂和仪器 主要试剂:DMEM/F−12(1∶1)、B−27、Accutase酶均购于Gibco公司;碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)均购于PeproTect公司;胎牛血清购于浙江天杭生物科技有限公司;胰蛋白酶购于北京索莱宝科技有限公司。主要仪器:3111型二氧化碳培养箱购于Thermo公司;SW−CJ−2FDSW−CJ−2FD洁净工作台购于苏州安泰空气技术有限公司;IX73型生物显微镜购于OLYMPUS公司;H2050R型离心机购于长沙湘仪离心机仪器有限公司。
2 神经干细胞的提取
2.1 提取步骤 取孕14 d SD大鼠1只,麻醉后将其浸泡于75%乙醇中0.5 h(仅露出头部),然后用无菌器械取出子宫,将子宫置于75%乙醇中浸泡2 min。在洁净工作台内解剖子宫,将胎鼠置于预冷的D−Hank’s液中,迅速取出胎鼠双侧大脑皮质,置于含有D−Hank’s液的培养皿中,迅速用镊子仔细剥除脑膜,转移至含有培养基的培养皿中,眼科剪剪碎,用无菌吸管转移到离心管内,以10~12次/min的频率缓慢轻柔吹打含有脑组织的培养基(机械吹打法),吹打至无肉眼可见组织块,以1 000 r/min离心5 min,去上清,加入NSCs无血清培养基,轻柔吹打成细胞悬液,先后过200目和500目细胞筛,细胞计数后以1×106个/mL密度接种,置于37℃、5%CO2培养箱中培养,见图1。
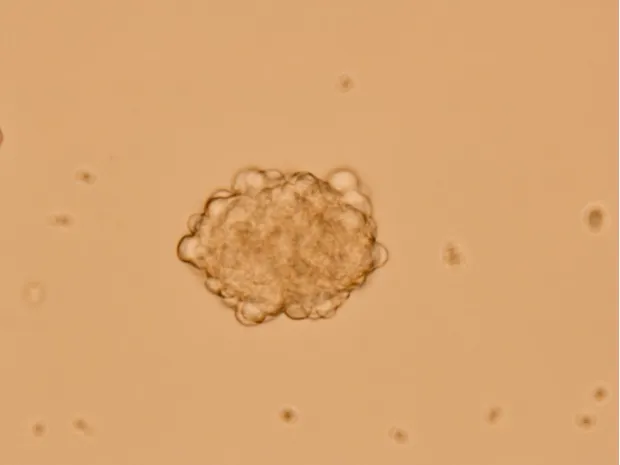
Fig.1 A good condition of the neurospheres(×400)图1 状态良好的神经球(×400)
2.2 提取要点
2.2.1 鼠龄的选择 大鼠的NSCs于胚胎第12天开始出现,第14~15天达到高峰[1−3]。
2.2.2 无菌操作 原代细胞提取过程中保持无菌原则至关重要,且NSCs较其他细胞更脆弱,因此更需注意无菌操作。主要环节:保持操作环境无菌,取材室和细胞室紫外线消毒20 min;操作人员严格消毒程序,换灭菌鞋、换无菌衣、戴口罩、戴帽子、洗手、穿无菌手术衣;通过乙醇浸泡和紫外线照射两种方法对实验动物进行彻底灭菌;对所有取材器械进行高压灭菌。
2.2.3 低温与营养支持 在提取过程中,应保持NSCs处于低温环境并给予营养支持。低温是活体组织和离体细胞长期保存的一种有效方法,主要通过降低细胞代谢率来起到保护作用。实验操作全程在冰板上进行,D−Hank’s液预冷,使脑组织处于低温环境中,可以最大限度提高细胞的存活率。为保证细胞的存活率,在D−Hank’s液中剥除脑膜后应立即将脑组织转移至培养基中,接种前便给予营养支持。
2.2.4 细胞分离方法 原代细胞分离常采用机械吹打和胰酶消化两种方法。机械吹打法即提取步骤中所提及的方法。胰酶消化法:用无菌吸管将剪碎的大脑皮质转移到离心管内,静置2 min,去上清,加入1 mL 0.125%胰酶,消化10 min,加入培养基终止消化,以1 000 r/min离心5 min,去上清,加入培养基,轻柔吹打成细胞悬液,过细胞筛,细胞计数后接种。胰酶消化的时间很难控制,如果消化时间过长会导致消化后活细胞比例较低;胎鼠脑组织中细胞外基质和结缔组织均较少,细胞间连接不紧密,取得大脑皮质后,用眼科剪剪碎,直接轻柔吹打即可,最后将细胞悬液用细胞筛过滤,可以得到高存活率的单细胞悬液。
2.2.5 细胞过筛 目的是最大限度将脑组织分离为单细胞,并去除未剥离干净的脑膜。许多研究者在实验中采用100目细胞筛(孔径150 μm)[4]、200目细胞筛(孔径75 μm)[5−6]、400目细胞筛(孔径38 μm)[7]等不同孔径的筛网。本课题组采用以上3个规格的细胞筛过滤后,在细胞培养过程中均发现培养基中有少量脑膜存在。NSCs的形态近似于圆形,直径在5~10 μm,因此课题组先后采用200目和500目细胞筛(孔径30 μm)过滤,过滤后的细胞悬液镜下观察未发现残存的脑膜,而且可以将绝大部分脑组织分离成单细胞。此外,少量脑膜的存在对于NSCs成球率和未分化状态的稳定性无影响。
3 培养基选择的依据
血清含有丰富的营养物质,对促进细胞生长有积极作用。但有研究表明含血清培养基可以诱导NSCs分化,不利于维持NSCs处于未分化状态[8],因此课题组采用无血清培养基培养NSCs。大部分研究者采用由DMEM/F12(98%)+B27(2%)+bFGF(20 μg/L)+EGF(20 μg/L)配置而成的培养基。DMEM/F12培养基是NSCs体外培养常用的基础培养基[9]。有研究指出B27能促进原代NSCs的增殖[10]。值得注意的是,Gibco公司生产的B27有多种类型,其中不含维生素A的B27不会诱导NSCs向神经元方向分化,有利于保持NSCs处于未分化状态。bFGF可以促进NSCs的增殖[11]。EGF既可以促进NSCs的增殖,又可以促进其向神经元和神经胶质细胞分化。bFGF与EGF联合应用可以促进NSCs体外增殖,抑制其分化[12]。本课题组采用由DMEM/F12(97%)+B27(2%)+青链霉素(1%)+bFGF(20 μg/L)+EGF(20 μg/L)配置而成的NSCs无血清培养基,培养出了状态良好的神经球。需要注意的是,为保持bFGF和EGF的最大活性,每次应少量配制培养基。
4 接种密度的选择
NSCs的生长密度对于其自身的增殖有重要的影响[13]。如果细胞密度过高,细胞则会聚集成团,导致营养供应不足,活性降低,甚至会出现大量死亡的状况。如果细胞密度过低,细胞之间缺乏有效的连接,造成增殖速度减慢。因此掌握好NSCs的接种密度对于其生长十分关键。文献中提及NSCs的接种密度从 1×105~1×107个/mL不等[14−16]。课题组按照1×105、1×106和1×107个/mL 3个密度进行接种,结果显示1×106个/mL的NSCs成球速度快,神经球数量多且状态良好。
5 不同培养方法对神经干细胞的影响
目前NSCs的培养方法主要有悬浮培养法和贴壁培养法。本课题组证实采用悬浮培养法可以形成稳定的神经球,有利于保持NSCs处于未分化的状态,而采用贴壁培养法培养的细胞则非常容易分化。需要注意的是,在悬浮培养NSCs的过程中,拿、放培养瓶要尽量平稳,以免造成细胞球聚集形成较大的细胞团块。
6 不同换液方式的体会
纵观研究人员对NSCs的换液方法,有全量换液和半量换液,其中多数采用半量换液的方法。NSCs本身就是未充分发育的细胞,所以较其他细胞而言更加脆弱,对外界环境的变化更加敏感,因此维持NSCs生长环境的相对稳定十分重要,频繁换液对细胞生长不利。NSCs生长不只是吸收培养基中的营养成分,还与NSCs自身分泌的活性物质(如生长因子、黏附分子和趋化因子等)有关,NSCs通过自分泌或旁分泌的方式调节自身的生物学特性,因此不推荐使用全量换液的方法。而只加液不弃液的方法较半量换液更方便,因此推荐使用每2~3 d只加液不弃液(25 cm2培养瓶每次添加培养基1~1.5 mL)的方法。
7 传代经验总结
7.1 传代时机 悬浮培养的神经球状态是判断传代时机的重要依据。据观察,活力好的神经球通常透光均匀且边缘明亮锐利。神经球的直径不宜过大,直径超过300 μm的神经球球心部较边缘厚很多,透光性减弱,球心部颜色较边缘暗。本课题组将NSCs培养至6~8 d,得到的神经球数量多、状态良好,适宜传代。
7.2 传代方法 NSCs传代方法主要有胰酶消化法、Accutase酶消化法[17]和机械吹打法等。酶消化法操作步骤:将含有NSCs的培养基转移至离心管,静置15 min,去上清,加入1 mL 0.125%的胰酶或1 mL Accutase酶,消化10 min,加入培养基终止消化,以1 500 r/min离心10 min,去上清,加入培养基,调整细胞密度为1×106个/mL,接种于培养瓶。机械吹打法操作步骤:将培养基转移至离心管,静置15 min,去上清,加入培养基,轻柔缓慢吹打10 min,调整细胞密度为1×106个/mL,接种于培养瓶。原代和1代的神经球细胞间连接不紧密,仅通过轻柔的吹打即可分离成单细胞悬液,且传代后活细胞比例最高,成球率最高,神经球可以保持稳定的未分化状态,吹打时要轻柔且避免产生气泡。2代及以后神经球通过单纯机械吹打无法使其完全分离为单细胞。采用胰酶消化法不容易掌握消化时间,对细胞损伤较大,活细胞比例相对较低,再次成球率低。损伤的细胞释放其核内DNA,这些DNA具有很强的黏性,会将分离消化的单细胞黏附在一起。本课题组对原代和1代的神经球采用机械吹打法进行传代,对2代及以后的神经球采用Accutase酶进行传代。利用Accutase酶消化2代及以后的神经球对细胞损伤最小,活细胞比例较高,成球率较高,神经球状态良好。
细胞培养过程中会出现死细胞、细胞碎片及细胞分解产物,如果不能及时清理这些物质则会影响NSCs的增殖。在传代过程中,使神经球自然沉淀,然后去除上清液,这些物质可以被最大程度地去除。原代培养的NSCs中混有一些杂细胞,经过反复传代培养后也可以被去除。
本课题组已经稳定传代培养NSCs至第7代。马浚宁等[18]发现从皮质提取的NSCs在传至9~11代后会出现神经球贴壁的现象,海马和嗅球区的NSCs也有类似现象,提示NSCs的悬浮特性会随着传代次数的增加而减弱。
8 神经干细胞标志物的选择
目前已经发现的NSCs标志物有巢蛋白、Musashi、神经元特异性烯醇化酶、波形蛋白1、细胞黏附分子等。大部分研究者把巢蛋白作为鉴定NSCs的标志物,巢蛋白又称为nestin,属于Ⅵ型中间丝蛋白,其表达具有时序性,nestin在分裂增殖能力旺盛的NSCs中高表达,在NSCs向终末细胞(神经元、少突胶质细胞和星形胶质细胞)分化过程中逐渐减弱,已经广泛应用于体外培养的NSCs的鉴定[19]。
9 总结
提取胎龄14 d胎鼠的大脑皮质,采用无血清培养基,以1×106个/mL的密度接种于25 cm2培养瓶(接种约3.5 mL),采取悬浮培养法,每2~3 d加液1~1.5 mL,每6~8 d传代1次,所得到的NSCs增殖分裂旺盛、成球率高、神经球状态良好,并且可以保持稳定的未分化状态。该方法值得参考。
