主动应用吗啡治疗特发性肺间质纤维化的对照研究
2018-08-29宋忠花张金庆舒树苗高炜
宋忠花,张金庆,舒树苗,高炜
特发性肺间质纤维化(IPF)预后较差,在间质性肺疾病(ILDs)中生存率最低[1],且其最为突出的症状为呼吸困难,严重影响患者的生活质量和预期寿命。针对呼吸困难的最根本处理措施为病因治疗,也即针对患者的原发病进行治疗[2]。目前,针对IPF尚无肯定疗效的治疗药物,新版IPF治疗指南[3]也仅对部分药物做了“有条件推荐”,肺移植是唯一能改善IPF患者生活质量并延长生存期的方法。国外指南中已有推荐应用吗啡治疗慢性阻塞性肺疾病(COPD)相关的呼吸困难[4],但用于IPF的治疗研究相对较少。目前,国内大多用吗啡来缓解晚期肿瘤及急性心力衰竭相关的呼吸困难,本研究旨在探讨主动应用吗啡治疗IPF相关呼吸困难的临床疗效及安全性。
1 对象与方法
1.1 研究对象 选择2016年2月—2017年6月于山东省立第三医院接受治疗的33例IPF住院患者作为研究对象,均符合《2011年特发性肺纤维化诊断和治疗循证指南》要求,并因明显的呼吸困难加重就诊入院。所有患者本人或委托代理家属均明确拒绝行肺移植、有创机械通气治疗,且治疗依从性好。患者依入院先后顺序被分为观察组16例,男9例,女7例,平均年龄(70.0±9.38)岁;对照组17例,男10例,女7例,平均年龄(75.1±9.80)岁。2组性别、年龄、胸部高分辨率CT(HRCT)所见间质病变范围及程度(即双肺基底部网格状影基础上是否伴有明显蜂窝肺改变)、入院时血氧饱和度(SpO2)、B型脑钠肽(BNP)、D−二聚体及降钙素原(PCT)水平差异无统计学意义,见表1。
排除标准:(1)器质性心脏病、严重心脏功能不全、恶性心律失常者。(2)存在职业性粉尘接触、气胸、肺栓塞、肺结核、恶性肿瘤、睡眠呼吸暂停及低通气综合征、肝肾功能不全、肠梗阻、前列腺肥大或增生、血液系统疾病、风湿免疫性疾病及内分泌系统疾病患者。(3)肺功能显示重度混合性通气功能障碍、血气分析提示高碳酸性呼吸衰竭者。(4)合并中枢神经系统疾病、神经肌肉接头疾病及潜在呼吸抑制风险等患者。(5)不能配合试验或治疗依从性差者。(6)曾应用过阿片类药物或有药物滥用史者。(7)对吗啡等阿片类药物过敏或不耐受者。(8)既往有明确焦虑、抑郁或精神病史。本研究已通过本院医学伦理委员会批准,并经患者所授权委托的家属签署知情同意书(鉴于可能受患者主观因素影响,并未告知患者本人)。
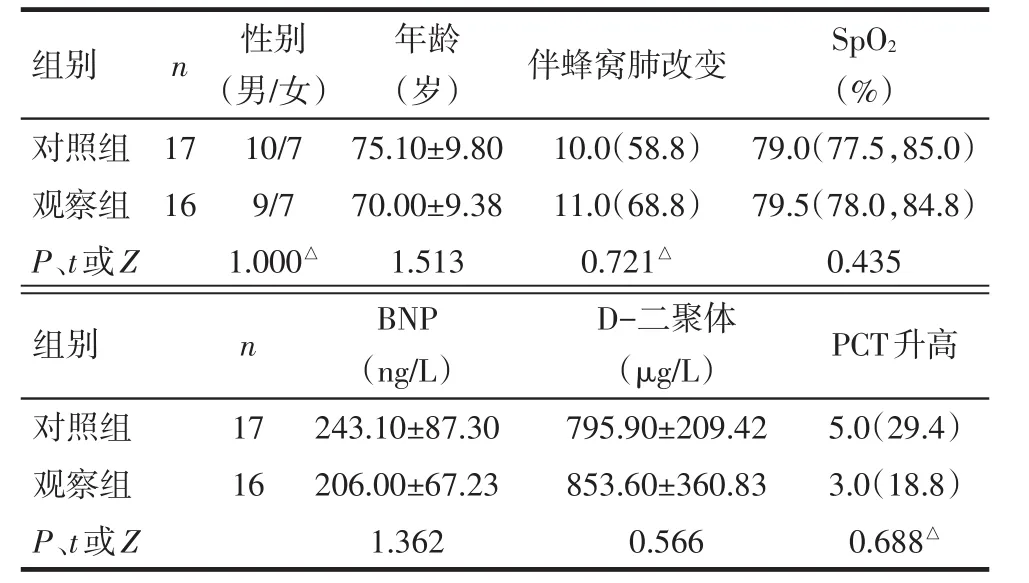
Tab.1 Comparison of basic data between two groups表1 2组患者一般资料比较
1.2 治疗方法 对照组:依据特发性肺间质纤维化的诊治方案[3,5−6]给予内科综合治疗,并进行个体化心理指导。观察组:在对照组治疗原则相同的基础上,住院期间全程给予低剂量吗啡1 mg皮下注射,每日3次(注射后1 h内医护人员均在可视范围内密切观察患者病情变化,同时备好相应抢救措施)。
1.3 观察指标 (1)采用视觉模拟量表(visual analog scale,VAS)记录呼吸困难程度[7]:0分代表无呼吸困难,100分代表极度呼吸困难。充分向患者及陪护家属说明VAS具体应用方法,分别在入院时、入院后第4天(即治疗72 h后)、出院前2 d及出院时,由主管医师上午查房时,请患者根据自我感觉对呼吸困难程度进行评分。(2)住院时间。(3)住院期间呼吸困难加重次数和糖皮质激素累计处方剂量。(4)不良反应发生情况(呼吸抑制、便秘、恶心)。
1.4 统计学方法 采用SPSS 19.0软件进行统计分析。符合正态分布的计量资料以均数±标准差()表示,2组间比较用t检验,重复测量资料用重复测量资料的方差分析;偏态分布的计量资料以M(P25,P75)表示,计数资料以例(%)表示,组间比较采用Fisher确切概率法或秩和检验,检验水准α=0.05。
2 结果
2.1 2组各时点VAS评分比较 2组治疗方案与时间因素均有统计学意义,且2因素存在交互作用(P<0.05);2组入院时VAS评分差异无统计学意义,观察组入院后各时点VAS评分均较对照组降低(P<0.05),见表2。
Tab.2 Comparison of VAS scores at different time points of admission and after treatment between two groups表2 2组患者入院时及治疗后不同时间VAS评分比较(分±s)

Tab.2 Comparison of VAS scores at different time points of admission and after treatment between two groups表2 2组患者入院时及治疗后不同时间VAS评分比较(分±s)
*P<0.05;F组间=6.996,F时间=495.794,F交互=3.991,均P<0.05
组别对照组观察组t n 17 16入院时87.60±7.10 88.60±9.50 0.335入院第4 d 79.90±7.67 74.50±6.83 2.123*出院前2 d 64.80±7.00 57.50±6.13 3.188*出院时44.10±5.82 37.30±9.12 2.596*
2.2 2组患者住院时间、住院期间呼吸困难加重次数和糖皮质激素累计处方剂量比较 2组平均住院时间差异无统计学意义。观察组住院期间出现呼吸困难加重次数、糖皮质激素累计处方剂量均较对照组减少(P<0.05),见表3。

Tab.3 The comparison of the times of dyspnea and the cumulative prescription dose of glucocorticoid between the two groups of patients during hospitalization表3 2组患者住院期间呼吸困难加重次数和糖皮质激素累计处方剂量比较
2.3 2组患者住院期间不良反应发生情况 2组患者均未出现呼吸抑制相关不良反应。观察组便秘比例大于对照组,恶心比例小于对照组(P<0.05),见表4。
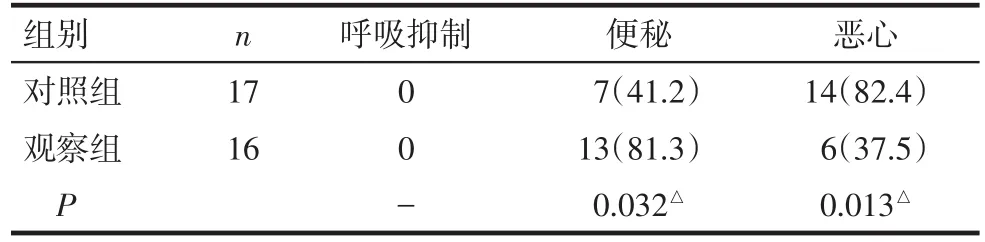
Tab.4 Comparison of adverse reactions between the two groups of patients during hospitalization表4 2组患者住院期间不良反应情况比较 例(%)
3 讨论
呼吸困难是导致呼吸系统疾病患者住院和潜在致残的主要原因,但针对其原发疾病的治疗往往不够充分[8]。IPF随病程延长所呈现出的顽固性或难治性呼吸困难,目前尚无特效治疗方法[9]。研究显示,约1/4的心力衰竭或呼吸系统疾病(包括IPF)患者在出院时仍伴有严重的呼吸困难和较低的生活质量[10]。因此,探讨缓解IPF尤其是终末期患者的呼吸困难尤为必要。
以吗啡为代表的阿片类药物能够有效减轻包括ILDs在内的多种原因所致的呼吸困难,短期治疗效果肯定[9]。已有多个国家推荐阿片类药物为治疗慢性呼吸困难和难治性呼吸困难的首选药物,且多认为规律性低剂量应用总体是安全的。阿片类药物缓解呼吸困难的可能机制包括降低机体对呼吸困难的感知、减轻机体耗氧量、缓解支气管痉挛及黏液高分泌和减轻焦虑等[4,11−12]。Kohberg等[13]认为,现阶段阿片类药物治疗IPF相关呼吸困难的数据仍十分有限,其治疗可以借鉴COPD相关呼吸困难的研究成果。目前,国内阿片类药物应用主要针对终末期肿瘤患者,治疗IPF相关呼吸困难的研究亦较少[14]。毛玉巧等[7]研究显示,COPD患者初始VAS评分越高,糖皮质激素治疗疗程越长,且随VAS评分的增加需要糖皮质激素干预治疗的概率也明显增加,提示激素对呼吸困难程度治疗干预的必要性。本研究针对IPF相关呼吸困难主动给予低剂量吗啡皮下注射治疗,结果显示入院第4天、出院前2 d及出院时VAS评分均较对照组降低,且三个时间节点间VAS评分比较同样显示出统计学差异,表明低剂量吗啡可缓解IPF患者的呼吸困难,并随治疗时间的延长,呼吸困难呈现逐渐减轻的趋势,提示临床疗效较稳定;同时,观察组患者在住院期间发生急性呼吸困难的次数减少,累计应用糖皮质激素剂量显著降低,亦与文献报道[7]的研究结果一致,表明主动给予低剂量吗啡治疗可减少IPF患者因呼吸困难而进行的糖皮质激素干预,笔者推测上述结果除与吗啡本身的药理作用直接相关外,可能还与改善患者焦虑−呼吸困难−焦虑恶性循环有关。
在难治性呼吸困难的治疗中,出于对呼吸抑制等药物不良反应的恐惧,包括胸科专业在内的临床医师处方阿片类药物仍显得十分谨慎[15]。但亦有研究表明,阿片类药物用于治疗呼吸困难的实际剂量尚不足以引起临床可见的呼吸抑制现象的发生[16]。本研究显示,观察组与对照组均未出现临床可观测到的呼吸抑制现象,观察组患者出现便秘症状明显多于对照组,与Rocker等[17]报道基本一致。恶心症状同样为吗啡应用过程中常见的不良反应,值得注意的是,对照组恶心症状反而多于观察组,结合临床工作实践,笔者推测可能与糖皮质激素高剂量应用相关的不良反应有关,例如低钾血症等。相关研究显示,由于吗啡治疗后呼吸困难得到了缓解,便秘和恶心症状在一定程度内是可耐受的[18]。
综上所述,主动应用吗啡治疗有助于缓解IPF相关呼吸困难,且安全有效,在取得患者或家属信任及理解的前提下,可在临床实践中尝试应用。但本试验仍存在一定程度的设计欠缺、样本量较小等局限性,有待进一步研究。
