IL-6和AG490对移植裸鼠的弥漫大B细胞淋巴瘤和伯基特淋巴瘤生长的影响*
2018-08-27庹樱篮王玲玲冯江龙李品浩杨文秀
庹樱篮, 王玲玲, 冯江龙, 李品浩, 杨文秀
(贵州医科大学病理学教研室, 贵州医科大学附属医院病理科, 贵州 贵阳 550004)
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)和伯基特淋巴瘤(Burkitt lymphoma,BL)是常见的、侵袭性非霍奇金淋巴瘤,它们在病因学、形态学、免疫表型、遗传学和临床表现等方面都具有明显的异质性。信号转导和转录激活因子(singnal transcducers and activators of transcription,STAT)在肿瘤细胞中异常的持续活化,尤其是STAT3与肿瘤的生物学行为及其发生机制密切相关[1]。有关淋巴瘤中存在STAT3通路异常活化的体外研究较多,也取得了一些研究成果,但对淋巴瘤动物体内研究的报道甚少。本研究利用STAT3通路激动剂白细胞介素6(interleukin-6,IL-6)及抑制剂AG490对DLBCL细胞株OCI-LY8和BL细胞株Raji荷瘤鼠进行体内实验性研究,以探讨STAT3信号通路对DLBCL和BL生长的影响。
材 料 和 方 法
1 动物
SPF级BALB/c裸鼠30只,雌性,4~6周龄,体重16~20 g,购于北京华阜康生物科技股份有限公司,动物质量合格证编号为SCXK(京)2014-0004。饲养于贵州医科大学动物实验中心,实验动物饲养设施合格证号为SCXK(黔)2012-0001。弥漫大B细胞淋巴瘤OCI-LY8细胞株购于University Health Network;伯基特淋巴瘤Raji细胞株购于中国科学院上海细胞库。
2 主要试剂
AG490(上海碧云天生物技术有限公司);IL-6(PeproTech);兔抗人p-STAT3 (Tyr705) 单克隆抗体和兔抗人survivin单克隆抗体(CST);兔抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)多克隆抗体(Abcam);RIPA裂解液和PMSF(上海碧云天生物技术有限公司);逆转录试剂盒和FastStart Universal SYBR Green Master (ROX)购自Roche。
3 主要方法
3.1细胞培养 复苏冻存于液氮罐中的弥漫大B细胞淋巴瘤细胞株OCI-LY8和伯基特淋巴瘤细胞株Raji,分别于20%胎牛血清+80% IMDM培养基+1%青、链霉素混合培养液和10%胎牛血清+90% RPMI-1640培养基+1%青、链霉素混合培养液在37 ℃、5% CO2的温箱中培养。
3.2裸鼠移植弥漫性大B细胞淋巴瘤和伯基特淋巴瘤模型的建立 BALB/c裸鼠饲养(SPF级),适应性喂养5~7 d后,通过腹腔注射环磷酰胺注射液(75 mg/kg)进行预处理(连续2 d,停药3 d),取对数生长期的OCI-LY8细胞和Raji细胞以密度2×1010/L、无菌条件下于裸鼠右前肢近腋窝处皮下接种,每只0.2 mL。
3.3实验分组及用药 根据细胞株类型,分为OCI-LY8和Raji细胞2组,每组15只裸鼠。分别接种细胞成瘤后随机分为对照(生理盐水,control)组、IL-6 (0.1 mg/kg)组和AG490 (8 mg/kg)组3个小组,注射体积均为每只0.2 mL,隔日1次,共5次。
3.4用药后的观察及测量 每日观察裸鼠的饮食和活动等情况,于用药第1、3、5、7、9和10天记录裸鼠体重及移植瘤体积(瘤体积=a×b2/2,其中a为肿瘤长径,b为肿瘤短径)的变化,并绘制移植瘤生长曲线图,并在干预周期结束后第2天脱颈椎处死动物,将肿瘤组织液氮速冻后于-80 ℃保存。
3.5p-STAT3、survivin和VEGF蛋白水平的免疫组织化学和Western blot检测 采用免疫组化PV两步法检测p-STAT3、survivin和VEGF的蛋白表达。操作按试剂盒说明书进行,用PBS代替 I 抗作为阴性对照,I 抗工作浓度分别为p-STAT3(1 ∶200)、survivin(1∶300)和VEGF(1∶100)。同时采用Western blot检测p-STAT3、survivin和VEGF的表达,将瘤组织加液氮进行研磨至碎后提取细胞总蛋白,定量煮沸后经10% SDS-PAGE,将蛋白转移至PVDF膜上,加入血清封闭液室温封闭1 h,加入兔抗人p-STAT3单克隆抗体(1∶1 800)、兔抗人survivin单克隆抗体(1∶2 000)、兔抗人VEGF 多克隆抗体(1∶1 000)和鼠抗人β-actin抗体(1∶1 000),4 ℃孵育过夜,再加入辣根酶标记山羊抗兔IgG(1∶3 000)37 ℃孵育1 h,再经化学发光剂反应,X线片压片曝光。将曝光后的条带扫描并用ImageJ分析数据。以β-actin蛋白条带作为内参照,最后数据以蛋白质表达的相对水平比予以表示。
3.6Real-time PCR检测suvivin和VEGF的mRNA表达水平 将肿瘤组织用TRIzol、氯仿和异丙醇等进行总RNA提取,测定浓度和定量后立即逆转录成cDNA。引物由上海生工生物工程公司合成,survivin的上游引物为5’-GCCAGATTTGAATCGCGGGA-3’,下游引物为5’-GCAGTGGATGAAGCCAGCCT-3’;VEGF 的上游引物为5’-CTGTCTTGGGTGCATTGGA-3’,下游引物为5’-ATTGGATGGCAGTAGCTGC-3’;β-actin的上游引物为5 ’-CACCAACTGGGACGACAT-3’,下游引物为5’-ATCTGGGTCATCTTCTCGC-3’。荧光定量PCR扩增反应采用20 μL体系,反应条件为:95 ℃ 30 s、95 ℃ 5 s、60 ℃ 34 s,扩增40个循环。PCR扩增产物计算RNA的相对量用2-ΔΔCt法计算。
4 统计学处理
应用SPSS 19.0软件进行统计分析,计量资料采用均数±标准差(mean±SD)表示,两组裸鼠成瘤率之间的比较采用Fisher确切概率法,多样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
结 果
1 成瘤率
裸鼠总成瘤率为83.3%(25/30),OCI-LY8细胞株成瘤率为66.7%(10/15),明显低于Raji细胞株(100%,15/15)(P<0.05)。
2 IL-6和AG490对裸鼠皮下移植DLBCL和BL生长的影响
荷瘤鼠体重及移植瘤生长情况的统计结果显示,DLBCL和BL荷瘤鼠的IL-6组中第9和10天裸鼠体重较相应对照组增高(P<0.05);2种移植瘤在第10天与第1天瘤体积的差值上与对照组的之间差异有统计学意义(P<0.05);此外,BL荷瘤鼠第7天瘤体积与第5天瘤体积差值有增大趋势,但无统计学差异。AG490组中裸鼠体重及瘤体积与对照组之间的差异均无统计学显著性,见图1、2和表1、2。

Figure 1. Growth curves of DLBCL xenografts in the nude mice. Mean±SD.n=3.*P<0.05vscontrol group.

Figure 2. Growth curves of Burkitt lymphoma xenografts in the nude mice. Mean±SD.n=3.*P<0.05vscontrol group.
3 肿瘤组织的病理学检查
大体观察可见肿瘤呈结节状,无包膜,边界清楚无黏连,肿块可活动;切面灰红或灰白色实性质软,呈鱼肉状,出血坏死较少,见图3。

表1 药物对OCI-LY8细胞株荷瘤鼠体重的影响
*P<0.05vscontrol group.

表2 药物对Raji细胞株荷瘤鼠体重的影响
*P<0.05vscontrol group.
弥漫大B细胞淋巴瘤移植瘤组织学特点为一致的中心母细胞样肿瘤细胞弥漫分布,细胞圆,体积较大,细胞核可呈圆形或椭圆型,染色质呈泡状,核膜厚,可见2~3个小核仁贴于核膜,细胞浆嗜双色性或嗜碱;伯基特淋巴瘤移植瘤镜下特点为肿瘤细胞中等大小,形态单一,弥漫分布,其间见星空现象,核圆,染色质粗,胞质深嗜碱性,见图4。
4 p-STAT3、survivin及VEGF 蛋白和mRNA水平的变化
免疫组织化学染色结果显示,p-STAT3阳性信号定位于细胞核,细胞核中见棕黄色颗粒;survivin和VEGF阳性信号定位于细胞浆,以细胞浆见棕黄色颗粒为阳性,见图5A。Western blot结果显示,与相应对照组相比,DLBCL 移植瘤IL-6组survivin和VEGF明显升高(P<0.05),AG490 组p-STAT3 及VEGF 明显降低(P<0.05),survivin未见明显改变,见图5B; BL移植瘤IL-6处理组p-STAT3和VEGF明显升高(P<0.05),而survivin表达无明显改变,在AG490处理组3种蛋白均明显降低(P<0.05),见图5C。
与对照组比较,DLBCL移植瘤中survivin和VEGF的mRNA表达水平在IL-6组的差异无统计学显著性,在AG490 组与对照组之间差异亦无统计学显著性,见图6。
讨 论
肿瘤微环境是体外实验研究不能实现的。因此,移植瘤模型建立的活体内实验是肿瘤研究不可或缺的手段。本研究采用DLBCL细胞(OCI-LY8细胞株)和BL细胞(Raji细胞株)建立移植瘤模型,为体内研究搭建平台。
JAK/STAT信号转导和转录激活因子信号通路已被证实与结肠癌、肝细胞癌和肺癌等多种肿瘤发生、发展密切相关[2],其在化疗耐药中的作用也被研究证实[3-4]。其中,STAT3虽然不是真正定义上的癌基因,但其对很多癌基因、抑癌基因表达的强大转录调控作用与肿瘤的发生发展关系密切,其主要是通过对其下游靶基因的转录调控而参与肿瘤的发生和演进过程。而细胞因子在肿瘤微环境中起到关键作用[5],有报道肿瘤相关细胞因子IL-6不仅能被STAT3上调表达,而且是STAT3信号通路的激活子[6]。本研究发现,IL-6处理的移植瘤体积和裸鼠体重有所增加;IL-6处理后p-STAT3蛋白表达在DLBCL和BL中均有所升高,与既往的研究报道和我们在体外细胞实验中的结果一致。而目前研究较多的JAIK/STAT通路特异性阻断剂AG490,可通过抑制STAT3磷酸化及下调细胞中STAT3的表达来阻断该信号通路[7-8]。大量体内外研究表明,AG490可抑制多种实体瘤细胞的增殖、侵袭和转移,对U266骨髓瘤和ALCL瘤细胞的增殖[8]和NK T细胞淋巴瘤细胞株中STAT3 的活化[9]均有抑制作用。本课题组的前期体外细胞实验也发现,AG490抑制培养的DLBCL和BL细胞内STAT3活化,减少STAT3的靶基因survivin和TIMP1的表达。本研究中AG490处理的2种淋巴瘤移植瘤组织中p-STAT3蛋白表达明显下调,瘤体生长曲线也比对照组曲线上升幅度小,这与前期的体外细胞实验结果符合。

Figure 5. The images of IHC (A; ×200) and Western blot for determining the protein levels of p-STAT3, survivin and VEGF in the DLBCL (B) and BL (C) transplanted tumors with different treatments. Mean±SD.n=3.*P<0.05vscontrol group.
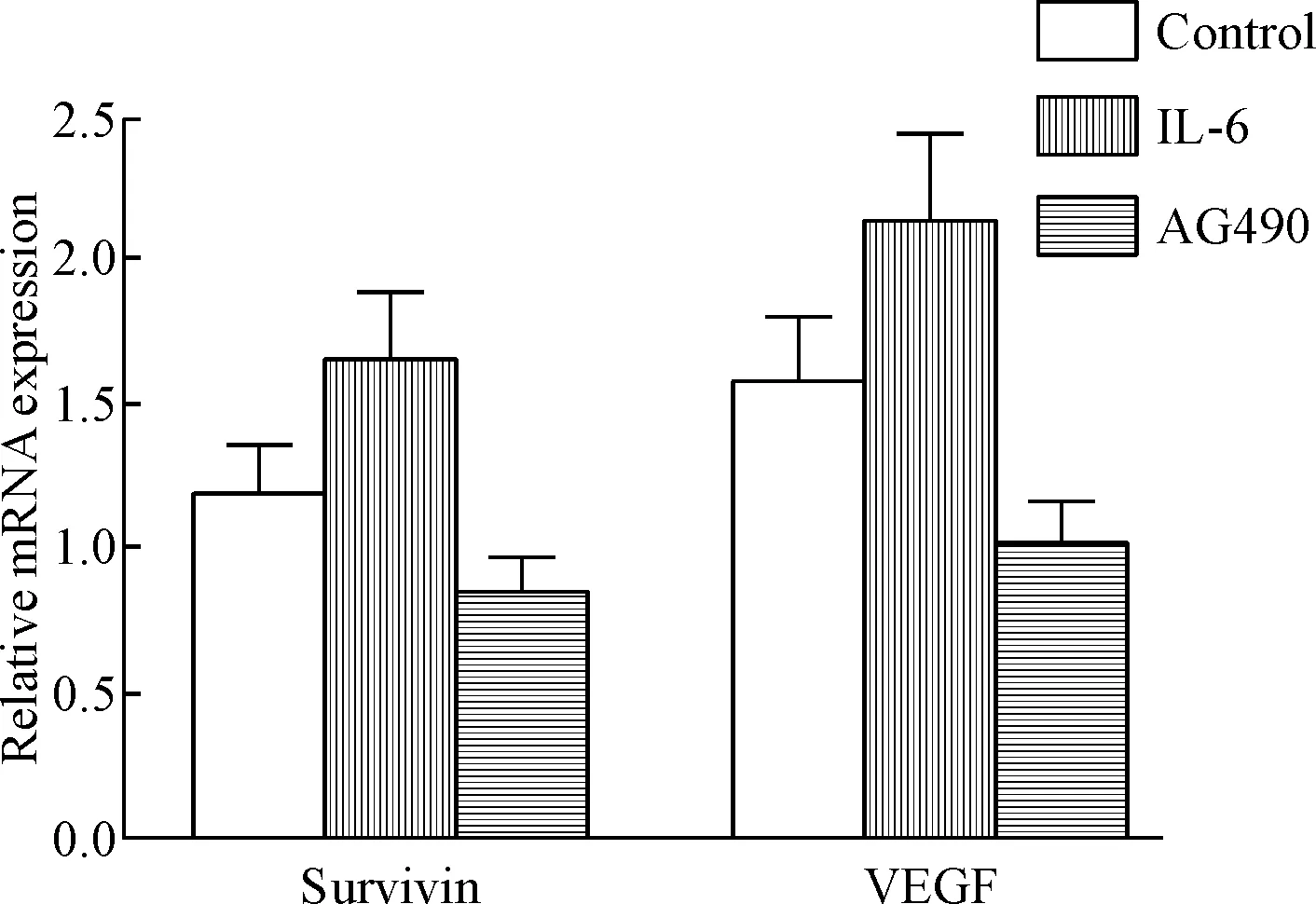
Figure 6. The 2-ΔΔCtvalues for evaluating the mRNA relative expression levels of survivin and VEGF in AG490, control and IL-6 groups of DLBCL. Mean±SD.n=3.
Survivin既是一个细胞凋亡抑制因子,又是细胞周期调控因子。它是一个很有前景的肿瘤治疗靶点[10]。在侵袭性NHL中survivin表达明显高于惰性NHL,而且在DLBCL及间变性大细胞淋巴瘤中survivin阳性表达病例预后差、5年生存率明显降低[11]。在研究间变性大细胞淋巴瘤时发现,p-STATS表达与survivin表达呈明显的正相关[12]。本课题组前期体外研究已发现survivin蛋白表达与STAT3和p-STAT3的水平呈现正相关关系。本研究结果与前期实验结果基本一致,提示DLBCL中STAT3活化可能是survivin高表达的重要分子机制,survivin应该是DLBCL治疗的一个重要靶点。然而,由于DLBCL的高度异质性,筛选适合该靶向治疗的DLBCL亚型将成为一个很有意义研究热点。
VEGF是一个重要的血管生成调节分子,故其表达异常与肿瘤的侵袭力和转移有着密切关系。在DLBCL中,Ⅲ、IV期患者VEGF的表达明显高于I、Ⅱ期患者,具有伴发症状的患者表达也增高[13-14]。目前已有研究证实,VEGF基因是STAT3的靶基因,通过STAT3可上调VEGF的表达[15]。在本研究中,DLBCL和BL两细胞株裸鼠移植瘤组织中VEGF蛋白表达在AG490处理组降低,在IL-6处理组增高,且与p-STAT3蛋白表达一致。结果表明在DLBCL和Burkitt淋巴瘤中VEGF表达上调可能也是STAT3活化的结果。
此外,本研究还发现survivin和VEGF的mRNA 表达量在IL-6和AG490处理组之间的差异均无统计学显著性。这提示survivin和VEGF表达可能存在转录后调控的机制或者存在其它通路对survivin及VEGF的调控,有待进一步研究的探讨。
综上所述,在IL-6和AG490作用下,DLBCL和Burkitt淋巴瘤裸鼠移植瘤的体积和裸鼠体重有一定程度变化,肿瘤组织中STAT3的活化出现明显异常,其下游靶基因survivin和VEGF表达变化与STAT3的变化一致。肿瘤的变化与STAT3的活化异常有关,survivin和VEGF异常可能是STAT3活化异常的结果。2种淋巴瘤移植瘤中survivin和VEGF表达异常可能是STAT3活化影响淋巴瘤生长的相关分子机制。
