氢分子通过激活自噬抑制C/EBP同源蛋白介导的巨噬细胞凋亡*
2018-08-27高聪聪郑冠琳姚来彬杨娜娜孔雅茹姚树桐秦树存
田 华, 高聪聪, 郑冠琳, 姚来彬, 焦 鹏, 杨娜娜, 孔雅茹, 姚树桐, 4△, 秦树存△
(泰山医学院1动脉粥样硬化研究所, 山东省高校动脉粥样硬化重点实验室,2生命科学学院,4基础医学院, 山东 泰安 271016;3泰山护理职业学院, 山东 泰安 271000)
易损斑块形成和破裂是造成动脉粥样硬化(atherosclerosis,AS)病变晚期临床急性症状的主要原因,而大量细胞凋亡是导致易损斑块形成,并影响其稳定性的重要因素。对心性猝死患者冠脉粥样斑块的研究证实,斑块内的凋亡细胞主要为巨噬细胞,提示巨噬细胞凋亡与AS斑块稳定性密切相关。因此,目前有研究者认为干预巨噬细胞的凋亡过程可能对阻止AS进展及降低心脑血管病事件发生率具有重要意义[1]。文献报道[2-3]和我们既往研究证实,氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)[4]可诱导巨噬细胞发生内质网应激(endoplasmic reticulum stress,ERS)反应,并上调C/EBP 同 源 蛋 白(C/EBP homologous protein,CHOP)表达,从而促进巨噬细胞凋亡,降低AS斑块稳定性,而载脂蛋白A-I(apoli-poprotein,A-I,ApoA-I) 模拟肽D4F[5]、槲皮素[6]和蜂胶醇提物[7]可通过抑制 CHOP 表达减轻巨噬细胞凋亡。
氢分子(hydrogen,H2)是世界上最轻且最丰富的化学元素,具有抗氧化、抗炎和抗凋亡等生物学作用[8],我们既往研究证实, 氢分子可以减轻博莱霉素诱导的小鼠肺纤维化[9];抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的脐静脉内皮细胞中凝集素样氧化型低密度脂蛋白受体1(lectin-like oxidized LDL receptor,LOX-1)表达,从而保护内皮细胞[10];降低高脂喂养的ApoE基因敲除(ApoE-/-)小鼠的AS易感性[11];抑制高脂喂养的LDL受体敲除(LDLR-/-)小鼠AS斑块的ERS反应,减少斑块内巨噬细胞凋亡,增加AS斑块稳定性[12],但是氢分子对ERS凋亡途径的调控机制还有待进一步阐明。
自噬是真核细胞利用溶酶体降解细胞内受损的细胞器及蛋白等大分子物质的过程,常在营养缺乏、组织缺氧、氧化应激和DNA损伤等情况下被激活。机体可通过自噬回收利用内源性细胞成分(氨基酸、游离脂肪酸和核苷酸)以维持细胞稳态[13]。文献报道巨噬细胞内ox-LDL的蓄积会引起氧化应激,进而触发AS斑块内巨噬细胞的自噬,而自噬的激活可减轻AS病变,增强斑块的稳定性[14]。敲除斑块内巨噬细胞自噬关键基因——自噬相关基因5(auto-phagy-related gene 5,ATG5)后,细胞凋亡和氧化应激水平明显增加,且自噬缺陷的凋亡细胞被吞噬细胞识别并清除的作用减弱,斑块内坏死核心增加,斑块的稳定性下降[15]。本课题组既往研究证实自噬通过抑制CHOP表达减轻ox-LDL诱导的巨噬细胞凋亡[16],提示自噬反应的激活可减缓AS进展,增强斑块稳定性,其机制可能与调控ERS反应有关。本研究在ox-LDL诱导的巨噬细胞凋亡模型的基础上,研究氢分子对CHOP介导的ERS凋亡途径的抑制作用,并探讨其上游机制是否与激活自噬有关。
材 料 和 方 法
1 材料与试剂
ox-LDL购自北京协生生物科技有限公司;DMEM高糖培养基和胎牛血清购自Gibco;抗beclin-1、CHOP和微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)多克隆抗体分别购自Cell Signaling Technology和Santa Cruz;3-甲基腺嘌呤(3-methyladenine,3-MA)、雷帕霉素(rapa-mycin,Rap)和兔抗β-actin多克隆抗体购自Sigma;Alexa Fluor 488标记驴抗兔IgG(H+L)购自Molecular Probes;辣根过氧化物酶标记山羊抗兔 IgG购自北京中杉金桥;四甲基偶氮唑蓝[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyl-2H-tetrazolium bromide,MTT]购自Genview;乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒购自南京建成生物技术公司;Annexin V-FITC细胞凋亡测定试剂盒购自南京凯基公司;增强化学发光(enhanced chemiluminescence,ECL)试剂盒购自Pierce;PVDF膜购自Millipore;其余试剂均为分析纯产品。
2 方法
2.1饱和氢培养基的制备 根据以往报道的方法进行制备[17],使用AYH-300型氢气发生器(北京天雨泽科技有限公司),在0.5 MPa压力下,将纯氢气溶解于无菌DMEM培养基中,达到饱和水平持续4 h。所用饱和氢培养基均为每次使用前新鲜配制,以维持氢气浓度不低于0.6 mmol/L。
2.2细胞培养和实验分组 鼠源RAW264.7巨噬细胞和人源THP-1巨噬细胞购自中国科学院上海生物化学与细胞生物学研究所细胞库。其中,RAW264.7巨噬细胞用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM 高糖培养基在37 ℃、5% CO2的培养箱中培养。处理前更换为无血清DMEM培养基同步化12 h,然后随机分为如下7组:(1) 正常对照(control)组;常规培养基培养;(2) 氢分子对照(H2)组:饱和含氢培养基培养;(3) ox-LDL组:常规培养基中加入100 mg/L ox-LDL;(4) 氢分子处理(H2+ox-LDL)组:饱和含氢培养基中加入100 mg/L ox-LDL;(5) 氢分子和3-MA同时处理(3-MA+H2+ox-LDL)组:饱和含氢培养基中先加入5 mmol/L 3-MA预处理1 h,再加入100 mg/L ox-LDL;(6) ox-LDL和Rap同时处理(Rap+ox-LDL)组:常规培养基中先加入3 μmol/L Rap预处理1 h,再加入100 mg/L ox-LDL;(7) 氢分子和Rap同时处理(Rap+H2+ox-LDL)组:饱和含氢培养基中先加入3 μmol/L Rap预处理1 h,再加入100 mg /L ox-LDL。人源THP-1巨噬细胞用含10%胎牛血清和L-谷氨酰胺(2 mmol/L)的RPMI-1640培养基在37 ℃、5% CO2的培养箱中培养,并用100 nmol/L佛波酯(phorbol 12-myristate 13-acetate,PMA)处理3 d,诱导分化为巨噬细胞,然后随机分为如下3组:(1) 正常对照(control)组:常规培养基培养;(2) ox-LDL组:培养基中加入100 mg/L ox-LDL;(3) 氢分子处理(H2+ox-LDL)组:饱和含氢培养基中加入100 mg/L ox-LDL。各组培养24 h后收集细胞。
2.3细胞活力和 LDH活性的测定 细胞培养于96孔板,按上述分组处理后,按既往报道的 MTT方法[7]检测细胞活力,以正常对照组细胞活力为100%,其余各组细胞活力以其吸光度(A) 值占正常对照组A值的百分比表示。同时,按照LDH活性检测试剂盒说明书测定培养基中LDH水平,进一步检测细胞损伤程度。
2.4Annexin V-FITC/PI双染法检测细胞凋亡 细胞按上述分组处理后,收集并重悬于500 μL上样缓冲液中,加入5 μL Annexin V-FITC和5 μL碘化丙啶(propidium iodide,PI)室温下避光孵育15 min,由流式细胞仪(Becton-Dickinson)分析测定细胞凋亡率。总细胞凋亡率(%) =早期凋亡率(Annexin+/PI-)+晚期凋亡率(Annexin+/PI+)。
2.5Western blot分析 采用RIPA试剂提取各组细胞总蛋白,BCA法测定蛋白浓度。等量蛋白采用10% SDS-PAGE进行分离,然后电转至PVDF膜,室温封闭,分别加入兔抗beclin-1(1 ∶500)、CHOP(1 ∶200) 和β-actin(1 ∶1 000)多克隆抗体,4 ℃孵育过夜,室温下洗膜后加入辣根过氧化物酶山羊抗兔IgG孵育2 h,洗膜后用化学显色底物 ECL进行发光显示,应用化学发光成像系统(上海欧翔科学仪器有限公司)进行图像采集。采用Image-Pro Plus图像分析软件(Version 6.0,Media Cybernetics)分析蛋白条带的积分吸光度(integral absorption,IA)值,以靶蛋白IA值/β-actinIA值的比值反映靶蛋白相对水平。
2.6免疫荧光细胞化学法检测LC3的表达 细胞培养于盖有无菌盖玻片的6孔培养板内,处理后经PBS润洗3次,4%多聚甲醛固定15 min,PBS润洗后以0.1% Triton X-100室温处理5 min,10%驴血清封闭,滴加兔抗小鼠LC3的 I 抗(1 ∶100),4 ℃孵育过夜,PBS润洗后滴加Alexa Fluor 488标记驴抗兔IgG(1 ∶ 1 000),37 ℃孵育30 min,以DAPI复染细胞核(蓝色),PBS充分润洗后以抗淬灭剂封片。激光共聚焦显微镜(Nikon)下观察,LC3阳性表达呈绿色,呈颗粒状聚集表明发生自噬反应。
3 统计学处理
结果用均数±标准差(mean±SD)表示。采用SPSS 13.0统计软件进行单因素方差分析,组间两两比较应用SNK法,以P<0.05为差异有统计学意义。
结 果
1 氢分子抑制ox-LDL诱导的巨噬细胞损伤
以100 mg/L ox-LDL处理RAW264.7细胞24 h可明显诱导细胞损伤,与对照组比较,细胞活力显著降低,LDH漏出增加(P<0.01);而氢分子可明显减轻ox-LDL所诱导的巨噬细胞损伤,与ox-LDL组相比,细胞活力增加,LDH漏出减少(P<0.05或P<0.01),见图1。
2 氢分子抑制ox-LDL诱导的巨噬细胞凋亡
ox-LDL处理组的RAW264.7细胞凋亡率较正常对照组明显增加 (P<0.01);而与ox-LDL 处理组比较,氢分子处理组细胞凋亡率显著降低 (P<0.01),见图 2。

Figure 1. The effect of hydrogen on the injury of RAW264.7 macrophages induced by ox-LDL. Mean±SD.n=6.* P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0. 01vsox-LDL group.
3 氢分子对ox-LDL诱导的巨噬细胞beclin-1和CHOP蛋白表达的影响
Beclin-1和CHOP分别是自噬启动和ERS凋亡途径的关键分子,Western blot结果显示,与正常对照组比较,ox-LDL处理组RAW264.7细胞中beclin-1和CHOP表达水平均明显增加(P<0.05或P<0.01);与ox-LDL 处理组比较,氢分子处理组的beclin-1表达进一步增加(P<0.01),而CHOP的表达水平明显下降(P< 0.01),表明氢分子可增强ox-LDL诱导的细胞自噬反应,同时可抑制CHOP介导的ERS凋亡途径,见图3。
4 氢分子通过激活自噬抑制ox-LDL诱导的巨噬细胞损伤
为了进一步明确氢分子可能通过诱导自噬而减轻ox-LDL所致的巨噬细胞凋亡,我们分别应用自噬抑制剂3-MA和自噬诱导剂Rap处理RAW264.7细胞,观察其对氢分子保护巨噬细胞的拮抗或促进作用。结果显示,氢分子对ox-LDL所致的细胞凋亡和细胞活力降低的抑制作用可被3-MA所拮抗,而被Rap进一步增强(P<0.05或P<0.01),见图 4。
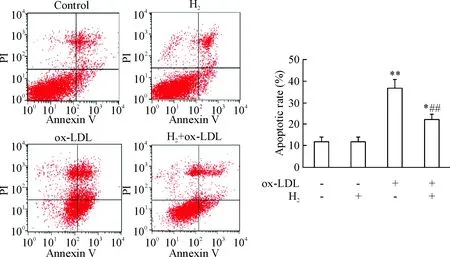
Figure 2. The effect of hydrogen on the apoptosis of RAW264.7 macrophages induced by ox-LDL. Mean±SD.n=6.*P<0.05,** P<0.01vscontrol group;##P<0.01vsox-LDL group.

Figure 3. The effect of hydrogen on the expression of beclin-1 and CHOP in RAW264.7 macrophages induced by ox-LDL. Mean±SD.n=3.*P<0.05,** P<0.01vscontrol group;##P<0.01vsox-LDL group.
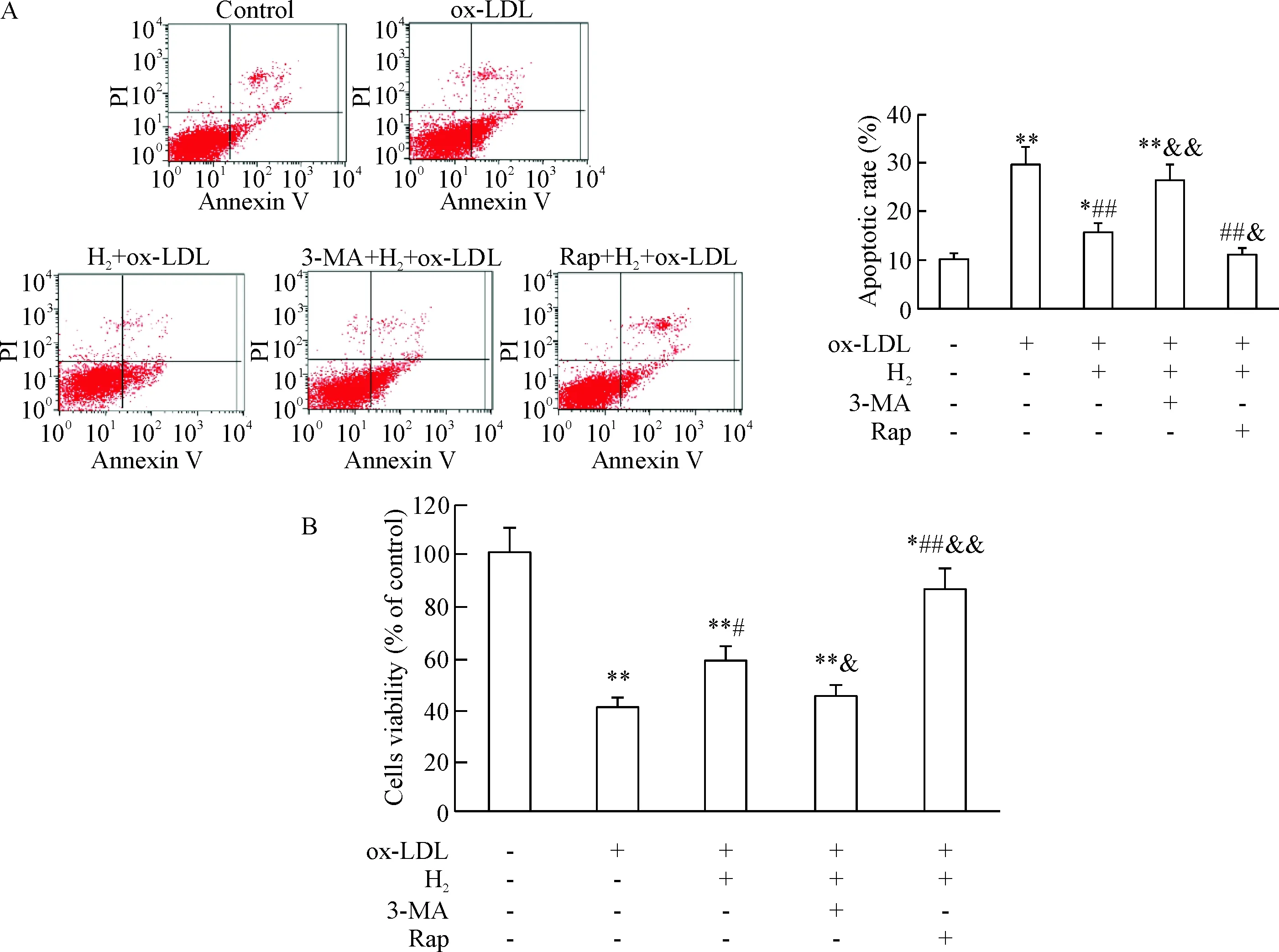
Figure 4. Hydrogen inhibited ox-LDL-induced injury of RAW264.7 macrophages by activating autophagy. A: the apoptotic rates were assayed by Annexin V-FITC/PI staining; B: the cell vability was measured by MTT assay.Mean±SD.n=6.* P<0.05,** P<0.01vscontrol group;#P<0.05,##P<0.01vsox-LDL group;&P<0.05,&&P<0.01vsH2+ox-LDL group.
5 氢分子通过激活自噬抑制ox-LDL所诱导的巨噬细胞CHOP上调
LC3是自噬的另一个标志分子,自噬发生后,LC3-I经泛素样加工修饰形成 LC3-II,进而整合到自噬体膜中,在自噬体形成中起重要作用。本实验采用免疫细胞化学法检测LC3聚集情况,结果显示,与对照组比较,经ox-LDL处理RAW264.7细胞24 h后,LC3颗粒化聚集明显;氢分子可促进ox-LDL的上述作用,且这种促进作用可被3-MA减弱,而被Rap进一步增强,见图5A。
与LC3的结果一致,Western blot结果显示,氢分子对ox-LDL所致beclin-1表达上调的促进作用可被3-MA抑制(P<0.01),而被Rap进一步增强(P<0.01)。另外,氢分子对ox-LDL所致CHOP表达上调的抑制作用亦可被3-MA减弱(P<0.01),而被Rap进一步增强(P<0.01),见图5B。上述结果表明氢分子可通过诱导自噬减轻CHOP介导的巨噬细胞凋亡。
6 氢分子对ox-LDL诱导的人源巨噬细胞THP-1凋亡及beclin-1和CHOP表达的影响
ox-LDL处理组THP-1巨噬细胞凋亡率较正常对照组明显增加(P<0.01);而与ox-LDL 处理组比较,氢分子处理组细胞凋亡率明显降低(P<0.05),见图6A。Western blot结果显示,与正常对照组比较,ox-LDL处理组细胞beclin-1表达有上升趋势,CHOP表达水平明显增加(P<0.01);与ox-LDL 处理组比较,氢分子处理组beclin-1表达进一步增加(P<0.01),而CHOP表达水平明显下降(P<0.01),见图6B,表明氢分子可增强自噬反应,同时可抑制CHOP所介导的THP-1巨噬细胞凋亡。
讨 论
巨噬细胞是在AS进展,尤其是泡沫细胞和易损斑块形成中起着关键作用的炎症细胞。大量巨噬细胞凋亡不仅直接导致凋亡的平滑肌细胞和巨噬细胞不能被有效吞噬,促进脂质核心的形成及增大,而且富含游离胆固醇的凋亡巨噬细胞通过释放基质降解蛋白酶损伤纤维帽,并产生肿瘤坏死因子-α和白细胞介素-1β,引起继发性炎症反应和坏死,从而促进斑块不稳定[1]。我们既往研究证实了腹腔注射饱和含氢生理盐水可以抑制ApoE-/-小鼠体内氧化应激反应,降低血浆胆固醇和载脂蛋白B含量,并减轻AS斑块中巨噬细胞浸润及炎症因子表达,进而抑制AS进展[11]。本研究在体外实验中证实氢分子可抑制ox-LDL诱导的RAW264.7巨噬细胞损伤,表现为细胞活力增加,LDH漏出减少及细胞凋亡率降低。

Figure 5. Hydrogen inhibited ox-LDL-induced CHOP upregulation by activating autophagy. A: immunofluorescence experiments showed LC3 visualized by Alexa Fluor 488 labeling (green) and nuclei stained with DAPI (blue). The representative fluorescent images captured using a laser scanning confocal microscope were showed. The scale bar = 20 μm. B: the protein expression of beclin-1 and CHOP was analyzed by Western blot. Mean±SD.n=6.* P<0.05,** P<0.01vscontrol group;#P<0.05,##P<0.01vsox-LDL group;△△P<0.01vsH2+ox-LDL group;▲▲P<0.01vsRap+ox-LDL group.
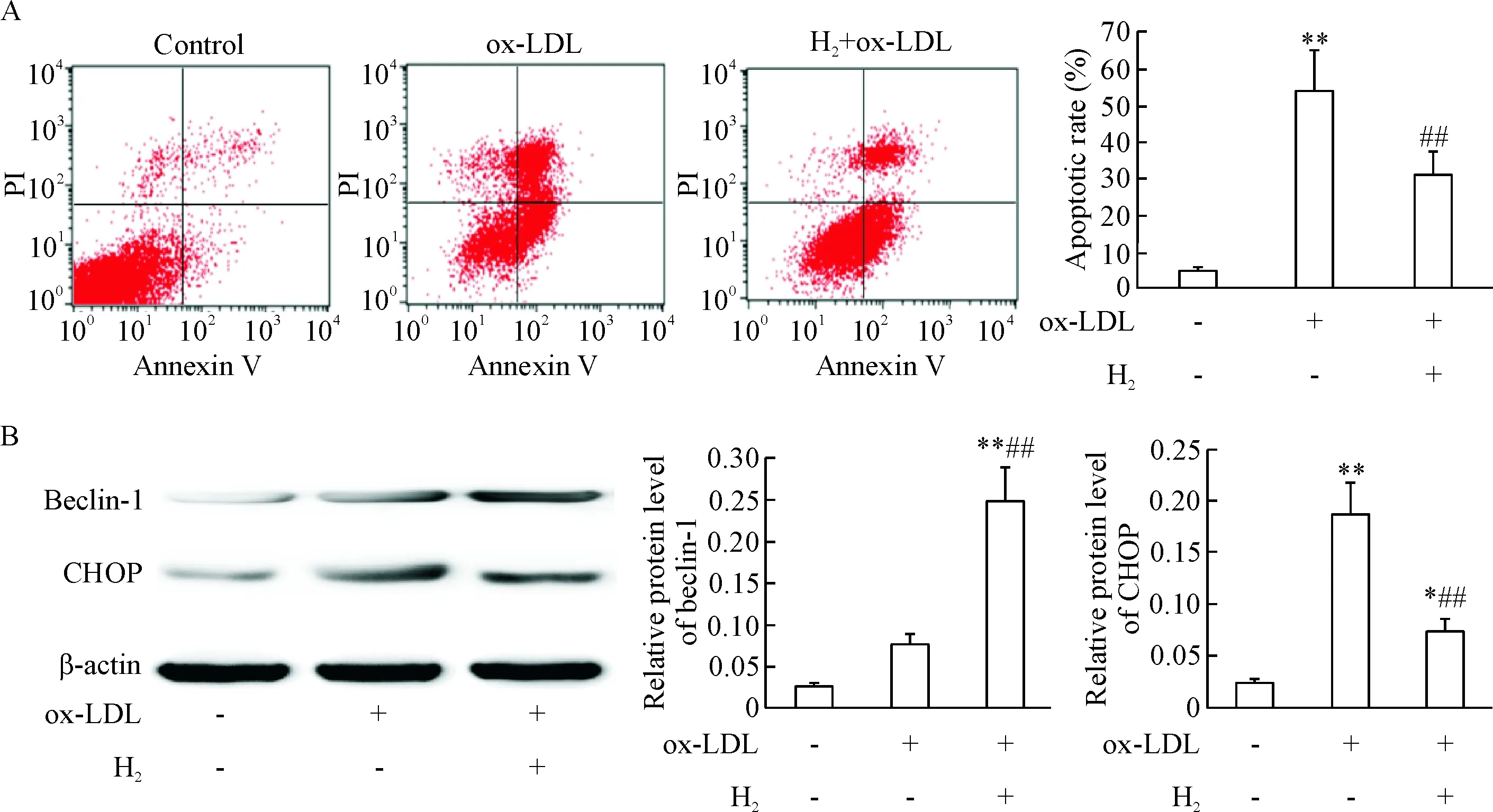
Figure 6. The effect of hydrogen on the apoptosis and the expression of beclin-1 and CHOP in THP-1-derived macrophages induced by ox-LDL. A: the ratio of apoptotic cells stained with Annexin V-FITC and PI was detected by flow cytometry analysis; B: the protein levels of beclin-1 and CHOP were determined by Western blot. Mean±SD.n=3.*P<0.05,** P<0.01vscontrol group;##P<0.01vsox-LDL group.
CHOP 又称生长停滞和DNA损害诱导基因153(growth arrest and DNA damage-inducible gene 153,GADD153),是介导ERS 相关凋亡途径的关键分子之一。大量研究表明,CHOP介导AS粥样斑块中巨噬细胞凋亡,并与AS斑块易损性密切相关[3, 18]。我们既往研究也证实,CHOP信号途径介导ox-LDL所诱导的巨噬细胞凋亡,而D4F、槲皮素和蜂胶醇提物可通过抑制该信号途径减轻巨噬细胞凋亡[4-7],表明CHOP介导的ERS相关凋亡途径参与AS的发生发展,并有可能成为AS防治的重要靶点。另外我们在LDLR-/-小鼠AS模型上证实氢分子可通过抑制ERS和氧化应激途径减少粥样斑块中巨噬细胞凋亡,从而增加斑块稳定性[12]。本研究在体外实验中进一步证实氢分子可抑制ox-LDL诱导的巨噬细胞CHOP表达上调,进而减轻巨噬细胞凋亡。
自噬是保持细胞稳态的重要过程,可以被饥饿、病原入侵和氧化应激等诱导。自噬始于双层膜自噬体结构形成,称为吞噬泡。自噬体在延伸过程中包裹脂滴、蛋白质聚集体和受损细胞器等胞内物质,并逐步延伸、成熟,形成自噬体,当其与溶酶体融合时,可转变为单层膜结构的自噬溶酶体。溶酶体的酸性环境及大量水解酶使物质变性水解,进一步降解为被细胞循环利用的代谢产物[19]。脂质过载的泡沫细胞是导致炎性反应和斑块进展的主要原因。巨噬细胞自噬不足使大量泡沫细胞聚集,脂质清除缺陷,胆固醇的流出减少[20],细胞内聚集受损的线粒体,造成细胞内活性氧水平上升,并激活炎症因子,造成DNA损伤,最终导致泡沫细胞凋亡,进而增加斑块破裂的风险。巨噬细胞自噬作为一种代偿机制,能够减轻上述因素对斑块的不良影响[21-22],提示自噬作为一种细胞自稳态调控机制,可能对AS进展具有延缓作用。近期关于氢分子调控自噬的文献报道并不一致,一方面富氢液可以通过激活自噬减轻带状疱疹后神经痛大鼠的机械痛敏和炎症因子的释放[23],饱和氢盐水通过抑制ERS并增强自噬而对新生小鼠缺氧缺血性脑损伤起到神经保护作用[24];另一方面,氢水可有效抑制反复力竭运动造成的海马组织超微结构、氧化应激损伤及细胞自噬现象[25],饱和氢盐水可降低心肌细胞自噬,减轻老年大鼠心肌缺血再灌注损伤[26]。对于这些现象,我们推测可能与氢分子在不同疾病模型中对自噬的调控作用及机制不同有关。我们既往研究证实,ox-LDL可经ERS途径诱导巨噬细胞自噬,而一定程度的自噬又可以通过抑制CHOP表达而减轻ox-LDL诱导的细胞凋亡[16],提示自噬对CHOP介导的ERS凋亡途径可能具有调控作用。本实验结果显示,氢分子可进一步上调ox-LDL诱导的自噬标志分子beclin-1表达,并促进LC3聚集,且该作用可被自噬抑制剂3-MA减弱,而被自噬诱导剂Rap增强。另外,氢分子对ox-LDL所致的RAW264.7巨噬细胞凋亡和细胞活力降低及CHOP上调的抑制作用也可被3-MA拮抗,而被Rap促进;在ox-LDL诱导的人源 THP-1巨噬细胞凋亡模型上也观察到氢分子不仅可抑制ox-LDL所诱导的巨噬细胞凋亡和CHOP上调,也可使beclin-1表达进一步上调,提示氢分子可通过上调巨噬细胞自噬抑制CHOP介导的巨噬细胞凋亡。
综上所述,本研究表明氢分子可通过抑制CHOP表达减轻ox-LDL所诱导的巨噬细胞凋亡,其上游机制可能是通过激活自噬实现的。
