阿司匹林对TNF-α诱导人早孕滋养细胞增殖和侵袭的影响及机制*
2018-08-27蔡丹纯王海臻廖丹丹高云飞
蔡丹纯, 王海臻, 廖丹丹, 钟 梅, 高云飞, 盛 超
(南方医科大学南方医院妇产科, 广东 广州 510515)
子痫前期(preeclampsia,PE)是一种以高血压和蛋白尿为主要临床表现的严重危害母儿健康的妊娠期特发性疾病,在我国发病率为2%~8%,是围生期母婴死亡的主要原因之一[1]。目前主流观点普遍认为子宫螺旋动脉重铸障碍导致胎盘形成缺陷是PE发病的始动因素[2-3],而螺旋动脉血管重铸障碍的实质是滋养细胞侵袭能力下降[4]。滋养细胞的侵袭能力受基质金属蛋白酶(matrix metalloproteinase,MMP)表达[5-6]及黏附分子表型转化[7]等的影响。研究发现,MMP-2和MMP-9在PE孕妇胎盘组织中表达显著降低,导致滋养细胞侵袭功能受损,螺旋动脉重铸不全[8]。
阿司匹林(aspirin)是环加氧酶抑制剂,可抑制前列腺素的合成,具有解热、镇痛和抗血小板聚集等作用,临床应用较广泛。流行病学研究表明,对于有PE高危因素的孕妇从孕11~14周开始口服小剂量阿司匹林直至孕36周,可明显降低PE的发生率[9-12]。Li等[13]发现,小剂量阿斯匹林可通过抑制环加氧酶1,降低暴露于缺氧环境下的原代滋养细胞中可溶性血管内皮生长因子受体1的表达和释放,进而对小剂量阿司匹林预防PE的发生做出了合理的解释。然而,目前尚缺乏阿司匹林对于绒毛滋养细胞功能影响的直接证据。本研究拟利用体外细胞模型,深入探讨阿司匹林对滋养细胞增殖和侵袭的影响及调控机制,为阿司匹林预防PE的发生提供理论和实验依据。
材 料 和 方 法
1 实验材料
选择南方医科大学附属南方医院2015年12月~2017年12月住院分娩的PE孕妇20例作为PE组,另以同期因社会因素行择期剖宫产术的20例无合并症的正常孕妇为正常对照(control)组。本研究取得了所有受试对象的知情同意,并且通过了南方医科大学附属南方医院伦理委员会的批准。PE诊断标准参照中华医学会妇产科学分会妊娠期高血压疾病学组2015年提出的妊娠期高血压疾病诊治指南[14]。所有研究对象均为单胎妊娠。正常对照组孕妇无吸烟、酗酒及长期服用药物史,无高血压、糖原病、心脏病、肾脏病等妊娠合并症;既往未发生过反复自然流产、胎儿畸形、死胎和死产等,此次妊娠因社会因素行剖宫产术。
本研究所用的细胞系为永生化的人早孕滋养细胞系HTR-8/SVneo,由加拿大皇后大学Charles H.Graham教授惠赠。RPMI-1640培养基和胎牛血清购自Gibco;肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)和阿司匹林购自Sigma; CCK-8检测试剂盒购自碧云天生物技术研究所;蛋白提取试剂盒购自普利莱基因技术有限公司;抗细胞周期蛋白D1(cyclin D1)抗体购自Cell Signaling Technology;抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体购自Abcam;抗β-actin抗体购自武汉博士德公司;辣根过氧化物酶标记的IgG购自北京中杉金桥公司; MMP-2及MMP-9 ELISA试剂盒购自Abcam; MMP-2/MMP-9活性检测试剂盒购自AnaSpec。
2 实验方法
2.1标本收集 在分娩前抽取孕妇肘静脉血3 mL,室温自凝30 min后,4 ℃、3 000 r/min离心10 min,分离出血清,置于-80 ℃冰箱保存。胎盘娩出后5 min内于胎盘母体面脐带旁开2 cm左右处,避开机化灶、钙化灶和出血灶迅速取胎盘组织4块,每块约1.0 cm×1.0 cm×1.0 cm,部分置于10%甲醛固定,用于随后组织形态观察。
2.2HE染色观察胎盘组织形态 胎盘组织经固定、脱水、透明、石蜡包埋及切片,切片厚度为4 μm,常规HE染色,观测胎盘子宫螺旋动脉管径的变化。
2.3细胞的培养 早孕滋养细胞系HTR-8/SVneo培养于含10%胎牛血清的RPMI-1640培养基,37 ℃、5% CO2培养箱培养,适时换液及传代。
2.4CCK-8法测定细胞活力 取对数生长期的HTR-8/SVneo细胞,接种于96孔板,每孔1×104个细胞,培养过夜,之后给予TNF-α (0.5 μg/L)和不同浓度(0.1、1和10 mmol/L)的aspirin,同时设立对照组,处理24 h。每组设置5个复孔,并设立空白组。各组细胞作用至规定时点后,每孔加入CCK-8试剂10 μL,继续培养2 h。酶标仪测定各个孔在450 nm波长处的吸光度(A) 值。细胞活力(%) =(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2.5Western blot检测Cyclin D1及PCNA蛋白的表达水平 将对数期生长的HTR-8/SVneo细胞,分为4组:对照(control)组、TNF-α组、aspirin组和TNF-α+aspirin组,按3×106个接种于60 mm细胞培养皿内,培养24 h后,对4组细胞分别进行如下处理: TNF-α组加入0.5 μg/L TNF-α; aspirin组加入0.1 mmol/L aspirin; TNF-α+aspirin组分别加入0.5 μg/L TNF-α和0.1 mmol/L aspirin;对照组加入与上述药物等体积的PBS。处理24 h后裂解各组细胞提取总蛋白,用全自动生化分析仪(Beckman)测定蛋白质浓度。根据蛋白浓度取适量进行SDS-PAGE分离蛋白。将蛋白转移到硝酸纤维素膜后,将膜置于含5%脱脂奶粉的TBST中摇床上封闭2 h,用TBST洗膜10 min,共3次,分别用抗cyclin D1、PCNA及β-actin的Ⅰ抗按适当比例4 ℃孵育过夜,TBST洗膜3次,加入辣根过氧化物酶标记的Ⅱ抗孵育2 h,TBST洗膜3次,化学发光。实验重复3次。
2.6Transwell小室实验检测细胞侵袭能力 4 ℃融化Matrigel,于冰上将Matrigel用PBS按照1∶8稀释。把Transwell小室放入24孔板中,取50 μL稀释好的Matrigel铺在小室内,放入细胞培养箱中2~3 h促胶凝固。Transwell上室中分别加入4个组的细胞悬液(1×105/L)200 μL,下室中加入含有10%胎牛血清的RPMI-1640培养基,37 ℃、5% CO2培养箱继续培养24 h,清洗膜,甲醛固定30 min,结晶紫染色5 min,显微镜下拍照,随机取6个不同的视野(×200)观察并记录穿膜的细胞数,实验重复3次,计算每组小室细胞的平均数。
2.7ELISA法检测MMP-2及MMP-9水平 收集细胞培养上清液,按试剂盒说明书进行操作,检测对照组、TNF-α组、aspirin组和TNF-α+aspirin组细胞培养上清液中MMP-2及MMP-9表达水平。实验重复3次。
2.8MMP-2/MMP-9活性检测试剂盒检测MMP-2及MMP-9活性水平 收集细胞培养上清液,按试剂盒说明书进行操作,检测对照组、TNF-α组、aspirin组和TNF-α+aspirin组细胞培养上清液中MMP-2及MMP-9活性水平。实验重复3次。
3 统计学处理
采用SPSS 16.0软件对数据进行统计学分析。计量资料均用Kolmogorov-Smirnov检验方法检验符合正态性分布,采用均数±标准差(mean±SD)表示,组间比较采用t检验或单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 PE孕妇胎盘组织中子宫螺旋动脉血管重铸障碍
HE染色显示,与对照组孕妇比较,PE组孕妇的胎盘组织子宫螺旋动脉管径变小,血管平滑肌增厚,提示螺旋动脉血管重铸障碍,见图1。

Figure 1. Uterine spiral artery in preeclampsia (PE) placenta was narrow (×200).
2 孕妇血清中MMP-2及MMP-9浓度
采用ELISA法检测对照组及PE组孕妇血清中MMP-2及MMP-9浓度,结果表明PE组MMP-2及MMP-9浓度明显低于对照组(P<0.05),见图2。
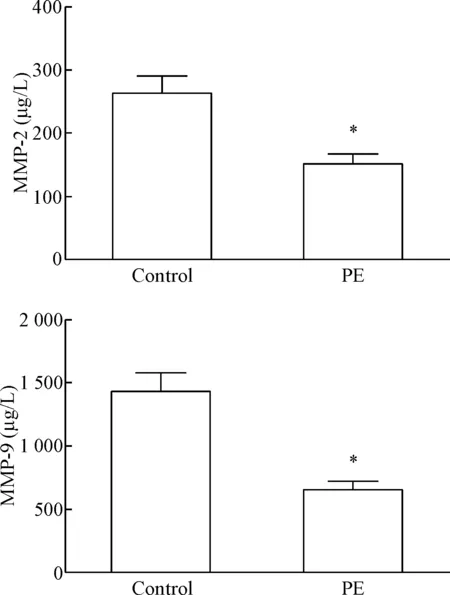
Figure 2. Serum levels of MMP-2 and MMP-9 were lower in preeclampsia (PE) women. Mean±SD.n=10.*P<0.05vscontrol group.
3 阿司匹林对HTR-8/SVneo早孕滋养细胞活力的影响
CCK-8结果显示,0.5 μg/L TNF-α体外刺激HTR-8/SVneo细胞后,细胞活力显著低于对照组(P<0.05)。不同浓度aspirin处理后对细胞活力产生不同影响,与对照组相比,0.1 mmol/L aspirin处理组细胞活力显著增加,而 1和10 mmol/L aspirin处理组细胞活力显著下降(P<0.05);同样,与TNF-α单独处理组相比,不同浓度aspirin(0.1、1和10 mmol/L)与TNF-α共同处理细胞后,0.1 mmol/L Aspirin处理可显著提高细胞活力,而1和10 mmol/L aspirin处理不能明显提高细胞活力,见图3。我们认为小剂量阿司匹林对HTR-8/SVneo细胞起保护作用,于是在后续实验中选用0.1 mmol/L作为处理浓度。
4 阿司匹林对TNF-α刺激下HTR-8/SVneo细胞cyclin D1及PCNA表达的影响
Western blot结果显示,TNF-α处理细胞后,cyclin D1及PCNA蛋白表达水平显著低于对照组;然而,TNF-α+aspirin共同处理细胞后,cyclin D1及PCNA蛋白表达水平显著高于TNF-α组(P<0.05),见图4。

Figure 3. Effects of aspirin and TNF-α on HTR-8/SVneo cell viability. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
图3阿司匹林对TNF-α刺激下HTR-8/SVneo细胞活力的影响

Figure 4. Effects of aspirin and TNF-α oncyclin D1 and PCNA protein levels in HTR-8/SVneo cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
5 阿司匹林对TNF-α刺激下HTR-8/SVneo细胞侵袭能力的影响
Transwell侵袭试验结果显示,TNF-α组小室的穿膜细胞数明显低于对照组(P<0.05);TNF-α+aspirin组小室的穿膜细胞数明显高于TNF-α组(P<0.05),见图5。这表明TNF-α抑制滋养细胞侵袭,阿司匹林能逆转这一作用。
6 阿司匹林对TNF-α刺激下HTR-8/SVneo细胞MMP-2及MMP-9表达的影响
ELISA法检测细胞培养上清液中MMP-2及MMP-9表达水平,发现TNF-α处理细胞后,细胞培养上清液中MMP-2及MMP-9表达水平显著低于对照组(P<0.05);然而,TNF-α+aspirin共同处理细胞后,细胞培养上清液中MMP-2及MMP-9表达水平显著高于TNF-α组(P<0.05),见图6。
7 阿司匹林对TNF-α刺激下HTR-8/SVneo细胞MMP-2及MMP-9活性的影响
TNF-α处理细胞后,细胞培养上清液中MMP-2及MMP-9活性显著低于对照组(P<0.05);然而,TNF-α+aspirin共同处理细胞后,细胞培养上清液中MMP-2及MMP-9活性显著高于TNF-α组(P<0.05),见图7。

Figure 5. Effects of aspirin and TNF-α on HTR-8/SVneo cell invasion ability measured by Transwell assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
讨 论
PE是一种妊娠期特发性疾病,是围生期母婴死亡的主要原因之一,终止妊娠乃是唯一有效的治疗方式。正常妊娠10周时,胎盘绒毛外滋养细胞沿螺旋动脉逆行侵袭,逐渐取代血管内皮细胞,血管肌肉弹力层被纤维素样物质取代,致使管腔扩大、阻力降低、血流增加, 此过程为生理性螺旋动脉血管重铸。PE孕妇子宫螺旋动脉血管内滋养细胞的数量极少,导致滋养细胞对子宫螺旋动脉的重铸极其不足,引起管腔狭窄,胎盘发育不完善[15-16]。因此子宫螺旋动脉重铸障碍导致胎盘形成缺陷可能是PE发病的始动因素[2-3],而其实质是滋养细胞生理侵袭能力下降[4]。

Figure 6. Effects of aspirin and TNF-α on MMP-2 and MMP-9 levels in HTR-8/SVneo cell culture supernatants analyzed by ELISA. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
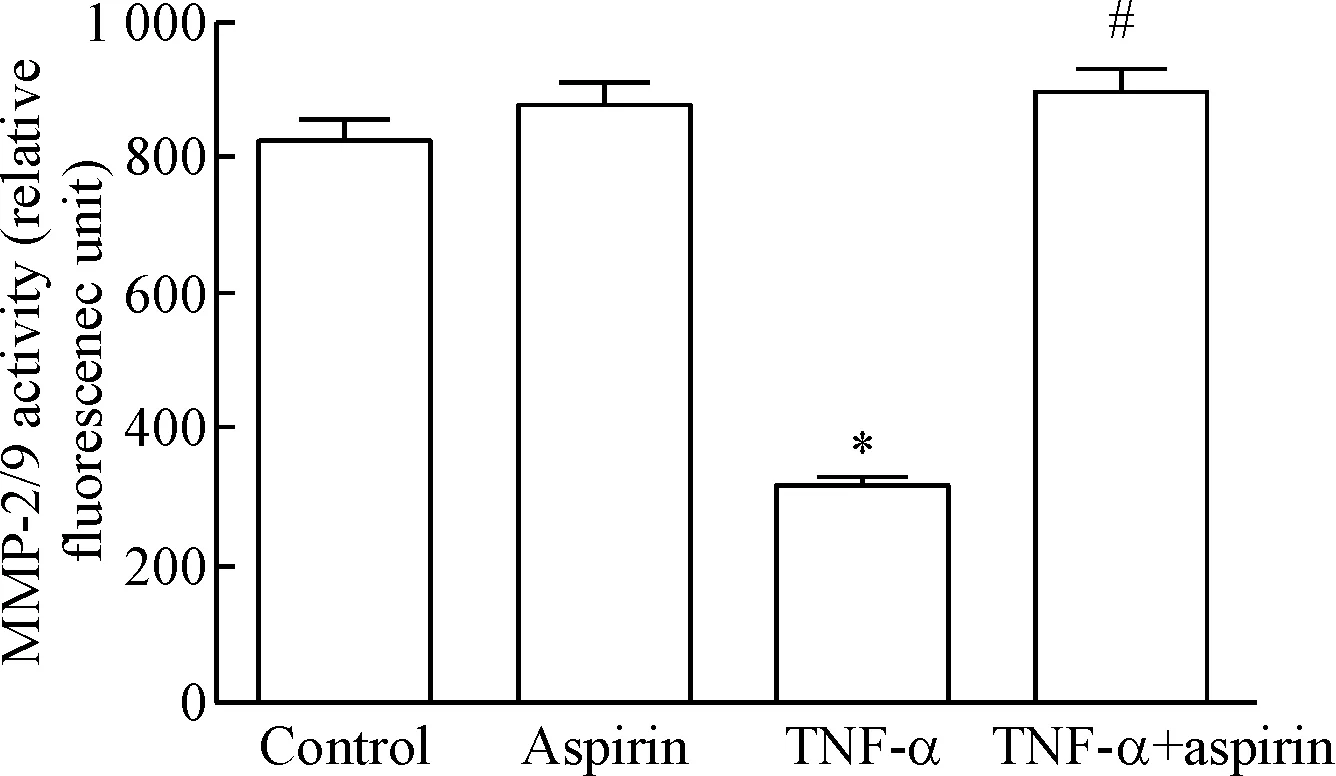
Figure 7. Effects of aspirin and TNF-α on MMP-2 and MMP-9 activity in HTR-8/SVneo cell culture supernatants analyzed by MMP-2/MMP-9 activity assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTNF-α group.
Roberge等[11]采用荟萃分析方法发现,对于有PE高危因素的孕妇从孕16周前开始口服小剂量阿司匹林直至孕34~36周,可明显降低早发型PE和胎儿宫内生长受限的发生率,然而超过孕16周后口服阿司匹林不能预防PE和胎儿宫内生长受限的发生。该流行病学研究结果中阿司匹林起预防作用的有效时间(孕16周前)与生理性螺旋动脉血管重铸完成的时间(孕13~18周)基本相符,因此猜测阿司匹林可能是通过改善滋养细胞的功能进而起到预防PE的作用。目前越来越多的学者认识到,PE是母亲对妊娠的一种过度炎症反应[17-18]。因此本实验中,我们利用TNF-α刺激HTR-8/SVneo细胞体外模拟PE炎症环境,探讨阿司匹林对绒毛滋养细胞增殖和侵袭的影响。
阿斯匹林为乙酰水杨酸类药物, 它作用于前列腺素合成过程中的第1个合成酶——环加氧酶, 使脂肪酸环加氧酶不可逆地乙酰化而失活,进而抑制PGI2和TXA2的合成,因此在临床上被广泛应用于抑制血小板聚集并阻止血栓形成[19]。近年来通过对阿司匹林的深入研究,学者发现阿司匹林不仅可以预防血栓形成,同时对细胞功能也有显著的影响。Cao等[20]以颅骨缺损的迷你猪为模型,发现阿司匹林局部给药可抑制TNF-α和干扰素的产生,进而提高啮齿类动物的颅骨修复,提示阿司匹林可促进骨髓基质干细胞的增殖和分化。Xu等[21]利用TNF-α体外刺激滋养细胞发现,阿司匹林可通过抑制PGF1α的表达进而增强滋养细胞取代内皮细胞血管重塑的能力。本研究采用CCK-8法检测细胞活性,发现小剂量(0.1 mmol/L)阿司匹林可促进HTR-8/SVneo细胞增殖,然而大剂量(1和10 mmol/L)阿司匹林可明显抑制细胞活性。研究表明,大剂量阿司匹林可抑制多种细胞生长增殖。Law等[22]证实阿司匹林可抑制P70核糖体蛋白S6激酶(p70S6K)活性,从而延长细胞周期,抑制角朊细胞Balb/MK生长。Goel等[23]发现阿司匹林可上调MMR蛋白表达,从而降低人结肠癌细胞SW480生长速率,抑制细胞增殖。
Cyclin D1是一个重要的细胞周期调控蛋白,通过结合细胞周期蛋白依赖性激酶4、磷酸化并失活视网膜母细胞瘤蛋白,在G1到S过渡的细胞周期进程中发挥着重要作用[24-25];PCNA存在于正常增殖细胞以及肿瘤细胞内, 与细胞DNA合成密切相关,对细胞增殖起着重要作用。本研究中,阿司匹林处理滋养细胞后,cyclin D1及PCNA蛋白表达明显增加,提示阿司匹林可促进滋养细胞增殖。另外,Transwell侵袭实验发现TNF-α+aspirin组滋养细胞侵袭能力较TNF-α组明显增加;ELISA法检测细胞培养上清液中MMP-2及MMP-9表达水平、MMP-2/MMP-9活性检测试剂盒检测MMP-2及MMP-9活性,发现TNF-α+aspirin组MMP-2及MMP-9表达水平及活性均较TNF-α组明显上升。这些结果提示阿司匹林可促进滋养细胞的侵袭能力,从而改善螺旋动脉重铸异常情况。
