MicroRNA-126通过靶向抑制EZH2增加胃癌SGC-7901细胞的放射敏感性
2018-08-27田晓刚张春林任锦霞赵凤菊杨文翠苟彩霞
田晓刚, 赵 林, 张春林, 任锦霞, 赵凤菊, 杨文翠, 苟彩霞
(甘肃省肿瘤医院放疗一病区, 甘肃 兰州 730050)
放射治疗(放疗)是现阶段肿瘤辅助治疗的重要手段之一,随着放疗技术不断进步,近年来肿瘤放疗的效果取得了一定的改善,但是胃癌患者大多对放射治疗不敏感,这一特点限制了放射治疗在胃癌中的应用[1-2]。为了减少胃癌放射治疗的应用局限、提高胃癌放射治疗的疗效,有必要进行胃癌细胞的放射增敏研究。微小RNA(microRNA,miRNA,miR)是一类长度为18~21 nt的非编码RNA,具有调控细胞生长和凋亡的作用。大量研究表明,肿瘤的发生发展过程伴随着miRNA的水平变化,并影响肿瘤的放疗或化疗效果[3-4]。前期研究中,我们发现miR-126在对放化综合治疗不敏感的患者胃癌组织中存在低表达,而提高胃癌SGC-7901细胞中的miR-126水平后,该细胞对放射治疗的敏感性增强[5]。生物信息学证据提示zeste基因增强子同源物2(enhancer ofzestehomolog 2,EZH2)基因是miR-126潜在的靶基因,且既往研究表明EZH2参与肿瘤细胞对放射治疗的敏感性[6]。因此,本研究假设miR-126可能通过靶向抑制EZH2在胃癌细胞中发挥放射增敏作用并设计实验加以验证。
材 料 和 方 法
1 主要试剂
TRIzol总RNA提取试剂盒购自Thermo Fisher Scientific; PrimeScript®RTase反转录试剂盒购自宝生物(大连)工程有限公司; TaqMan® MicroRNA反转录试剂盒购自Life Technologies; microRNA荧光定量 PCR 试剂盒购自生工生物工程(上海)股份有限公司; GoTaq®实时荧光定量qPCR 试剂盒、Dual-Glo®双萤光素酶报告基因检测试剂盒及相关报告质粒购自北京普洛麦格生物有限公司;所有引物、真核表达质粒、miRNA模拟序列及用于转染对照的无关序列均由上海吉玛生物有限公司设计合成; DMEM培养基、胎牛血清、胰酶和Lipofectamine系列转染试剂购自Thermo Fisher Scientific; CCK-8细胞活力检测试剂盒购自上海碧云天公司; Annexin V-FITC凋亡试剂盒购自Sigma;所有 I 抗及 II 抗购自Abcam; ECL超敏发光液购自北京普利莱基因技术有限公司。
2 方法
2.1细胞培养 胃癌SGC-7901细胞系购自中国科学院上海细胞生物学研究所细胞库。细胞培养于含有10%胎牛血清的DMEM培养基,细胞消化使用0.25%胰酶,培养条件为37℃、 5%CO2湿度恒定的细胞培养箱。取对数生长期细胞进行实验。
2.2细胞转染 通过转染miR-126 模拟序列(miR-126 mimic, 5’-UCGUACCGUGAGUAAUAAUGCG-3’)使SGC-7901细胞中miR-126过表达。通过转染EZH2真核表达质粒pcDNA3.1-EZH2使SGC-7901细胞中EZH2过表达。miR-126 mimic的转染采用Lipofectamine® RNAiMAX转染试剂,同时转染miRNA阴性对照序列(miRNA negative control, miR-NC)作为阴性转染对照。真核表达质粒pcDNA3.1-EZH2的转染使用Lipofectamine®2000转染试剂,同时转染pcDNA3.1空质粒作为阴性转染对照。具体转染方案参考转染试剂厂商提供的说明书。
2.3RT-qPCR TRIzol试剂提取细胞中的总RNA样本,提取的RNA样本经定量和纯度检测后(A260/A280值位于1.8~2.0间)用于反转录。为进行miR-126的检测,RNA反转录采用TaqMan® MicroRNA反转录试剂试剂盒进行以合成cDNA,合成的cDNA采用miRNA荧光定量 PCR 试剂盒进行扩增定量。为进行EZH2的mRNA检测,RNA的反转录采用PrimeScript®RTase反转录试剂盒以合成cDNA,合成的cDNA采用GoTaq®实时荧光定量 qPCR 试剂盒进行扩增定量。所有PCR反应条件参考厂商提供的说明书。miR-126的定量采用小核仁RNA 48 (small nucleolar RNA 48, SNORD48)作为内参照,EZH2的mRNA定量采用GAPDH作为内参照。目的基因的相对表达水平采用2-ΔΔCt法计算。miR-126上游引物序列为5’-CAGTGCGTGTCGTGGAGT-3’,下游采用通用引物,序列为5’-GTGCAGGGTCCGAGGT-3’。SNORD48上游引物序列为5’-GAGTGATGATGACCCCAGGTAA-3’,下游采用通用引物,序列同上。EZH2的上游引物序列为5’-TTTCCAACACAAGTCATCCC-3’,下游引物序列为5’-AACCCACATTCTCTATCCCC-3’。GAPDH上游引物序列为5’-TATAAATTGAGCCCGCAGCC-3’,下游引物序列为5’-TACGACCAAATCCGTTGACTC-3’。
2.4Werstern blot实验 含有蛋白酶抑制剂的RIPA蛋白裂解液裂解细胞,收集总蛋白样品并与上样缓冲液混合后煮沸,电泳使用12% SDS-PAGE进行分离,每孔上样量25 μg,120 V恒压电泳。转膜采用PVDF膜,转膜电压90 V,持续1.5 h。转膜结束后,使用5%脱脂奶粉室温封闭PVDF膜1 h。封闭后,膜分别使用兔抗人EZH2多克隆抗体(1∶500)及兔抗人GAPDH多克隆抗体(1∶5 000)4℃孵育过夜。接着使用PBST洗涤3次,除去未结合的 I 抗;辣根过氧化物酶标记的 II 抗稀释后(1∶1 000)与膜接触,室温下孵育1~2 h,ECL超敏发光液显色并分析条带。
2.5双萤光素酶报告基因实验 为明确miR-126与EZH2 mRNA的直接靶向关系,分别设计合成含有miR-126结合位点的野生型及突变型的EZH2 mRNA 3’端非翻译区(untranslated region,UTR)序列并克隆至psiCHECK2报告基因质粒,分别命名为psiCHECK2-EZH2-WT及psiCHECK2-EZH2-MUT。将报告基因质粒分别与miR-126 mimic和miR-NC共转染细胞。将转染后的各组细胞以每孔1×105的密度种植于96孔板,继续培养48 h,采用Dual-Glo®双萤光素酶报告基因检测系统分析并计算萤火虫萤光素与海肾萤光素发光强度的比值。
2.6照射处理及分组方式 细胞接受照射前,按下述分组方案进行不同转染处理。根据细胞转染方案的区别将细胞分为如下4组:转染miR-126 模拟序列+转染pcDNA3.1空质粒(miR-126 mimic+pcDNA3.1)组;转染miR-126 模拟序列+转染pcDNA3.1-EZH2表达质粒(miR-126 mimic+pcDNA3.1-EZH2)组;转染microRNA模拟物阴性对照序列+转染-EZH2表达质粒(miR-NC+pcDNA3.1-EZH2)组;转染miRNA模拟物阴性对照序列+转染pcDNA3.1空质粒(miR-NC+pcDNA3.1)组。完成转染48 h后,对各种转染组合的细胞进行射线照射,照射时培养皿覆盖2 cm厚有机玻璃板,源皮距设置为100 cm,剂量率为3.2 Gy/min,总剂量为4.0 Gy。
2.7平板集落形成实验检测各组细胞的放射生物学参数 各组细胞分别接受于0、 2、4及8 Gy剂量的照射,照射后的细胞接种于6孔板。接种数量通过照射剂量决定, 0、 2、4及8 Gy剂量对应的接种数分别为每孔200、 500、2 000及20 000个细胞。培养2周后,使用吉姆萨染色估计集落的形成情况,按公式计算集落形成率。集落形成率(%)=0 Gy培养皿中的集落数/0 Gy细胞培养皿中的细胞接种数×100%。按公式计算细胞存活分数(survival fraction,SF)。SF=某剂量照射后的培养皿内的集落数/(该剂量的接种数×集落形成率)。根据多靶单击模型计算各组平均致死量(D0)、2 Gy剂量下对应的SF值(SF2)和放射增敏比(sensitivity enhancement ratio,SER)。SER=(其它组的D0)/(miR-NC+pcDNA3.1组的D0)。
2.8CCK-8法检测细胞活力 各组细胞以每孔3×104的密度种植于12孔板。使用CCK-8细胞活力检测试剂盒检测细胞的活力变化。检测时点为照射后24 h及48 h。检测方案参考试剂盒说明书。根据公式计算各组细胞的相对抑制率。48 h相对抑制率(%)=1-(48 h细胞活力值-空白值)/(24 h细胞活力值-空白值)。
2.9流式细胞术检测细胞凋亡 常规消化各组细胞,制备细胞悬液,并使用Annexin V-FITC凋亡试剂盒进行染色,避光孵育30 min上机检测并计算凋亡率。
3 统计学处理
采用SPSS 17.0软件进行数据处理和统计分析。数据以均数±标准差(mean±SD)表示。两组间差异的比较使用t检验,多组间的比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 上调胃癌SGC-7901细胞中miR-126可以靶向抑制EZH2的表达
如图1 所示,转染miR-126模拟序列可以有效上调SGC-7901细胞中的miR-126表达(P<0.05)。与阴性转染对照相比,上调miR-126后,细胞中EZH2的mRNA及蛋白水平均显著降低,差异有统计学意义(P<0.05),见图2、3。
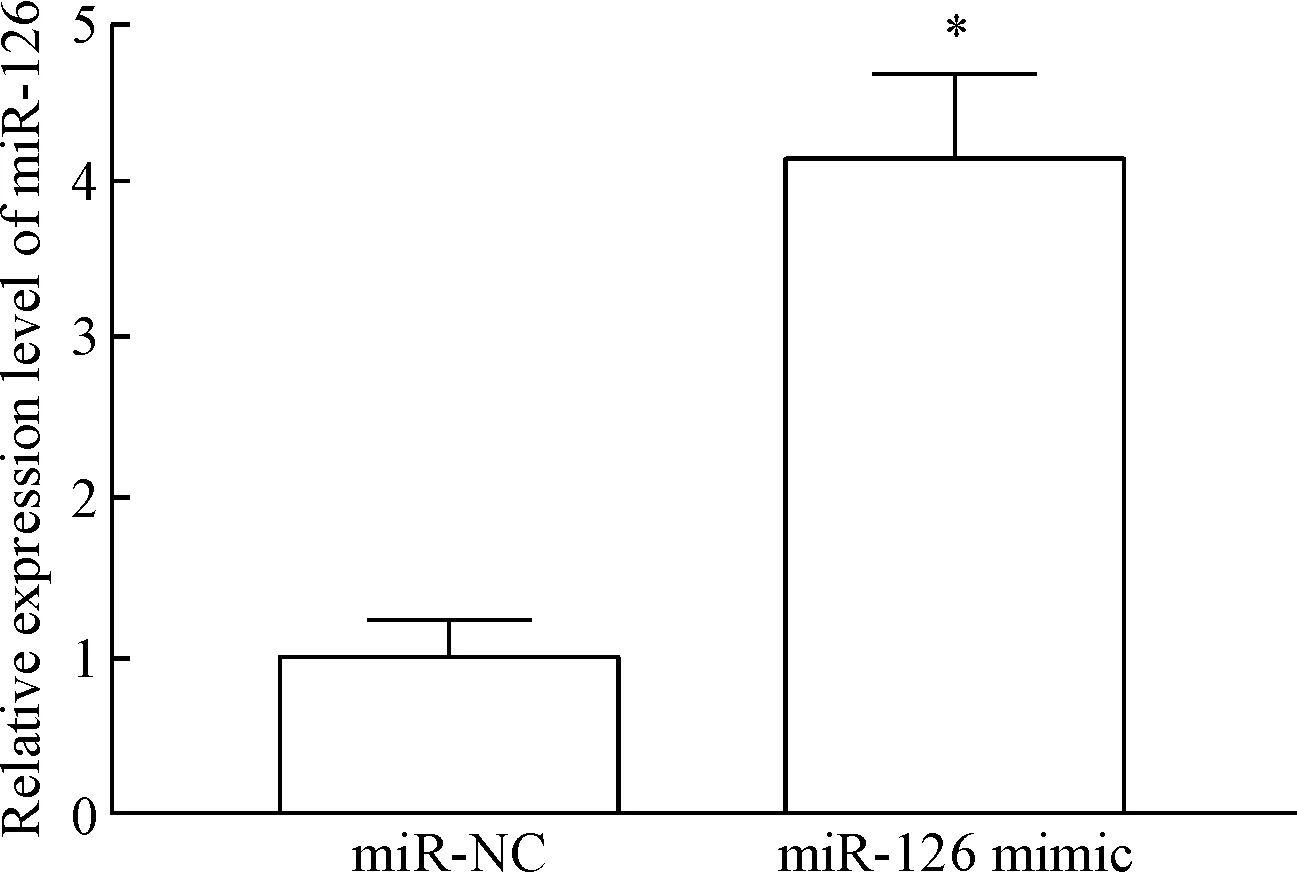
Figure 1. The expression level of miR-126 in the SGC-7901 cells after miR-126 mimic transfection. Mean±SD.n=3.*P<0.05vsmiR-NC group.
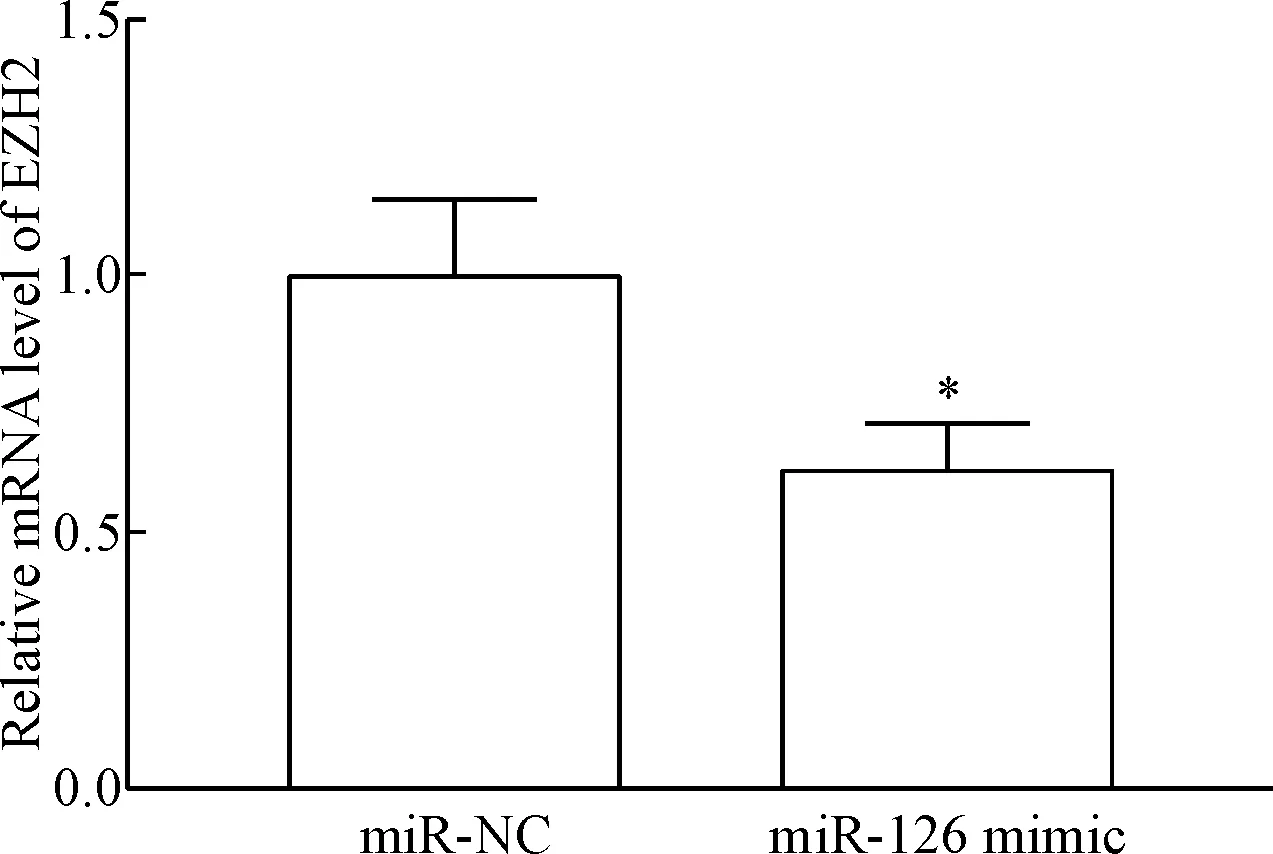
Figure 2. The mRNA level of EZH2 in the SGC-7901 after miR-126 mimic transfection. Mean±SD.n=3.*P<0.05vsmiR-NC group.
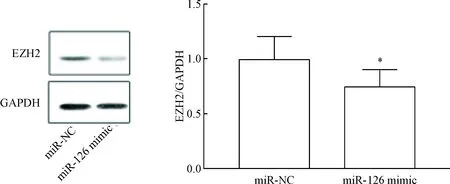
Figure 3. The protein level of EZH2 in the SGC-7901 cells after miR-126 mimic transfection. Mean±SD.n=3.*P<0.05vsmiR-NC group.
双萤光素酶报告基因实验发现,含有EZH2野生型3’UTR 序列的报告基因质粒与miR-126 mimic共转染后,萤光素酶相对活性降低,明显低于与miR-NC共转染的细胞(P<0.05);而含有EZH2突变型3’UTR 序列的报告基因质粒无论与miR-126 mimic还是miR-NC共转染,萤光素酶的相对活性均无显著变化。这些证据表明在胃癌SGC-7901细胞中miR-126可以直接结合EZH2 3’UTR的形式靶向抑制EZH2的表达,见图4。

Figure 4. The relative luciferase activity of SGC-7901 cells in each group detected by dual-luciferase reporter assay. Mean±SD.n=3.*P<0.05vsmiR-NC group.
2 miR-126增加胃癌SGC-7901细胞放射敏感性的作用与EZH2部分介导有关
集落形成实验发现在上调miR-126水平增加的同时上调EZH2水平,会削弱miR-126的放射增敏作用,见图5。在放射学参数方面,转染miR-126 mimic+pcDNA3.1-EZH2的SF2值及D0值均大于转染miR-126 mimic+pcDNA3.1的细胞(P<0.05),其SER小于转染miR-126 mimic+pcDNA3.1的细胞(P<0.05),但仍高于其它2组细胞(P<0.05),提示EZH2部分逆转了miR-126的放射增敏效果,见表1。在细胞活力实验中,转染miR-126 mimic+pcDNA3.1-EZH2的细胞在经过照射后生长抑制率低于转染miR-126 mimic+pcDNA3.1的细胞(P<0.05),但仍高于其它2组细胞(P<0.05),见图6。细胞凋亡分析结果可见,转染miR-126 mimic+pcDNA3.1-EZH2的细胞在经过照射后凋亡率低于转染miR-126 mimic+pcDNA3.1的细胞(P<0.05),但仍高于其它2组细胞(P<0.05),见图7。仅上调EZH2的细胞(miR-NC+pcDNA3.1-EZH2组)与阴性转染对照细胞(miR-NC+pcDNA3.1组)相比,照射后的细胞活力及凋亡率差异无统计学显著性。这些证据提示miR-126增强胃癌SGC-7901细胞放射敏感性的作用与EZH2有关,但这种关系只是部分的。
讨 论
大多数肿瘤细胞都存在一定的放射耐受现象,临床上放射野内的肿瘤出现复发的现象依旧存在[7-8]。胃癌的病理分型以腺癌为主,而腺癌对放射线相对不敏感,加之胃周围邻近的重要器官等对放射线耐受性较低,容易引起放射损伤[9]。故单纯依靠加大放射剂量取得效果的方式并不可取。这种情况下,需要研究新的放射增敏手段,以提高胃癌细胞对放射的敏感性。
miRNA为短链非编码RNA,通过与靶基因特定区域的结合可以降解靶基因,从而使靶基因的表达降低,实现转录后调控作用。通过这种调控作用miRNA可与靶基因形成复杂的调控网络,从而影响细胞生长的调节[10]。由于miRNA可以调控肿瘤细胞的DNA修复、周期以及凋亡等与放射敏感性相关的重要生物学环节,越来越多的研究开始关注miRNA与肿瘤细胞放射敏感性的关系。有研究指出,食管癌细胞的放射抵抗现象可能由miR-21引起,抑制miR-21后食管癌细胞的放射敏感性得到增强[11]。本研究关注的miR-126已经被证实与多种肿瘤相关,目前研究倾向于认为miR-126不足与肿瘤的发生发展有关。有研究发现miR-126在胃癌组织中存在低表达,与胃癌的远端转移及侵袭相关[12]。但是较少有研究探讨miR-126与肿瘤放射敏感性的关系,尚未见到关于胃癌的相关报道。本课题组在前期研究中对miR-126与胃癌细胞对放射敏感性的关系进行了探讨。前期研究中,我们发现与对放疗较为敏感的胃癌患者相比,对放疗不敏感的患者miR-126水平较低;进一步的体外细胞实验证实,miR-126确实能增加胃癌细胞的放射敏感性;但是在之前的研 究中,我们没能揭示其机制[5]。本研究在原有研究的基础上,对miR-126增强胃癌细胞放射敏感性的机制进行了探讨。我们认为miR-126必然通过其靶基因发挥作用,因此采用生物信息学手段对miR-126的靶基因进行了预测,并对这些靶基因进行了基因注释分析及KEGG信号通路分析,据此选取了部分与肿瘤及肿瘤细胞周期、凋亡相关的靶基因。结合文献报道,最终在众多靶基因中选择了EZH2作为研究对象。
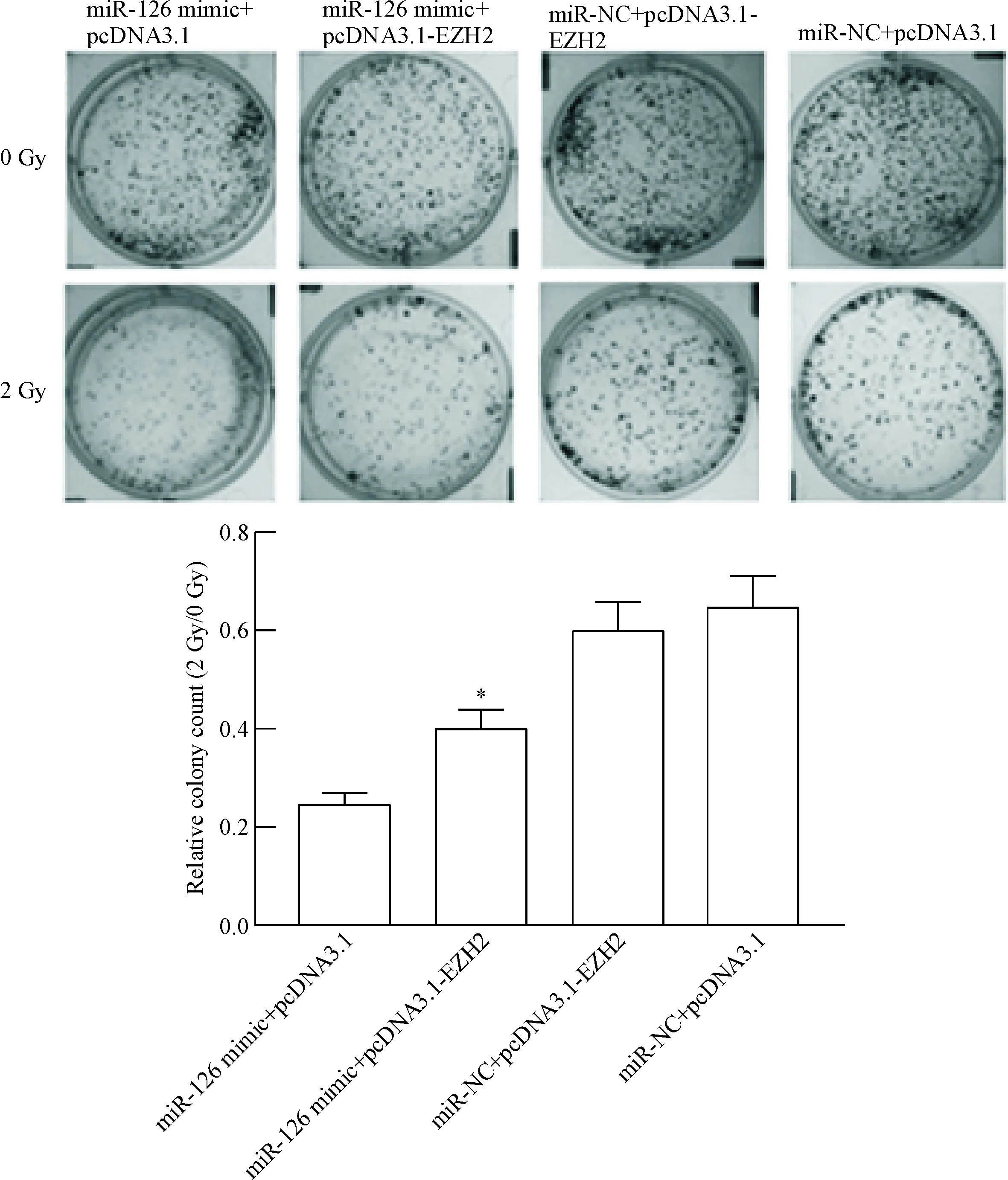
Figure 5. The colony formation ability of the SGC-7901 cells in each group after 2 Gy radiation. Mean±SD.n=3.*P<0.05vsother groups.
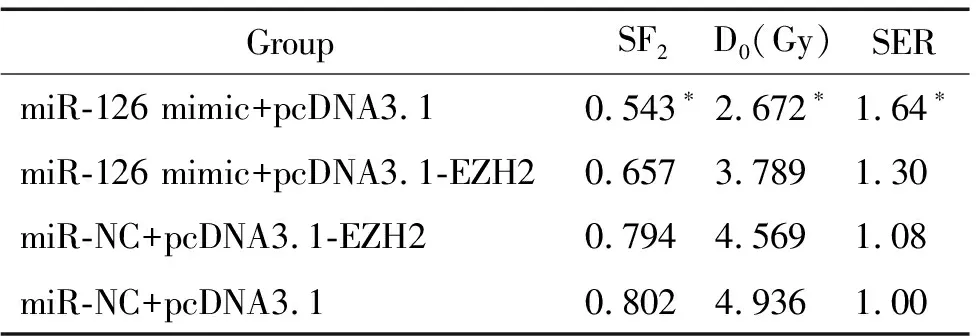
表1 各组SGC-7901细胞的放射生物学参数的比较
*P<0.05vsother groups.

Figure 6. The changes of the viability of the SGC-7901 cells with different transfection objects after radiation. Mean±SD.n=3.*P<0.05vsother groups.
EZH2为多梳蛋白家族的主要成员之一,是组蛋白H3第 27 位赖氨酸(H3K27)的特异性甲基化转移酶,参与组蛋白H3的甲基化调控,对基因沉默和转录抑制发挥重要作用[13]。大量研究证实,EZH2与肿瘤细胞的发生发展有关,张笑添等[14]发现胃癌中miR-101可以通过抑制EZH2减少胃癌细胞的增殖。更重要的是EZH2与肿瘤细胞的异常增殖、凋亡减少及周期异常的关系特别密切,因此,EZH2常常介导肿瘤的治疗耐受。如有研究指出EZH2参与卵巢癌、非小细胞肺癌的顺铂耐药,抑制EZH2后,这些肿瘤细胞对顺铂的敏感性均得到提高[15]。在T淋巴细胞瘤中,抑制EZH2可增加肿瘤细胞的放射敏感性[16]。基于EZH2的这种特性,我们假设miR-126增强胃癌放射敏感性的作用可能是通过对EZH2的靶向抑制实现的。为证明此假设,我们首先在胃癌SG-7901细胞中验证了miR-126对EZH2的靶向抑制作用,通过上调细胞的miR-126我们观察到了EZH2的明显抑制。双萤光素酶报告基因实验也提示,miR-126可与EZH2的mRNA 3’UTR区域结合。因此我们认为在胃癌SG-7901细胞中,miR-126可以靶向抑制EZH2的表达。我们进一步通过一定的转染组合及随后的细胞活性、细胞凋亡分析发现,EZH2的过表达可以削弱miR-126的放射增敏作用,但是这种削弱是部分的,因为相对阴性转染对照细胞,即使过表达EZH2,miR-126过表达的细胞仍然对放射较为敏感。这表明miR-126确实通过抑制EZH2来增加胃癌细胞对射线的敏感,但不是仅通过EZH2,必定有其它miR-126的靶基因参与此过程,这值得在后续研究中去探讨。另外,我们发现,在单纯上调EZH2的情况下,细胞的放射敏感性并没有降低,这说明在SGC-7901细胞中EZH2的作用可能已经饱和,故即使过表达EZH2也无法诱导进一步的放射抵抗。

Figure 7. The apoptotic rates in the SGC-7901 cells with diffe-rent transfection objects after radiation. Mean±SD.n=3.*P<0.05vsother groups.
总之,本研究初步证实miR-126可通过EZH2的靶向抑制而增强胃癌细胞放射敏感性。
