腺苷A1受体介导参麦注射液对肢体缺血再灌注损伤大鼠海马组织的保护作用*
2018-08-25何海娟杨燕青戴勤学
何海娟 杨燕青 戴勤学
[1.台州恩泽医疗中心(集团)恩泽医院,浙江 台州 318000;2.台州恩泽医疗中心(集团)浙江省台州医院,浙江 台州 318000;3.温州医科大学附属第一医院,浙江 温州 325000]
【目的】 观察腺苷A1受体是否介导参麦注射液对肢体缺血再灌注损伤大鼠的脑保护作用。方法 60只大鼠随机分为对照组、模型组、参麦注射液组、参麦注射液+腺苷A1受体拮抗剂组、溶剂对照组。采用双侧股动脉夹闭的方法建立大鼠肢体缺血再灌注损伤模型,对照组大鼠不夹闭股动脉,其他操作同造模大鼠。参麦注射液组大鼠在造模后即刻腹腔注射参麦注射液,模型组大鼠在造模后即刻腹腔注射等量0.9%氯化钠注射液,参麦注射液+腺苷A1受体拮抗剂组大鼠在造模前30 min腹腔注射腺苷A1受体拮抗剂,造模后即刻腹腔注射参麦注射液。溶剂对照组大鼠只在造模前30 min注射二甲亚砜。大鼠肢体缺血再灌注48 h后处死,观察海马组织的脑水含量,采用尼氏染色观察大鼠海马CA1区神经元损伤情况,采用Western blot法观察大鼠海马组织中Bcl-2和Bax蛋白表达量。结果 与对照组比较,模型组大鼠的海马组织脑水含量明显增高 (P<0.05),Bcl-2/Bax比率明显减小,海马CA1区正常细胞数量明显减少(P<0.05)。与模型组比较,参麦注射液组大鼠海马组织脑水含量明显减少(P<0.05),海马CA1区正常细胞数量明显增多,Bcl-2/Bax比率明显升高(P<0.05)。与参麦注射液组比较,参麦注射液+腺苷A1受体拮抗剂组大鼠海马组织脑水含量明显增加,Bcl-2/Bax比率明显降低,海马CA1区正常细胞数量明显减少(P<0.05)。结论 参麦注射液对肢体缺血再灌注损伤大鼠海马组织具有保护作用;腺苷A1受体可能介导了参麦注射液对肢体缺血再灌注损伤大鼠海马组织的保护作用。
肢体缺血再灌注损伤在临床上是一个常见的病理生理过程,比如肢体血管再通、断肢再植等[1]。当肢体血流恢复时,其不仅仅引起肢体骨骼肌缺血性损伤,还可以通过全身炎症反应影响到远端脏器的损伤,比如肺、脑、肾等重要器官损伤[2]。目前研究者的关注热点逐渐转移到远端脏器损伤的保护。有研究表明大鼠肢体发生缺血再灌注损伤时,可以引起海马组织损伤,诱发大鼠认知功能障碍[3]。腺苷A1受体是一种抑制型G蛋白偶联受体,通过配体腺苷激活后可以减少释放兴奋性氨基酸,从而达到神经保护的作用[4]。参麦注射液是临床常用的一种药物,中医理论认为参麦注射液具有益气养阴之功效,其有效成分为麦冬皂苷、人参皂苷、麦冬黄酮、麦冬多糖和人参多糖[5]。课题组前期研究表明参麦注射液对脑缺血再灌注损伤大鼠具有神经保护的作用[6],也有研究表明参麦注射液能改善肢体缺血再灌注损伤过程的肺脂质过氧化损伤,从而减少肺脏的损伤[7],但是其具体的机制并没有被完全阐明。因此,本研究探讨腺苷A1受体是否介导了参麦注射液对肢体缺血再灌注损伤大鼠海马组织的保护作用。现报告如下。
1 材料与方法
1.1 实验动物 健康雄性SPF级Sprague Dawley大鼠 60只,体质量(220±20)g,由上海斯莱克实验动物公司提供,许可证号码:SCXK(沪)2015-0035。于造模前72 h购买并饲养于SPF级动物房中。手术前1 d禁食,但不禁水。
1.2 试药与仪器 参麦注射液(正大青春宝药业有限司);A1R拮抗剂腺苷受体阻断剂(1,3-dipropyl-8-cyclopentylxanthine,DPCPX,批号:2016YE356678)、二甲基亚砜(DMSO,美国 Sigma公司,批号:2013YE246396);Bcl-2抗体 (美国Bioworld Technology公司,批号:SY20134321);Bax抗体(美国abcam 公司,批号:ab53154);酶标仪(DENLEY DRAGON Wellscan MK3,Thermo,芬兰);BX60 显微镜(Olympus)。
1.3 给药方法 参麦注射液组大鼠在造模后即刻腹腔注射参麦注射液15 mL/kg[9],模型组大鼠在造模后即刻腹腔注射等量0.9%氯化钠注射液。将腺苷A1受体拮抗剂用DMSO溶剂溶解成1 mg/mL,参麦注射液+腺苷A1受体拮抗剂组大鼠在造模前30 min腹腔注射腺苷A1受体拮抗剂1 mg/kg,造模后即刻腹腔注射参麦注射液15 mL/kg。溶剂对照组大鼠仅在造模前30 min注射DMSO溶剂1 mL/kg。
1.4 标本采集与检测 1)尼氏染色。每组取6只大鼠麻醉后处死,剪开胸腔,用4%多聚甲醛经心脏进行灌注,直至大鼠全身僵硬,取出脑组织,放置4%多聚甲醛溶液浸泡过夜后,按常规方法制备石蜡组织切片。将备好的组织切片用甲酚紫染色液(尼氏染色液)对切片进行染色10 min,用蒸馏水冲洗干净;在显微镜下用分化液进行分化,直至背景色接近无色;酒精脱水,二甲苯透明,树胶封片。海马CA1区锥体层正常神经元细胞数在400倍光镜下计数。对照组大鼠海马神经元中的圆形神经元认为是正常细胞。2)脑水含量测定。大鼠麻醉后处死,断头,在冰面上取出双侧海马组织,其中一侧放入液氮中准备进行Western bolting检测。另一侧海马组织用滤纸吸干,称重并记录湿重,后置于60℃恒温箱48 h烤干称干重,求得脑水含量(%)=(湿重-干重)/湿重×100%。3)Western bolting法检测 Bcl-2/Bax比率。海马组织总蛋白的提取采用细胞蛋白提取试剂盒(Thermo公司,美国),按照说明书的步骤操作。等量样品经聚偏二氟乙烯膜分离蛋白转移至NC膜上,转移后的NC膜经BSA孵育1 h,再封闭后,分别加入兔抗大鼠Bcl-2或Bax单克隆抗体 (Santa Cruz公司,美国),4℃孵育并过夜。室温下摇床冲洗,再孵育二抗(山羊抗兔),并化学发光,显影、成像。β-actin作为内参对照。应用Alphaimager 2200凝胶图像处理系统分析目的蛋白。蛋白表达水平用目的蛋白条带光密度值与β-actin条带光密度值的比值来表示。Bcl-2/Bax比率=Bcl-2蛋白表达水平/Bax蛋白表达水平。
1.5 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,组间比较均采用单因素方差分析,若方差不齐采用Tamhane检验进行两两比较;若方差齐采用LSD检验进行两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠海马组织脑水含量比较 见表1。与空白对照组比较,模型组大鼠的海马组织脑水含量明显增高(P<0.05),与模型组比较,参麦注射液组大鼠海马组织脑水含量明显减少(P<0.05),与参麦注射液组比较,参麦注射液+腺苷A1受体拮抗剂组大鼠海马组织脑水含量明显增加(P<0.05)。溶剂对照组与模型组比较差异无统计学意义(P>0.05)。
2.2 各组大鼠海马CA1区正常神经元计数比较 见表1,图1。采用尼氏染色的方法标记海马CA1区正常神经元。可见模型组大鼠海马CA1区神经元胞体明显缩小,胞浆内尼氏体少而小,呈颗粒状,细胞周围出现水肿裂隙。参麦注射液组大鼠海马CA1区神经元损伤程度较模型组大鼠明显好转。参麦注射液+腺苷A1受体A1拮抗剂组大鼠海马CA1区神经元损伤程度较参麦注射液组大鼠严重。与空白对照组比较,模型组大鼠海马CA1区正常神经元计数明显减少(P<0.05),与模型组比较,参麦注射液组大鼠海马CA1区正常神经元计数明显增多(P<0.05),与参麦注射液组比较,参麦注射液+腺苷A1受体拮抗剂组大鼠海马CA1区正常神经元计数明显减少(P<0.05)。溶剂对照组与模型组比较差异无统计学意义(P>0.05)。
2.3 各组大鼠海马组织Bcl-2/Bax比率比较 见表1,图2。与空白对照组比较,模型组大鼠海马组织Bcl-2/Bax比率明显减小(P<0.05),与模型组比较,参麦注射液组大鼠海马组织Bcl-2/Bax比率明显增大(P<0.05),与参麦注射液组比较,参麦注射液+腺苷A1受体拮抗剂组大鼠海马组织Bcl-2/Bax比率明显减小(P<0.05)。溶剂对照组与模型组比较差异无统计学意义(P>0.05)。
表1 各组大鼠海马组织脑水含量、正常神经元计数、Bcl-2/Bax比率比较(±s)
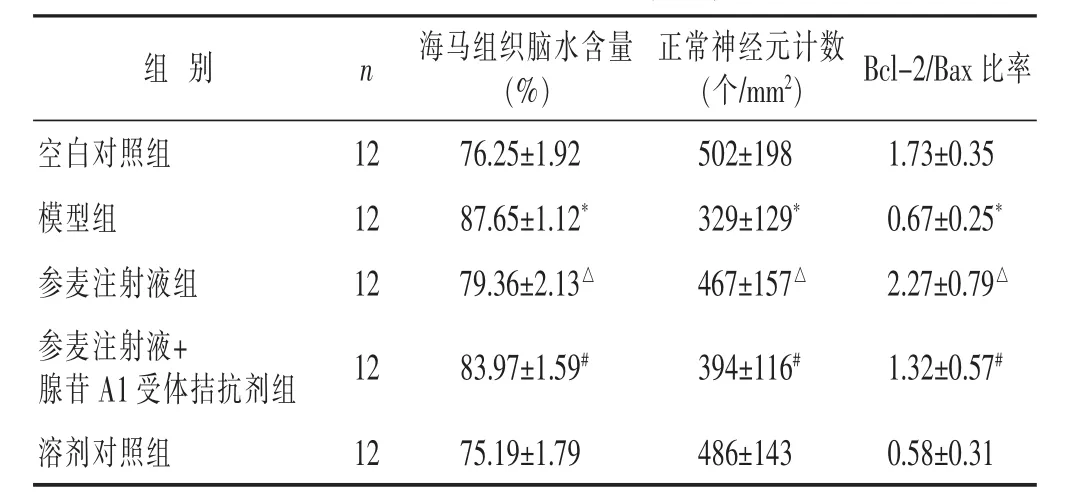
表1 各组大鼠海马组织脑水含量、正常神经元计数、Bcl-2/Bax比率比较(±s)
与对照组比较,*P<0.05;与模型组比较,△P<0.05,与参麦注射液组比较,#P<0.05
组 别 n Bcl-2/Bax比率海马组织脑水含量(%)空白对照组 12 1.73±0.35模型组 12 0.67±0.25*参麦注射液组 12 2.27±0.79△正常神经元计数(个/mm2)76.25±1.92 502±198 87.65±1.12* 329±129*79.36±2.13△ 467±157△参麦注射液+腺苷A1受体拮抗剂组 12 1.32±0.57#83.97±1.59# 394±116#溶剂对照组 12 75.19±1.79 486±143 0.58±0.31

图1 各组大鼠海马CA1区尼氏染色图

图2 各组大鼠海马组织Bcl-2/Bax蛋白表达量
3 讨 论
肢体缺血再灌注损伤可以引起远端重要脏器损伤,从而诱发多器官功能障碍,最终导致死亡[10]。因此预防肢体缺血再灌注损伤诱发的远端脏器损伤显得十分重要。目前在临床上,参麦注射液已经广泛运用于围手术期患者的器官保护[11],但是其具体的机制并不明确。故本文以肢体缺血再灌注损伤大鼠为模型,以参麦注射液为干预手段,以大鼠海马组织CA1组织形态学、脑水含量、Bcl-2/Bax比率为观察指标,以腺苷A1受体为研究切入点,从机制上阐明腺苷A1受体介导参麦注射液对大鼠肢体缺血再灌注损伤诱发脑损伤的保护作用。
在本实验中,笔者发现肢体缺血再灌注损伤可以引起大鼠海马组织CA1区正常神经元计数明显较对照组减少,海马组织脑水含量明显高于对照组,Bcl-2/Bax比率明显低于对照组,说明肢体缺血再灌注损伤确实可以诱发大鼠海马组织的损伤,这与先前的研究结果相一致。参麦注射液注组大鼠海马组织CA1区正常神经元计数明显较模型组增多,海马组织脑水含量明显低于模型组,Bcl-2/Bax比率明显高于模型组,说明参麦注射液可以缓解肢体缺血再灌注损伤诱发的脑损伤。而参麦注射液+腺苷A1受体拮抗剂组大鼠的海马组织脑水含量明显较参麦注射液组增加,海马CA1区正常神经元计数明显少于参麦注射液组,Bcl-2/Bax比率明显低于参麦注射液组,说明腺苷A1受体拮抗剂能够部分逆转参麦注射液对肢体缺血再灌注损伤大鼠的脑保护作用。溶剂对照组与模型组比较,海马组织CA1区正常神经元计数、海马组织脑水含量和Bcl-2/Bax比率差异均无统计学意义,说明DMSO溶剂本身并不会对实验结果造成影响。
有研究表明大鼠肢体缺血再灌注后脑组织中Bcl-2蛋白表达减少而Bax蛋白表达增加,我们的研究结果与其相一致。有研究认为,Bcl-2和Bax蛋白调节细胞的程序性死亡,不但取决于自身表达量的高低,还与其两者的比值相关。当Bcl-2蛋白表达增加时,则抑制细胞凋亡,当Bax蛋白表达增加时,则加快细胞凋亡[12]。故本实验采用Bcl-2/Bax比率来评价海马组织的损伤程度。
另有研究表明,参麦注射液可以增加脑组织中三磷酸腺苷(ATP)水平[6],而 ATP 可以通过酶降解生成腺苷[13]。腺苷是中枢神经系统的一种重要的神经调质[13]。腺苷受体分为A1、A2a、A2b、A3受体,其中与脑保护最为密切相关的是腺苷A1受体[4]。在中枢神经系统中,腺苷A1受体密集分布在海马、小脑、上丘、皮质中。已有大量的研究表明腺苷A1受体对脑缺血性损伤具有神经保护作用,其机制为抗炎、抗氧自由基形成、抗凋亡等[14]。因此,我们推测参麦注射液可以通过提高海马组织中的腺苷水平,进而激动腺苷A1受体达到脑保护的作用。
肢体缺血再灌注损伤诱发远端脏器损伤的机制十分复杂,目前认为炎症反应在此起了重要作用,肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)在其中起了重要作用[15]。进一步实验将会观察海马组织中的TNF-α和IL-1β,从更深一层机制中阐明参麦注射液对肢体缺血再灌注损伤的脑保护作用。
综上所述,参麦注射液可以缓解大鼠肢体缺血再灌注损伤诱发的海马组织损伤,而腺苷A1受体拮抗剂能够部分逆转该效应。因此,腺苷A1受体可能部分介导了参麦注射液对肢体缺血再灌注损伤大鼠海马组织的保护作用。
