系统性红斑狼疮患者外周血单个核细胞中RSAD2表达及意义
2018-08-23曲婧格王也李熙萌聂英坤
曲婧格,王也,李熙萌,聂英坤
(哈尔滨医科大学附属第二医院,哈尔滨150086)
系统性红斑狼疮(SLE)是一种可能致命并伴有多系统损害的自身免疫疾病,以产生大量自身抗体为特征,并通过抗原抗体免疫复合物沉积导致组织损伤,但确切的发病机制尚不明确。干扰素(IFN)是一种可以干扰病毒复制或传播的生物性蛋白质,包括Ⅰ型(IFN-α、 IFN-β等)、Ⅱ型(IFN-γ)及Ⅲ型(IFN-λ)三种类型[1]。近年研究表明,Ⅰ型IFN在SLE发病机制中起关键作用,IFN诱导基因如淋巴细胞抗原6复合体(LY6E)、IFN诱导蛋白1(IFIT1)在SLE患者PBMCs中显著升高,并与其疾病活动度有一定的相关性[2,3]。但在同样能被IFN诱导上调的系列基因中,S-腺苷甲硫氨酸基区域蛋白2(RSAD2)在SLE患者中的表达情况却鲜有报道。2017年10月~2018年2月,我们对SLE患者外周血单个核细胞(PBMCs)内RSAD2的表达进行检测,探讨其与SLE患者疾病活动度和免疫指标的相关性。
1 资料与方法
1.1 临床资料 选择同期在我院就诊的SLE患者46例作为SLE组,其中男3例、女43例,年龄11~69(45.56±15.35)岁。SLEDAI积分[5](5.9±3.9)分,其中高疾病活动度(SLEDAI积分≥6分)25例、低疾病活动度(SLEDAI积分<6分)21例。纳入标准:符合1997年美国风湿病学会(ACR)制定的SLE分类诊断标准[4];外周血血清抗核抗体(ANA)、抗小核糖核蛋白(nRNP)抗体、抗Sm抗体、抗核小体抗体及抗Ro-52抗体、抗双链DNA(dsDNA)抗体、补体C3、补体C4资料完整。排除标准:并发淋巴增生性或除SLE外的自身免疫性疾病(如类风湿关节炎、干燥综合征和克罗恩病)、慢性感染疾病(如艾滋病)、活动性感染、经免疫抑制剂及糖皮质激素治疗。另选同期在我院进行健康体检的性别、年龄匹配的健康对照者33例作为对照组,其中男2例、女31例,年龄14~68(43.23±14.47)岁。收集SLE组外周血ANA、nRNP抗体、抗Sm抗体、抗核小体抗体及抗Ro-52抗体、dsDNA抗体、补体C3、补体C4资料。两组性别、年龄差异无统计学意义。本研究经哈尔滨医科大学附属第二医院伦理委员会批准,并取得受试对象的知情同意。
1.2 主要试剂 人外周血淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);InvitrogenTMTRIzolTMReagent (Thermo Fisher Scientific); Bulge-LoopTMmRNA qRT-PCR、M-MLV逆转录酶、SYBR Green、dNTP、DDT、RNase抑制剂、Oligo(dT)18、异丙醇、氯仿等(锐博生物科技有限试剂)。
1.3 PBMCs内RSAD2 mRNA表达检测 采用RT-PCR法。抽取两组晨起空腹静脉血2 mL,加入EDTA抗凝管中,采用密度梯度离心法分离PBMCs,加入1 mL TRIzol,吹打至白色沉淀溶解后转入无酶EP管中,-80 ℃保存。取出已加入TRIzol的标本,室温解冻,依次加入氯仿、异丙醇、冰预冷的无水乙醇、无RNA酶DEPC水,充分溶解后于60 ℃中孵育5 min。进行逆转录反应,得到逆转录反应产物cDNA,并分别用无RNA酶的水稀释10倍。检索NCBI数据库,查到人类RSAD2基因的cDNA全长序列,以DNA STAR软件设计扩增模板的引物,以β-actin作为内参照基因。RSAD2上游引物5′-TTGGACATTCTCGCTATCTCCT-3′,下游引物5′-AGTGCTTTGATCTGTTCCGTC-3′;β-actin上游引物5′-CATGTACGTTGCTATCCAGGC-3′,下游引物5′-CTCCTTAATGTCACGCACGAT-3′。各引物均由博尚生物技术公司合成。配置总体积为20 μL反应体系,PCR循环条件95 ℃ 20 s,95 ℃ 1 s、60 ℃ 20 s共40个循环,95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s共40个循环。对RT产物的细胞拷贝数进行标准化,以2-ΔΔCt为相对表达量。按照2-ΔΔCt值将SLE患者分为高RSAD2表达、低RSAD2表达两个水平。
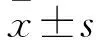
2 结果
2.1 两组RSAD2 mRNA表达水平比较 SLE组、对照组RSAD2 mRNA表达水平分别为8.4±10.7、1.7±1.4,SLE组RSAD2 mRNA表达水平高于对照组(P<0.01)。SLE组中高疾病活动度者、低疾病活动度者RSAD2 mRNA表达水平分别为11.4± 12.7、4.9 ±6.4,高疾病活动度者RSAD2 mRNA表达水平高于低疾病活动度者(P<0.01)。
2.2 不同RSAD2 mRNA表达程度的SLE患者免疫指标比较 46例SLE患者中,RSAD2高表达23例、低表达23例。RSAD2高表达者ANA、抗nRNP抗体阳性率均高于RSAD2低表达者(P均<0.05)。见表1。
2.3 SLE患者RSAD2表达水平与SLE特异性抗体水平的相关性 SLE患者RSAD2 mRNA表达水平与ANA(r=0.39,P<0.01)、抗nRNP抗体(r=0.31,P<0.05)均呈正相关,而抗Sm抗体、抗dsDNA抗体、抗核小体抗体、抗Ro-52抗体及补体C3、C4均无明显相关(P均>0.05)。

表1 不同RSAD2 mRNA表达程度的SLE患者免疫指标比较(例)
3 讨论
SLE是由环境致病因素、遗传风险因素等引起的一种常伴有靶器官损害的自身免疫性疾病,患病率和病死率呈持续增长,社会经济负担重,是一个严重的公共卫生问题。高疾病活动度是导致疾病进展的主要因素,其高疾病活动度严重影响患者的日常生活。早期或者临床前期发现及诊断可以显著改善或者治愈这种疾病,然而SLE的早期诊断仍是临床难题。近年研究发现,在SLE患者中Ⅰ型IFN的血清水平与病情活动呈正相关,IFN诱导基因与SLE发病密切相关,高IFN基因表达的SLE患者年龄较低,有着更高的抗dsDNA抗体或者低补体,病程较短且往往有着更高的活动性[6]。特别是Ⅰ型IFN系统,可通过对一系列下游基因的调控诱导自身免疫,因此研究Ⅰ型IFN诱导表达基因与SLE的关系具有重要意义。
RSAD2是Ⅰ型IFN介导的与内质网相关的病毒抑制基因,又被称作蝰蛇毒素(Viperin)或cig5,位于人类染色体2p25.2上,是一种有着广泛抗病毒活性的宿主蛋白质,近年研究表明,RSAD2与免疫反应密切相关,可用于预测类风湿关节炎的病情进展[7]。荟萃分析发现,RSAD2对SLE有重要的调控作用,在SLE中较正常对照表达明显升高[8]。进一步研究发现,SLE患者RSAD2的转录产物在CD3+、CD4+、CD19+B细胞及CD33+髓样细胞中较正常对照细胞表达明显升高[9]。同时,有基因芯片相关研究在筛选SLE患者与正常对照的差异表达基因中发现,RSAD2为显著上调的差异表达基因。进一步在小鼠B淋巴细胞中进行qRT-PCR验证,结果显示在SLE鼠B淋巴细胞中RSAD2较正常小鼠B淋巴细胞仍然显著上调[10]。本研究发现,SLE组RSAD2 mRNA表达水平高于对照组,SLE组高疾病活动度者RSAD2 mRNA表达水平高于低疾病活动度者,提示RSAD2表达升高可能与SLE的发生发展机制相关,并可以在一定程度上反映疾病的活动情况。
SLE的免疫异常涉及复杂的细胞间相互作用的过程,B淋巴细胞是SLE发病的直接参与者。抗原提呈细胞(APC)通过膜相关抗原受体(sIg、BCR)特异性捕获并提呈抗原,诱导B细胞活化,产生大量自身抗体,与自身抗原形成免疫复合物,通过Toll样受体配体,使B淋巴细胞处于高度活化状态。多种因素均可影响B淋巴细胞的免疫活性,如免疫调节机制缺陷、免疫耐受性丧失、信号转导异常等[11]。目前已经证实,SLE患者中存在B淋巴细胞受体信号通路的持续激活,基因分析显示B淋巴细胞受体信号通路存在基因表达缺陷和免疫效应分子异常[12,13]。B淋巴细胞除了分泌自身抗体外,还可以表达自身抗原,激活T淋巴细胞,产生促炎细胞因子,包括TNF-α和IL-6等[14]。以上多种机制共同影响了SLE的发生发展,而IFN诱导产生的RSAD2,作为一个抗病毒基因,有研究表明其在银屑病皮肤中过表达,其与IFNα诱导的抗病毒基因表达中的作用一致[15],推测RSAD2的过表达与IFN诱导的其他基因共同在SLE发生发展中起着重要作用。SLE经典的筛选手段是通过检测血清ANA水平。本研究发现,SLE患者中RSAD2高表达者ANA、抗nRNP抗体阳性率均高于RSAD2低表达者,且SLE患者RSAD2 mRNA表达水平与ANA、抗nRNP抗体均呈正相关,提示RSAD2的过表达可协助SLE患者体内产生自身抗体,进一步表明其可能通过影响了B淋巴细胞的免疫活性,从而影响SLE的发生发展。
综上所述,SLE患者RSAD2的表达水平显著增高,并与疾病活动度及免疫功能相关,表明RSAD2具有作为SLE生物标志物的潜力,抑制RSAD2基因的表达也可能成为治疗SLE的一种新方向。
