URAT1基因多态性与哈萨克族人群高尿酸血症发病影响因素的交互作用
2018-08-23李瑞秦丽岩姚华张蓓苗蕾刘璐孙玉萍
李瑞,秦丽岩,姚华,张蓓,苗蕾,刘璐,孙玉萍
(1新疆医科大学基础医学院,乌鲁木齐830011;2新疆医科大学第六附属医院;3新疆医科大学第一附属医院;4新疆医科大学公共卫生学院)
高尿酸血症(HUA)是痛风、心脑血管疾病、代谢性疾病等疾病的独立危险因素[1,2]。近年研究发现,环境因素或遗传因素均可使人体内尿酸的合成增加或排泄减少,当体内尿酸水平达到一定阈值时,均能使机体出现无症状HUA。绝大多数HUA的发生是由于尿酸在体内排泄障碍所引起,而肾脏对尿酸的滤过及重吸收直接决定体内的尿酸水平。人尿酸盐转运子(URAT1)基因由SLC22A12基因编码,表达于肾脏近曲小管,参与尿酸在肾脏的重吸收[3],以离子通道的形式掌控着体内的尿酸水平,一旦其表达异常,直接影响着HUA的发生发展。基因位于编码区的单核苷酸多态性(SNP)突变可影响其蛋白质的表达,进而影响其生物学活性。虽然URAT1基因rs524023位点位于非编码区,但其突变为有意义的突变,参与疾病的发生。自2014年11月~2016年12月,我们检测了哈萨克族人群中HUA发病的影响因素及HUA患者URAT1基因rs524023位点的突变情况,分析二者的交互作用,为哈萨克族HUA的防治提供理论依据。
1 资料与方法
1.1 临床资料 选择乌鲁木齐市参加健康体检的哈萨克族体检者1 035例,其中男434例、女601例,年龄(43.12±12.25)岁。纳入标准:①HUA[4]的诊断符合男性尿酸水平>417 μmol/L(7 mg/dL),女性>357 μmol/L(6 mg/dL);②年龄20~70岁;③相互间不存在血缘关系;④在新疆稳定居住20年以上的三代直系血亲均为哈萨克族;⑤所有研究对象均知情同意。排除标准:患有恶性肿瘤、其他急慢性炎症、感染及自身免疫性疾病等,近期有服用降尿酸药物者。本研究经医院伦理委员会审核批准。
1.2 资料收集及疾病筛查 对全部体检者进行问卷调查,记录其一般信息、现病史、既往史及家族遗传史等,测量身高、体质量、腰臀围、血压[包括收缩压(SBP)、舒张压(DBP)]等。采集体检者禁食12 h后的静脉血5 mL,充分抗凝,取出3 mL以3 500 r/h离心分离血清,检测血尿酸(SUA)、肌酐(CREA)、葡萄糖(GLU)等生化指标。定义肥胖为BMI≥28 kg/m2,高血压为血压≥140/90 mmHg,高血糖为空腹血糖(FBG)≥6.1 mmol/L或已确诊糖尿病,高胆固醇血症为TC≥5.18 mmol/L,高甘油三酯血症为TG≥1.70 mmol/L,慢性肾脏病为肾小球滤过率(eGFR)<60 mL/(min·1.73 m2)。
1.3 URAT1基因多态性检测 取血后,应用磁珠法提取全血DNA,并检测其浓度及纯度,将符合要求的DNA置于-80 ℃冰箱留存备用。URAT1基因rs524023位点单核苷酸多态性引物的设计与合成由上海天昊生物工程有限公司完成,并应用多重基因点突变快速检测技术(iMLDR)对SNP位点进行分型。
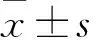
2 结果
2.1 哈萨克族人群HUA发病的影响因素分析结果 1 035例哈萨克族研究对象中,HUA者194例,包含男119例、女75例,年龄(45.66±13.34)岁;不合并HUA者841例,包含男315例、女526例,年龄(41.30±11.84)岁。合并HUA者的年龄、男性比例、BMI、SUA、BUN、SCr和TG均高于不合并HUA者,FBG、eGFR低于不合并HUA者(P均<0.01)。见表1。选择是否为HUA患者为因变量,对以上因素进行多因素Logistic回归,年龄(OR=1.02,95%CI=1.01~1.04)、慢性肾脏病(OR=5.99,95%CI=3.01~11.26)和高甘油三酯血症(OR=3.61,95%CI=2.49~5.24)为哈萨克族HUA的危险因素,而女性(OR=0.44,95%CI=0.31~0.62)为哈萨克族HUA的保护因素。见表1。
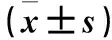
表1 合并与不合并HUA者临床指标比较
2.2 合并与不合并HUA者URAT1基因rs524023位点多态性分析结果
2.2.1 等位基因与基因型分布情况 不合并HUA者URAT1基因rs524023位点基因型频率符合HWE平衡检验(χ2=1.17,P=0.56),表明所选研究对象有较高的群体代表性。合并与不合并HUA者的rs524023位点等位基因与基因型分布差异无统计学意义(P均>0.05)。见表2。
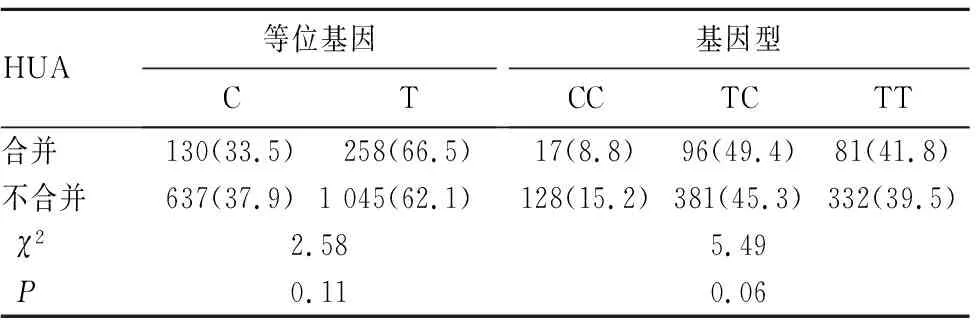
表2 合并与不合并HUA者URAT1基因rs524023位点等位基因与基因型分布情况比较[例(%)]
2.2.2 遗传模型中URAT1基因突变与HUA的关联分析 加性模型中,TC和TT基因型相对于CC基因型表现为HUA的危险因素(OR>1,95%CI不跨1),调整性别和年龄后患病风险相对增加1.87和1.89倍。显性模型中,携带TT+TC基因型为HUA的危险因素(OR>1,95%CI不跨1),调整性别和年龄后患病风险相对增加1.88倍。见表3。
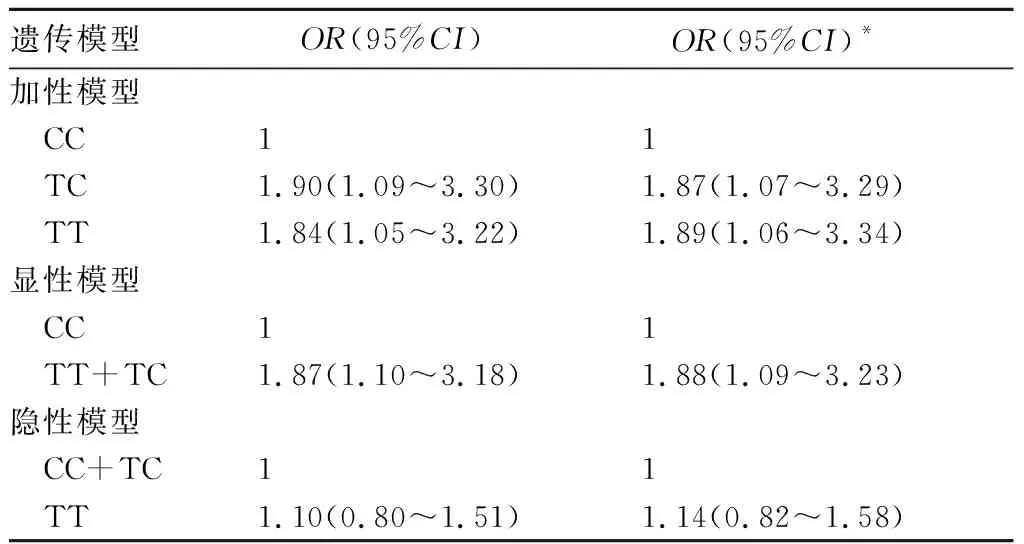
表3 遗传模型中URAT1基因多态性与HUA的关联性分析
2.3 URAT1基因多态性与HUA影响因素的交互作用分析 选取筛选出的HUA发病影响因素,与URAT1基因多态性进行交互作用分析,结果表明,女性携带URAT1基因rs524023位点突变在相加和相乘模型中均存在交互作用,表现为哈萨克族HUA的保护因素(P′<0.05,OR′=0.16);慢性肾脏病患者携带URAT1基因rs524023位点突变仅在相乘模型中存在交互作用,且可增加哈萨克族HUA的患病风险(P′<0.05,OR′=2.12)。见表4。
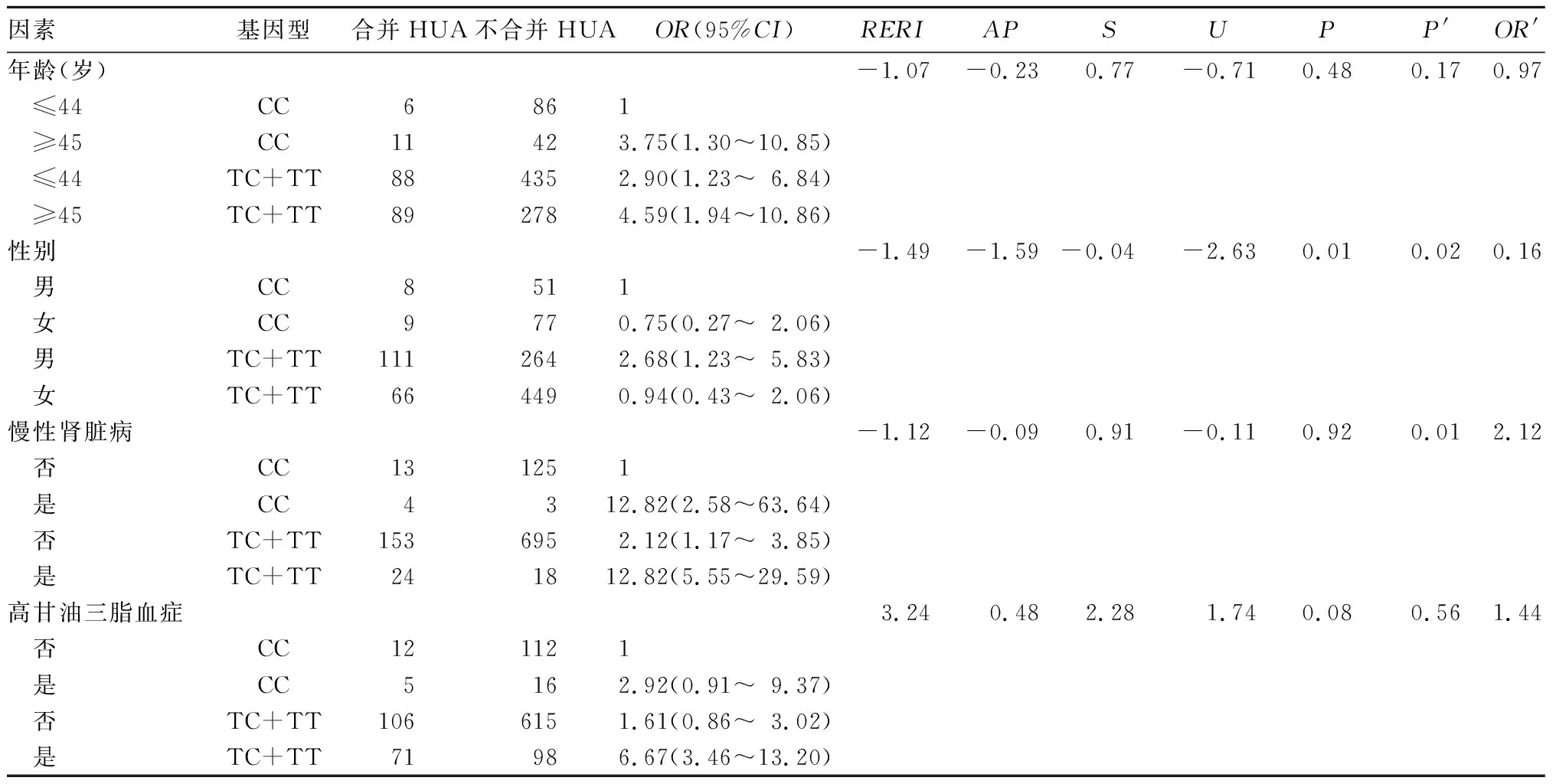
表4 URAT1基因多态性与HUA的交互作用分析
3 讨论
流行病学调查资料显示,HUA作为伴随众多疾病发生发展的基础性疾病之一,其在我国的患病率约为8.4%~25%,且存在地域差异[5,6]。哈萨克族作为新疆主要的少数民族之一,是一支依水草而居的游牧民族,有着悠久的民族文化历史及风俗习惯。本课题组前期调查发现,哈萨克族人群HUA的患病率稍低,推测可能与其独特的生活方式及饮食习惯有关[7]。已有研究证实,年龄、男性、肥胖、高血压、糖尿病、慢性肾脏病、血脂异常、心脑血管疾病等都参与HUA的发生发展,且相互间存在密切的促进作用[8~10]。但本研究结果显示,仅年龄、慢性肾脏病和高甘油三酯血症为哈萨克族HUA的危险因素,分析原因,可能与哈萨克族人群喜食牛羊肉和奶制品(奶茶、奶酪等),少吃蔬菜有关[11,12]。
尿酸源于嘌呤代谢,摄入过多富含嘌呤的食物、内源性嘌呤合成增多或疾病致使的嘌呤代谢紊乱均能一定程度上升高体内SUA水平,但80%原发性HUA是由于尿酸排泄障碍引起[10]。肾脏作为尿酸排泄的主要器官,任何原因引起的肾小球对尿酸滤过减少或肾小管的重吸收增加,均可上调体内尿酸水平并增加患HUA的风险。反之,体内尿酸过多时可以尿酸盐晶体的形式沉积于关节等组织器官,当尿酸盐沉积在肾脏时,可引起肾脏局部炎症及免疫反应并损害其功能。由此可见,HUA和慢性肾脏病两者间互为因果,相互影响[13,14]。
URAT1基因作为尿酸盐阴离子交换器,表达于肾小管上皮细胞刷状缘,调控着肾脏对尿酸的重吸收。研究显示,URAT1基因位于染色体11q13,含有10个外显子,是一种编码555个氨基酸的膜转运蛋白。其包含2种剪切体(a,b),由于剪切体b相对于a而言,缺失了221个氨基酸,推测这种特殊结构可能影响肾小管对尿酸的重吸收[15]。本研究结果显示,虽然rs524023位点基因型及等位基因频率在病例组和对照组中并未表现出有统计学意义的差异,但在遗传模型中,TT、TC和TT+TC基因型均表现为HUA的危险因素(OR>1),提示URAT1基因rs524023位点突变可增加哈萨克族患HUA的风险;交互作用分析发现,URAT1基因rs524023位点突变与哈萨克族HUA发病影响因素间存在交互作用,表现为女性携带rs524023位点突变可减少哈萨克族HUA的患病风险,而慢性肾脏病患者携带rs524023位点突变则表现为哈萨克族HUA的危险因素,提示URAT1基因rs524023位点突变为哈萨克族女性HUA的保护因素,但可加重哈萨克族慢性肾脏病患者发生HUA的可能性。
综上,URAT1基因rs524023位点突变是哈萨克族HUA的危险因素,且与性别和慢性肾脏病间存在交互作用,为进一步深入探讨哈萨克族HUA的发生发展及防治策略提供了新方向。
