1,25-二羟维生素D3对糖尿病肾病大鼠足细胞Angptl4、Desmin表达的影响
2018-08-23吴欣黄健刘畅杨静阳柳黄匀李晓颖于黔
吴欣,黄健,刘畅,杨静,阳柳,黄匀,李晓颖,于黔
(贵阳市第一人民医院,贵阳550002)
糖尿病肾病(DN)是糖尿病最常见的并发症之一,是引起终末期肾病的主要原因。足细胞损伤被认为是引起DN蛋白尿和肾小球硬化的关键因素,其损伤常表现为足突融合消失、细胞体积逐渐变小、阴离子电荷减少,最终脱落并从尿液中排出[1]。血管生成素样蛋白4(Angptl4)是血管生成素样蛋白家族的重要成员,主要分布在肝脏、脂肪组织、心肌、骨骼肌、肾脏[2]。最近的研究发现,肾小球足细胞分泌的Angptl4与肾脏病患者大量蛋白尿的形成相关[3]。结蛋白(Desmin)是一种细胞骨架中间的丝蛋白成分,正常情况下Desmin在足细胞无明显表达,但在某些因素引起足细胞受损时,其表达量可明显增加,因此可作为足细胞损伤的标志[4]。1,25-二羟维生素D3[1,25-(OH)2D3]最经典的生物学效应是调节钙磷代谢,近年研究发现,其对DN免疫炎症反应的多个环节具有调节作用,活性维生素D3可以减少肾脏病患者蛋白尿以及足细胞表达维生素D受体。维生素D抗蛋白尿作用与血流动力学、血糖改变无关[5],而足细胞是防止尿蛋白滤出主要的屏障,因此推测维生素D3可能通过作用于肾脏足细胞而减轻尿蛋白的排泄。2017年3~9月,我们观察了1,25-(OH)2D3对DN大鼠肾组织足细胞Angptl4和Desmin表达的影响,进一步探讨1,25-(OH)2D3肾脏保护作用的机制。
1 材料与方法
1.1 动物与试剂 雄性 SD大鼠 30只,购买并饲养于贵州医科大学实验动物中心,体质量220~260 g。1,25-(OH)2D30.25 μg/粒(上海罗氏公司),溶于橄榄油配成混悬液(0.02 μg/mL)。链脲佐菌素(STZ,美国 Sigma公司);1,25-(OH)2D3(上海罗氏公司);大鼠Angptl4、Desmin抗体(北京博奥森生物技术有限公司);免疫组化试剂盒、浓缩型DAB试剂盒、Western blotting试剂盒(北京中杉金桥生物技术有限公司)。
1.2 模型制备与分组 大鼠适应性喂养1周后,随机选取22只,采用一次性腹腔注射STZ方法制备糖尿病模型。禁食 12 h后,单次腹腔注射STZ 55 mg/kg,3 d后尾静脉取血测血糖,以空腹血糖维持在13.9 mmol/L或随机血糖在16.7 mmol/L以上为糖尿病模型制备成功。4周后大鼠出现蛋白尿和肾脏病理改变,为DN模型制备成功。共造模成功18只大鼠,随机分为DN模型组(M组)、1,25-(OH)2D3干预组(D组)各9只。将未造模的8只大鼠作为正常对照组(N组)。
1.3 干预方法 D组在糖尿病模型建立后予1,25-(OH)2D30.1 μg/ (kg·d)灌胃, M组给予等量橄榄油灌胃,N组给予等量蒸馏水灌胃,均干预12周。干预期间每周测量尾静脉血糖2次,对血糖过高(>26.0 mmol/L)的大鼠皮下注射适量胰岛素,维持随机血糖在16.7 mmol/L水平以上。
1.4 尿液指标检测 干预12周末时,各组大鼠进代谢笼,收集24 h尿液,采用双缩尿法测定24 h尿蛋白(24 h Upro),采用ELISA法测定尿Angptl4水平。
1.5 血液指标检测 留取尿液后处死各组大鼠,眼球取血,分离血清,采用全自动生化分析仪测定血BUN、SCr水平,采用ELISA法测定血Angptl4水平。
1.6 肾组织病理变化观察 取各组大鼠右肾组织,置于10%甲醛固定液固定,石蜡包埋,切片厚约3 μm,行常规HE染色、PAS染色,在400倍高倍镜下和电镜下观察肾组织病理变化。
1.7 肾组织Angptl4、Desmin蛋白表达检测 ①采用免疫组化SP法。取各组大鼠右肾组织,按照试剂盒说明进行免疫组化染色,采用 PBS代替一抗作为阴性对照。以细胞质内出现棕黄色颗粒为阳性。每张切片在400倍视野下随机选取10个含肾小球的视野,以Image-Pro Plus图像分析软件测量目标区域面积、积分光密度,以两项乘积计算平均光密度值。②采用Western blotting法。留取大鼠左肾于-80 ℃冰箱保存。制备SDS-PAGE 胶,肾组织匀浆40 μg,半干转印迹系统(360 mA,60 min)至聚偏氟乙烯膜(PVDF),5%市售脱脂奶粉室温摇床封闭120 min,Angptl4、Desmin(1∶1 000)于室温摇床孵育120 min,二抗(1∶5 000)于室温摇床孵育60 min,以GAPDH为内参照, DAB 避光显影,用Image J分析软件将图片上每个特异条带灰度值数字化。
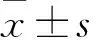
2 结果
2.1 各组尿液、血液指标比较 与N组相比,M组、D组24 h Upro、尿Angptl4、血BUN、血Scr均升高,血Angptl4水平均降低(P均<0.05)。与M组相比,D组24 h Upro、尿Angptl4、血BUN、血Scr均降低,血Angptl4水平升高(P均<0.05)。见表1。
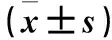
表1 各组大鼠尿24 h Upro、尿Angptl4及血BUN、Scr、Angptl4水平比较
2.2 各组肾组织病理变化 HE染色示,N组肾小球体积、形态和结构正常。M组可见肾小球因毛细血管球肥大导致体积增大,肾小球基底膜部分增厚,系膜增生明显,肾小管上皮细胞偶可见空泡,小管内可见蛋白管型,有大量炎症细胞浸润,肾间质和小动脉无明显改变。电镜结果显示,M组肾小球基底膜增厚,足突融合,符合DN的早期改变,因造模时间短,未见到DN晚期的结节性硬化。D组肾脏病理改变较M组减轻。
2.3 各组肾组织Angptl4、Desmin蛋白表达比较 ①免疫组化结果:N组肾小球及周围肾小管组织结构清晰,其肾小管、内皮细胞、足细胞、系膜细胞无明显阳性染色;M组Angptl4和Desmin的表达明显增强,主要见于肾小球足细胞,而D组Angptl4和Desmin的表达较M组减低(P均<0.05)。见表2。②Western blotting结果:与N组相比,M组Angptl4、Desmin蛋白表达均上调(P均<0.05);与M组相比,D组Angptl4、Desmin蛋白表达均下调(P均<0.05)。见表2、图1。
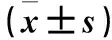
表2 各组肾组织Angptl4、Desmin表达比较
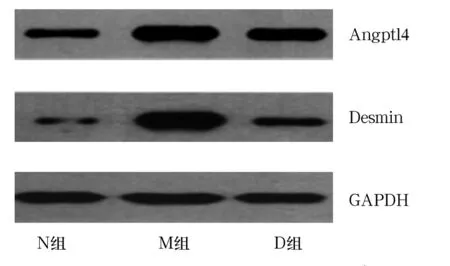
图1 各组肾组织Angptl4 、Desmin蛋白表达情况(Western blotting法)
3 讨论
肾小球足细胞损伤是DN早期的重要分子病理特征,在DN 的发生发展过程中起着关键作用,且与蛋白尿密切相关[3]。而足细胞相关因子表达的改变是蛋白尿形成的一个重要环节。本研究发现,与N组相比,M组24 h Upro、血BUN、Scr明显上升,表明DN大鼠模型建立成功。
Angptl4是一种分泌蛋白, 被认为是参与糖和脂质代谢的蛋白,与糖尿病患者的糖脂代谢紊乱及胰岛素抵抗有关[6]。近年研究发现,Angptl4蛋白参与了多种生理和病理反应,包括创伤修复、肿瘤、血管生成和氧化还原调控等。Angptl4在正常肾脏组织中少量表达,而在肾癌、药物引起肾损伤、肾脏纤维化时表达增加。最近有研究发现,在足细胞相关疾病(如微小病变性肾病、膜性肾病)中,肾小球中足细胞分泌的Angptl4表达上调,提示Angptl4在肾脏损伤中可能发挥重要作用。Angptl4在足细胞中的过度表达可引起大量的选择性蛋白尿、肾小球基底膜缺失以及足细胞足突弥散融合,表明Angptl4可能对肾小球基底膜的屏障功能有影响[7]。最新研究显示,Angptl4可能在微小病变型肾病(MCD)蛋白尿的发生中发挥了重要作用[7]。Chugh等[8]研究发现,MCD小鼠足细胞、外周血清及尿液中Angptl4水平增加;通过转基因技术使小鼠足细胞特异性高表达Angptl4后,可使MCD小鼠肾小球滤过屏障唾液酸分泌降低,导致静电荷减少,小鼠出现明显的蛋白尿,表明肾小球足细胞特异性高表达Angptl4在MCD蛋白尿形成过程中起重要作用。研究认为,Angptl4在肾病综合征患者中导致蛋白尿的发病机制可能是:病理状态下,足细胞分泌的低唾液酸化的Angptl4与肾小球基底膜结合,改变了蛋白信号通路引起蛋白尿,然后随着疾病进展,Angptl4逐渐向内皮移动并累积,促进了足突的融合并进一步加重了蛋白尿的程度[7]。本研究发现,模型组大鼠蛋白尿和血、尿Angptl4的水平明显上升,肾组织Angptl4的表达上升,提示Angptl4与DN大鼠的蛋白尿相关。
Desmin是一种细胞骨架中间丝蛋白,正常情况下仅在系膜细胞少量表达,足细胞不表达,当足细胞受损时,可大量表达[9],因此也被作为反映足细胞损伤的标志蛋白。本研究发现,模型组大鼠肾组织Desmin表达明显升高,而Desmin作为足细胞损伤的标志,表明DN大鼠发生足细胞损伤。
1,25-(OH)2D3的生物学作用主要包括调节钙磷代谢和骨的再建,调节细胞增生与分化,以及免疫调节等。许多研究发现,活性维生素D3可影响系膜细胞生长和炎症反应,从而对进行性肾小球损伤具有保护作用。最近的流行病学调查显示,活性VitD3及其类似物可以显著降低CKD患者包括DN患者的蛋白尿[10]。VITAL研究是全球第一个安慰剂对照、随机双盲的多中心临床研究,结果发现,1,25-(OH)2D3在联合血管紧张素转化酶抑制剂的基础上,可显著降低2型糖尿病患者蛋白尿水平[11]。在多种动物模型包括肾大部切除和阿霉素诱导的肾病模型中发现,给予维生素D类似物可以明显降低蛋白尿,减轻足细胞损伤[10,12]。本研究发现,模型组大鼠蛋白尿和血、尿Angptl4的水平明显上升,肾组织Angptl4和Desmin的表达上升,而1,25-(OH)2D3干预后,蛋白尿和血、尿Angptl4的水平下降,肾组织Angptl4和Desmin的表达下降,这可能是1,25-(OH)2D3发挥肾脏保护作用的机制之一。
综上所述,在DN模型大鼠中,足细胞损伤后分泌Angptl4、Desmin增加,而1,25-(OH)2D3干预后肾组织Angptl4、Desmin蛋白表达减少,从而减少蛋白尿,减轻肾脏病理损害,提示1,25-(OH)2D3可能具有足细胞保护作用,为1,25-(OH)2D3临床治疗DN 提供了新的理论依据,但具体机制还有待进一步的科学研究。
