超声评价微泡诱导超声空化联合血凝酶增强兔VX2肝癌微波热消融作用
2018-08-21贺建国周晓东
石 颖,谷 芬,杨 倩,贺建国,周晓东*
[1.山西医科大学第二医院超声诊断科,山西 太原 030001;2.空军军医大学(第四军医大学)西京医院超声诊断科,陕西 西安 710032]
近年来,超声引导热消融已经成为非手术治疗肝癌的重要手段之一。肝脏及肝癌组织血流丰富,在热消融治疗过程中,部分热能被血流带走而产生“热沉降效应”,导致少数肿瘤细胞不能被彻底杀灭[1]。本课题组前期实验研究[2]表明,微泡诱导超声空化联合局部注射血凝酶可导致明显的兔肝局部微血管损毁及血流减低,同时可增加兔正常肝脏低能量微波消融体积,增强消融效果[3]。本研究建立兔VX2肝癌模型,通过超声检查验证消融后即刻微泡诱导超声空化联合血凝酶对兔肝VX2肿瘤微波热消融的增强作用。
1 材料与方法
1.1 实验动物 选取35只健康新西兰大白兔,购自空军军医大学(第四军医大学)实验动物中心,体质量2.0~2.5 kg,雌雄不限。腿部种植VX2肿瘤的荷瘤种兔2只,购自江苏省连云港市第二人民医院实验室。本实验经空军军医大学(第四军医大学)伦理委员会批准(伦理委员会编号XJYYLL-2013016)。
1.2 动脉模型建立 经静脉麻醉实验兔后,选择肝左叶较厚部位,以眼科镊插入肝脏实质形成隧洞,将VX2瘤组织填入,以明胶海绵填塞后关闭腹腔。VX2肿瘤种植14天后,32只荷瘤兔存活,且肝VX2肿瘤最大径均>1 cm。
1.3 主要仪器与试剂 CZ-960A型高声压超声无创治疗仪(四川绵阳索尼克电子有限责任公司),治疗探头直径2.5 cm,频率831 KHz,峰值负压4.6 MPa,平均声强1.55 W/cm2,占空比0.22%,采取工作6 s、间歇6 s的交替治疗模式。微波治疗仪ECO-100C(南京亿高微波系统工程有限公司),工作频率(2 450±20)MHz,采用A型治疗针头,针头长度为3 mm。EchoLaser超声仪(百胜医疗公司),高频探头9 L,频率4~11 MHz。超声造影剂采用声诺维(SonoVue),微泡平均直径为2.5 μm,使用前注入5 ml生理盐水振荡混匀。注射用血凝酶(商品名巴曲亭,蓬莱诺康药业有限公司)。
1.4 实验方法
1.4.1 实验动物分组 将32只荷瘤兔随机分为4组:生理盐水组(空化假辐照+生理盐水)、血凝酶组(空化假辐照+生理盐水+血凝酶)、空化组(超声空化+微泡)和联合组(超声空化+微泡+血凝酶),每组8只。
1.4.2 超声空化治疗 对实验兔建立静脉通道,麻醉成功后开腹,暴露肝左叶VX2肿瘤,以生理盐水浸润纱布固定。将消毒后的CZ-960A型高声压超声无创治疗仪治疗探头与VX2肿瘤紧密接触。空化组和联合组采用微量泵经兔耳缘静脉以0.5 ml/min流率匀速泵入超声造影剂声诺维(0.2 ml/kg体质量),同时使用超声治疗探头进行空化辐照治疗10 min;联合组空化辐照后于肝左叶VX2肿瘤空化治疗区注射血凝酶2 U,空化组不注射任何药物。生理盐水组和血凝酶组经静脉通道持续泵入生理盐水(0.2 ml/kg体质量),同时使用超声治疗探头进行空化假辐照10 min;血凝酶组假辐照后在肝左叶VX2肿瘤空化假辐照区注射血凝酶2 U,生理盐水组不注射任何药物。
1.4.3 微波消融治疗 超声空化治疗完毕后即刻,对各实验组兔肝左叶VX2肿瘤中心进针行微波消融治疗,治疗功率10 W,时间3 min。
1.5 疗效评价 分别以灰阶超声和CEUS于治疗前测量肿瘤,消融治疗后测量消融区长度、宽度和厚度,计算肿瘤和消融区体积,体积=π/6×长度×宽度×厚度。以CDFI和CEUS观察消融前肿瘤血流分布特征、消融后消融区内及消融边缘残留组织血流分布情况。
1.6 统计学分析 采用SPSS 13.0统计分析软件。计量资料用±s表示。4组间比较采用单因素方差分析,两两比较用LSD法。消融前肿瘤体积灰阶超声与CEUS间比较采用两独立样本t检验,消融后消融区体积灰阶超声与CEUS间比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 灰阶超声 治疗前,兔VX2肝癌表现为低回声结节,见图1A。4组间肿瘤体积差异无统计学意义(P均>0.05),见表1。消融后,消融区超声表现为组织回声增强,可见片状分布的粗大点状强回声,见图1B。消融后,4组间灰阶超声测量消融区体积总体差异有统计学意义(P<0.001);两两比较,联合组消融区体积大于其他3组(P均<0.05),空化组消融区体积大于生理盐水组和血凝酶组(P均<0.05),生理盐水组与血凝酶组体积差异无统计学意义(P>0.05),见表1。
2.2 CDFI结果 4组兔治疗前肿瘤均可见丰富的血流信号,27只见明显的环绕血流分布与散在的短棒状血流信号,见图1C,5只见短棒状或条索样血流分布。消融后,联合组肿瘤实质内均未显示血流信号,生理盐水组、血凝酶组和空化组部分肿瘤实质消融区边缘可见点状血流信号分布,见图1D。
2.3 CEUS结果 治疗前CEUS示兔肝VX2肿瘤动脉期迅速增强,门静脉期快速消退,表现为典型的“快进快出”特征,见图1E。治疗前CEUS测量4组肿瘤体积差异无统计学意义(P>0.05),CEUS与灰阶超声测量4组肿瘤体积差异均无统计学意义(P均>0.05),见表1。
表1 4组兔VX2肝癌消融前肿瘤体积和消融后消融区体积比较(±s,n=8)
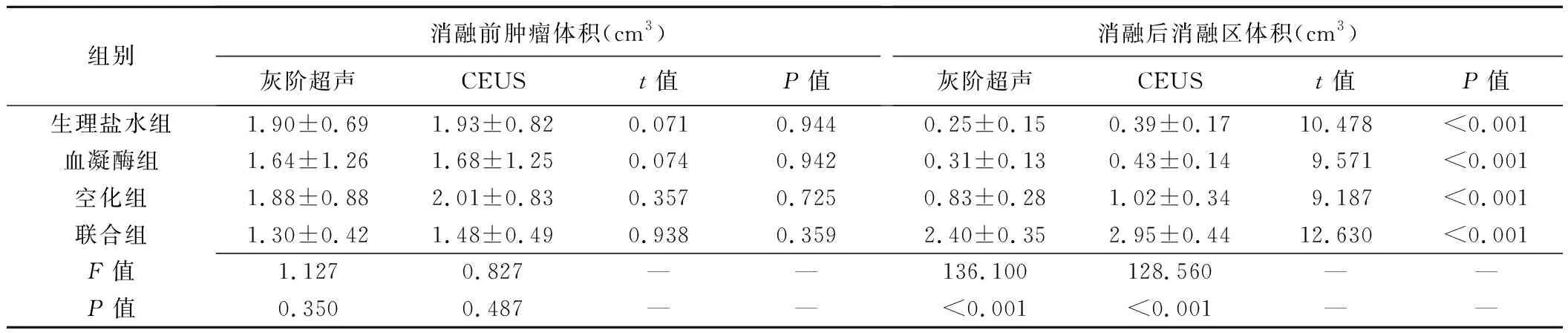
表1 4组兔VX2肝癌消融前肿瘤体积和消融后消融区体积比较(±s,n=8)
组别消融前肿瘤体积(cm3)灰阶超声CEUSt值P值消融后消融区体积(cm3)灰阶超声CEUSt值P值生理盐水组1.90±0.691.93±0.820.0710.9440.25±0.150.39±0.1710.478<0.001血凝酶组1.64±1.261.68±1.250.0740.9420.31±0.130.43±0.149.571<0.001空化组1.88±0.882.01±0.830.3570.7250.83±0.281.02±0.349.187<0.001联合组1.30±0.421.48±0.490.9380.3592.40±0.352.95±0.4412.630<0.001F值1.1270.827——136.100128.560——P值0.3500.487——<0.001<0.001——

图1 空化组实验兔消融治疗前后肿瘤超声表现 A.治疗前,灰阶超声示肿瘤呈不均质低回声(箭); B.消融后,灰阶超声示消融区内片状分布粗大点状强回声(箭); C.治疗前,CDFI示肿瘤内多发短棒样血流信号(箭); D.消融后,CDFI示消融区内血流信号消失,边缘可见残留血流信号(箭); E.治疗前,CEUS示肿瘤动脉期呈高增强(箭); F.消融后,CEUS示消融区内无增强,边缘见与CDFI图像相对应的条带状残留血供(箭)

图2 兔肝VX2肿瘤消融治疗后CEUS声像图 A.生理盐水组; B.血凝酶组; C.空化组; D.联合组
消融后,4组实验兔消融区内凝固坏死的组织均表现为造影剂充盈缺损,见图1F。联合组肿瘤实质部分均无增强,生理盐水组、血凝酶组和空化组部分肿瘤实质消融区边缘可见少量残余活性组织,呈典型的“快进快出”表现。CEUS测量4组间消融区体积总体差异有统计学意义(P<0.001);两两比较,联合组消融区体积大于其他3组(P均<0.05),空化组大于生理盐水组和血凝酶组(P均<0.05),生理盐水组与血凝酶组间差异无统计学意义(P=0.770),见图2。与灰阶超声测量的消融区体积相比,各组CEUS测量值均较大(P均<0.05),见表1。
3 讨论
目前超声引导下热消融治疗已被临床广泛认可,但单次消融体积有限,常导致消融不彻底、肿瘤易复发等不良后果。减少肝癌及周围肝组织的血供,降低“热沉降”效应,有利于提高热消融的效率[4-6]。研究[7]发现微泡诱导的超声空化可降低局部肝脏的血流供应,动物实验[8-9]发现超声造影剂微泡可增强兔VX2肝癌HIFU消融区的体积,且微泡在低强度超声作用下产生的空化效应可增强兔VX2肝癌激光消融效果[10]。Liu等[11]发现超声空化联合酒精消融兔正常肝脏,可较单纯酒精消融提高约10倍消融体积。为进一步降低局部血流灌注,本课题组前期研究[2-3]发现,在超声空化基础上局部注射血凝酶,可显著减少局部正常肝脏血流量,提高消融效果。在此基础上,本研究采用兔肝VX2肿瘤模型,使用超声空化联合血凝酶,以降低“热沉降”效应,结果发现联合组消融体积较生理盐水组明显增大,提高约7倍,较单纯空化治疗组提高约2.5倍。分析原因,兔VX2肝癌血供丰富,虽然肿瘤微血管对微泡诱导的超声空化敏感[12-13],但所造成的微血管壁机械性损伤属暂时性,加入血凝酶可更有效地降低局部血流量、提高热消融靶区的热能沉积,增大局部热消融的体积。
本研究治疗前CEUS测量的肿瘤体积与灰阶超声测量体积比较差异无统计学意义,原因可能为兔VX2肿瘤体积较小,且大多有包膜,因此测量差异不明显;且消融时产生气化,使消融区边界模糊,对比度差,故灰阶超声的测量误差较大。CEUS使用的超声造影剂仅在血管腔内流动,不进入组织细胞间隙,是真正的血池示踪剂[14-15],CEUS可清晰显示凝固坏死的组织与周边正常组织分界,使测量更为精确,因此消融后两者测量的消融区体积差异有统计学意义。
在显示血流方面,CDFI和CEUS均可显示组织内部的血流信号,但在位置较深和血流速度缓慢的组织中,CDFI显示组织血流的效果有限[16]。超声造影剂可清晰显示肿瘤和组织中的血流灌注,尤其对于显示热消融治疗后肿瘤残余组织的血流状况,CEUS明显优于CDFI。
综上所述,本研究结果表明微泡诱导的超声空化联合血凝酶可增大兔VX2肝癌微波热消融后消融范围。CEUS可准确显示肿瘤及消融区体积大小,并可检测消融区是否有残留组织,对评估肿瘤消融后疗效具有较高准确性。
