热射病模型大鼠脾脏巨噬细胞极化方向的探讨
2018-08-20彭霈曹秉振
彭霈,曹秉振
(济南军区总医院,济南250031)
热射病是一种致死性急症,临床上以较高的核心温度、皮肤干燥伴严重的中枢神经系统损害(如谵妄、抽搐、昏迷)为主要临床表现[1]。尽管热射病发生时,中枢神经系统的损伤由病理及影像学变化可直接观测到[2];但在全身炎性反应综合征发生时,中枢神经系统中炎性因子发生变化的机制仍未明了。已有多个学者发现,热射病发生时巨噬细胞分泌的细胞因子水平发生了变化[3,4],巨噬细胞的极化方向与炎性因子密切相关。巨噬细胞的极化[5]分为M1型和M2型,M1型为促炎性因子型,常见的M1型表面标志物有HLA-DR、CD197、诱导型一氧化碳合酶(iNOS)等[6];M2型为抗炎性因子型,M2型表面标志物有CD206、CD301、Ⅰ型精氨酸酶(ArgⅠ)等[7]。2016年3~6月,本实验选取iNOS、ArgⅠ分别作为两种极化方向的指标检测,探讨热射病模型大鼠巨噬细胞的极化方向。
1 材料与方法
1.1 动物、试剂及仪器 清洁级Wistar大鼠40只(36只+储备4只),体质量200~250 g,8周左右,购自山东大学齐鲁医学院动物中心。适应性生长2周后开始用于实验。可控式恒温箱购自山东瑞科电器公司;Aanti-CD68 antibody购自美国abcam公司;BX41显微镜、倒置相差显微镜购自日本奥林巴斯光学工业株式;RPMI-1640不完全培养基购自美国Gibco公司;细胞核、浆蛋白抽取试剂盒,BCA蛋白质定量试剂盒购自上海康成生物公司;iNOS(稀释比1∶2 000)、ArgⅠ(稀释比1∶2 000)购自美国abcam公司;Horseradish Peroxidase(HRP)结合的二级抗体、HRP-结合的抗生物素抗体购自上海康成生物;Western显影液、定影液购自上海冠龙照相器材公司;Western扫描仪购自上海天能科技有限公司。
1.2 动物分组及处理 将实验动物共分为热暴露即刻组,热暴露后1 d、2 d、3 d、7 d组,对照组共6组,每组6只。实验组动物给予热暴露温度40 ℃,相对湿度60%,照射100 min建立热射病大鼠模型。对照组不给予任何处理。
1.3 脾脏巨噬细胞的提取及鉴定 通过对南方医科大学的热射病复合内毒素感染模型[8]的改装,并借鉴台湾学者的模型[9],构建热射病大鼠模型。通过借鉴法舒地尔治疗自身免疫性脑脊髓炎[10]一文中小鼠脾脏巨噬细胞的分离方法,并结合国内对人、大鼠脾脏巨噬细胞分离技术[11]的研究进展,取得大鼠脾脏巨噬细胞。具体步骤如下:大鼠热射病造模结束后,水合氯醛4 mL/kg注射麻醉,然后无菌取出脾脏组织,通过清洗组织、制备细胞混悬液后,向沉淀中加入适量RPMI-1640不完全培养基,吹打、混匀,调整细胞浓度为2×106/mL,接种至一次性塑料培养瓶中培养,使培养瓶底细胞分布均匀,转移至37 ℃、5% CO2培养箱中培养,每隔4小时观察细胞的生长状况,培养12 h细胞贴壁度达到较佳状态时,取出至镜下观察。胎盘兰染色法鉴定细胞活力均在95%以上,瑞氏-姬姆萨染色法鉴定巨噬细胞纯度较高,在90%以上。运用细胞免疫组化法,显微镜下检测出细胞CD68抗体的阳性表达,即可定性鉴定为巨噬细胞。
1.4 脾脏巨噬细胞iNOS、ArgⅠmRNA表达的检测 采用实时定量PCR法。取出冻存的脾脏巨噬细胞,在37 ℃的水浴箱中复温,随后接种至一次性塑料培养瓶中,37 ℃、CO2培养箱中培养。贴壁细胞用PBS液清洗、匀浆使核酸蛋白体完全解离、离心提取细胞的全部RNA,使用NanoDrop®ND-1000测定RNA的浓度和纯度。按第一链cDNA合成试剂盒说明逆转录为cDNA,然后进一步进行PCR扩增。引物序列:iNOS:F:5′TTGGAGCGAGTTGTGGATTG3′,R:5′TGAGGGCTTGCCTGAGTGA3′。Arg Ⅰ:F:5′AACGGGAAGGTAATCATAAGCC3′,R:5′GCCTGGTTCTGTTCGGTTTG3′。PCR反应体系包括2 Master Mix 5 μL,F和R各0.5 μL,加水共8 μL,取cDNA 2 μL,反应条件:95 ℃、10 s,60 ℃、60 s,40个循环。将热应激处理后不同时间点的各组细胞样品分别进行iNOS、ArgⅠ两因子和GAPDH管家基因进行PCR反应。从机器中直接获得待检测因子的浓度结果,待测基因最终得到的相对浓度值可由管家基因给予校正,将机器自动生成的目的基因数值作为分子,各组样品管家基因的数值作为分母,两者相除后即可得到。
1.5 脾脏巨噬细胞iNOS、ArgⅠ蛋白表达的检测 采用Western blotting法。首先用蛋白质抽提试剂提取大鼠脾脏巨噬细胞总蛋白,SDS-PAGE电泳法分离细胞蛋白质,随后转移至PVDF膜,5%BSA溶液完全浸润,加iNOS、ArgⅠ试剂盒中的一抗,4 ℃放置过夜,TBST缓冲液清洗5 min,共3次,滴加HRP标记的二抗,室温孵育60 min,TBST缓冲液清洗5 min,共3次。取KCTM试剂盒,两试剂等量混合,放入PVDF膜,室温下反应3 min,固定,晾干,观察结果。使用电脑Image J软件自动分析检测结果,将图片上得到的条带定量计算出所检测的两种目的蛋白的灰度值。

2 结果
2.1 脾脏巨噬细胞的鉴定 显微镜下观察细胞呈圆形或椭圆形,排列密集,界限清晰,胞质内容物丰富,富含颗粒状物质,呈嗜酸性胞质。核仁呈圆形,清晰可见。免疫组化法测定巨噬细胞CD68抗体阳性表达。
2.2 各组iNOS、ArgⅠ表达比较 热暴露即刻组,热暴露后1、2、3、7 d组及对照组iNOS mRNA分别为0.071±0.020、0.045±0.020、0.059±0.02、0.026±0.005、0.171±0.086、0.129±0.270,ArgⅠmRNA分别为0.048±0.018、0.072±0.005、0.156±0.003、0.172±0.012、0.179±0.013、0.131±0.015。热暴露即刻组,热暴露后1、2、3、7 d组及对照组iNOS蛋白分别为0.208±0.087、0.168±0.074、0.116±0.039、0.076±0.012、0.282±0.086、0.468±0.145,ArgⅠ蛋白分别为0.210±0.032、1.196±0.243、1.259±0.121、1.346±0.332、1.408±0.103、0.832±0.109。与对照组iNOS mRNA及蛋白相比,除热暴露后7 d组差异无统计学意义外,余各组均降低(P均<0.05)。与对照组ArgⅠmRNA及蛋白比较,热暴露后1 d组低(P<0.05),热暴露后2 d、3 d、7 d组逐渐升高(P均<0.05)。
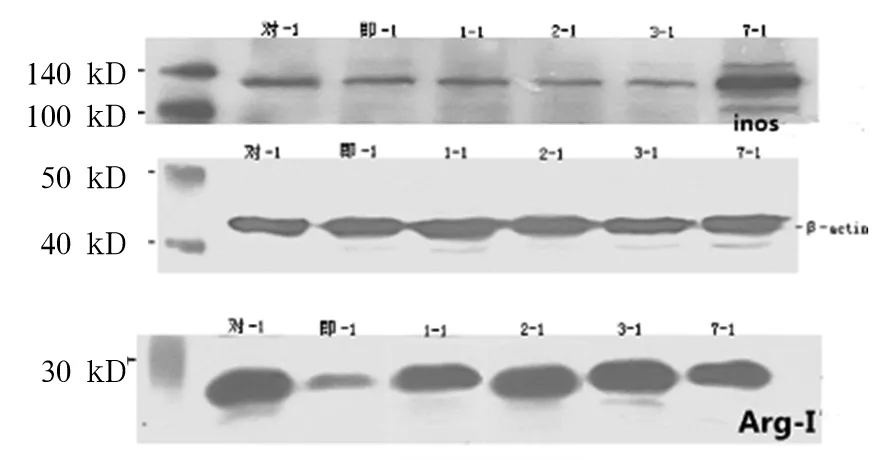
注:对-1,即-1,1-1,2-1,3-1,7-1分别代表对照组、热暴露过后即刻组、热暴露后1 d组、热暴露后2 d组、热暴露后3 d组、热暴露后7 d组。
图1iNOS、ArgⅠ在细胞中的蛋白表达
3 讨论
脾脏是机体最主要的免疫器官,调节机体的特异性及非特异性免疫反应,在联系循环系统及免疫系统间起着主要的桥梁作用。按组织结构成分来说,白髓和红髓共同构成脾脏组织。白髓相当于淋巴结的白质,主要用于对抗外界微生物及感染应激。红髓主要用来储存及过滤血液,分为脾索、脾血窦。巨噬细胞即附着于血窦的壁上,其具有强大的吞噬功能,可以吞噬、清除进入血液中的病原体,如细菌、血吸虫等,衰老红细胞的清除也由其完成,除此之外,脾索中还包括有淋巴细胞、树突状细胞。
巨噬细胞作为人体主要的免疫细胞,在炎性反应中发挥重要作用。根据其所处的环境不同,巨噬细胞可表达不同的功能表型,包括经典活化途径激活的M1型和替代活化途径激活的M2型。在脂多糖、肿瘤坏死因子α(TNF-α)等因子的刺激下,巨噬细胞促进TNF-α、IL-1、IL-12、ROS等细胞因子和CCR7、CXCL9等趋化因子的分泌,向M1型方向发生极化,发挥促进炎性反应、吞噬病原物的作用,加重机体炎性损伤。而在IL-4、IL-13和糖皮质激素等的刺激下,巨噬细胞向M2型方向发生转化,分泌抗炎因子IL-10和TGF-β、VEGF、EGF等,同时抑制IL-1、IL-6等促炎因子的分泌,发挥抗炎作用及减轻组织损伤。
在热射病病理机制的研究中,Moseley等学者认为当机体受到外界热应激环境刺激时,体内产生大量的内毒素,并发了内毒素血症,以脂多糖为主要成分的内毒素可进一步激活单核巨噬细胞释放炎性因子,如TNF-α、IL-1等,进一步引发全身炎性反应及凝血功能障碍。发挥促炎功能的促炎因子如TNF-α、IL-1能同时诱导IL-6、IL-8等抗炎性因子的产生,机体内的各种细胞因子之间相互作用、互相促进,从而使各种因子的数量逐渐增加,形成一个庞大的细胞因子间的作用反应体系,最终发展成级联式的炎性反应,导致多器官功能障碍综合征。多数国内外学者在构建热射病模型后,均监测到血液中各种细胞因子的大量分泌[2]。
巨噬细胞的极化方向与内环境中炎性因子的分泌密切相关。单纯构建的动物热射病模型和与脂多糖复合动物模型中,血液标本的炎性因子均显著增多,如TNF-α、IL-1、IL-6等。理论上,热射病发生后机体迅速发生免疫反应,大量的炎性细胞因子分泌,巨噬细胞向M1型方向极化。文献[12]显示,低温环境促进脂肪中巨噬细胞极化为M2型。有研究发现,低温可通过IL-4/IL-13-Stat6信号通路的介导,诱导M2型细胞活化;进一步通过分泌儿茶酚胺类激素促进机体产热,维持体温恒定,保护机体免受低温的损害。本实验结果显示,在热射病发生后1 d,与M2型极化相关的ArgⅠ含量逐渐增加,提示向M2型方向转变,起到抗炎作用、促进机体功能恢复。
从实验结果看,热应激即刻组两种因子的表达量均减少,理论上热应激刺激炎性因子的分泌,促使巨噬细胞发生极化,然而两种目的检测因子的表达量均减少,考虑到机体遭受外界应激刺激时巨噬细胞能够迅速出现免疫反应,极化现象的发生或许可能在热射病超急性期出现。其次,本实验选取的时间点稍宽,热应激超过24 h后,大鼠能够适应性生存,也是细胞极化发生不明显的一个考虑因素,后续试验可增加造模成功24 h内的指标测量。在1 d后同组ArgⅠ的表达即高于iNOS,起到保护机体的作用,是否由于离开高热环境后机体的保护及适应性的耐受有关,也是需要考虑的影响因素。
经过对巨噬细胞分型的研究,诸多学者认为机体内环境的不稳定性、体内的代谢状态等较多因素影响细胞的类型,使其不断变化;实际情况下细胞的分型不是很明显,M1、M2的分型是细胞处于功能状态的两个对立方面的表现,大多数细胞以两者之间的某种或某些状态存在[13];同时,对两种极化方向的细胞表面标志物的研究也只是在一定层次水平上可以应用,缺乏特异性。机体受到热刺激后处于一个不平衡的内环境,大量的炎性因子分泌,同时有少量的抗炎因子分泌,两者之间既相互促进又互为抑制,两种因子的动态不平衡增加了本实验的难度。本实验种属选取大鼠,相对于免疫学研究较常用的小鼠免疫反应敏感性稍差。对指标的检测采用实时定量PCR、Western blotting两种方法检测巨噬细胞的极化发生,操作方法具有直接、易于分析的优点,相对于国外采用的磁珠分选细胞法,此方法简单,但干扰因素多。后续实验可结合流式细胞术方法检测。因受动物种属来源的限制,测定大鼠来源细胞极化的抗体种类可选择小,本实验选取iNOS、ArgⅠ两个指标,尽管已明确两因子代表两种极化方向,但其敏感性及本实验的方法学是否易于检测出,也是本实验需继续深究的地方。
总之,本研究从巨噬细胞极化方向来研究热射病的治疗具有很大的创新性,同时也是近年来免疫性、代谢性疾病研究新热点。巨噬细胞极化的不平衡与机体内环境的变化相关。即使是已经极化为某一方向的巨噬细胞,当机体内环境发生改变或受到其他因子的刺激时,仍可能向其对立方向发生极化。继续深入研究巨噬细胞极化的发生,对于热射病在炎性反应方面的病理学机制研究有重要意义。进一步通过对巨噬细胞极化的某些关键通路、影响因素等加以干预处理,改变巨噬细胞极化方向,为提高热射病的治愈率、降低病死率,提供新的治疗策略。
