口腔鳞癌组织中KDM4A表达与患者临床病理参数和预后的关系
2018-08-20何海蕾严俊峰王羽刘建伟
何海蕾,严俊峰,王羽,刘建伟
(1赣州市人民医院,江西赣州341002;2南昌大学第一附属医院)
头颈鳞癌指发生于耳鼻喉及口腔颌面部的鳞状细胞癌,总体发病率位居所有恶性肿瘤的第6位,其中,口腔鳞癌是发病率最高的一种恶性肿瘤[1]。据报道,全美境内每年新增约5万例口腔鳞癌患者,约1万例患者因此死亡;而全球范围内,每年新增约30万例,死亡约14.5万例[2]。尽管近年包含外科手术治疗、放疗、化疗及其他辅助治疗手段的口腔鳞癌临床治疗技术取得了长足进步,患者的五年生存率仍未突破50%[3]。一般认为,影响患者预后的主要原因在于不受控制的组织转移与淋巴结转移[4]。组蛋白赖氨酸去甲基化酶(KDM)自2004年被发现以来,已被证明在多种癌症组织中异常表达[5]。近来许多研究将KDM作为肿瘤研究的一个突破口。KDM4A(或被称为JMJD2A、JHDM3A)是一种含有JmjC结构域的去甲基酶,属于KDM4家族[6]。与其他KDM4家族成员相同,KDM4A对特定基因的转录具有促进或抑制的调控作用[7],因此能够参与特定恶性肿瘤的发生与发展。本研究探讨了KDM4A在口腔鳞癌组织中的表达变化及其意义。
1 资料与方法
1.1 临床资料 选取2012年7月~2016年12月赣州市人民医院口腔颌面外科收治的口腔鳞癌患者110例,均术后经病理科确诊为口腔鳞癌。其中,男76例、女34例,年龄26~75岁、中位年龄53.21岁;TNM分期:Ⅰ期46例,Ⅱ~Ⅲ期64例;有淋巴结转移51例,无淋巴结转移59例;肿瘤高分化67例,低、中分化43例,术前未经放、化疗及其他抗肿瘤方式治疗。纳入标准:原发性口腔鳞状细胞癌;术前未经放、化疗及其他抗肿瘤手段治疗;年龄≤75周岁;临床病理资料完整。排除标准:合并其他恶性肿瘤;伴有严重代谢性疾病或全身感染性疾病;严重肝肾功能不全等。另取癌旁正常组织(距离癌组织>5 cm)21例份作为对照。经本院伦理委员会批准,患者及其家属知情同意。
1.2 组织KDM4A表达的检测 采用免疫组化法。将手术切取的标本以4%甲醛溶液固定,石蜡包埋。利用全自动组织芯片仪(MITOGEN@000139)制作石蜡组织芯片。常规4 μm连续切片,装片。采用Envision二步法染色,DAB显色,苏木素复染,以兔抗人KDM4A多克隆抗体Abnova(上海煊翎生物科技有限公司)为一抗,自身为阳性对照;阴性对照采用PBS为一抗。染色结果判定:每份样本取400倍光学高倍镜下4个至少含有100个细胞的不同视野,计分取算术平均数。将免疫组化染色结果按染色、计数分为两部分,其评分标准分别为:染色计分:无色计0分,浅黄色计1分,黄色至浅棕色计2分,棕色计3分;计数计分:<5%计0分,5%~25%计1分,>25%~50%计2分,>50%计3分。计算染色计分与计数计分的乘积,以≤4视为阴性表达,≥6视为阳性表达。
1.3 随访 以患者术后出院为观察起点,结合复诊病历,利用电话、电子通讯等手段对患者及其家属进行随访,随访截止于2017年9月,随访时长9~62(32.78±14.84)个月。
1.4 统计学方法 采用SPSS22.0统计软件。计数资料以频次或百分比表示,比较采用χ2检验,预后评估采用Kaplan-Meier生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 口腔鳞癌组织及癌旁正常口腔黏膜组织中KDM4A表达的比较 口腔鳞癌组织中KDM4A阳性表达率为51.82%(57/110),癌旁正常口腔黏膜组织中KDM4A阳性表达率为9.52%(2/21),两者比较差异有统计学意义(χ2=12.723,P<0.05)。将口腔黏膜癌患者按照KDM4A表达情况分成KDM4A表达阳性组(57例)与KDM4A表达阴性组(53例)。
2.2 KDM4A在口腔鳞癌组织中的表达与患者临床病理参数的关系 口腔鳞癌组织中KDM4A的表达与患者的性别、年龄、吸烟史、饮酒史、肿瘤组织分化程度均无关(P均>0.05),与TNM分期、是否发生淋巴结转移密切相关(P均<0.05)。见表1。
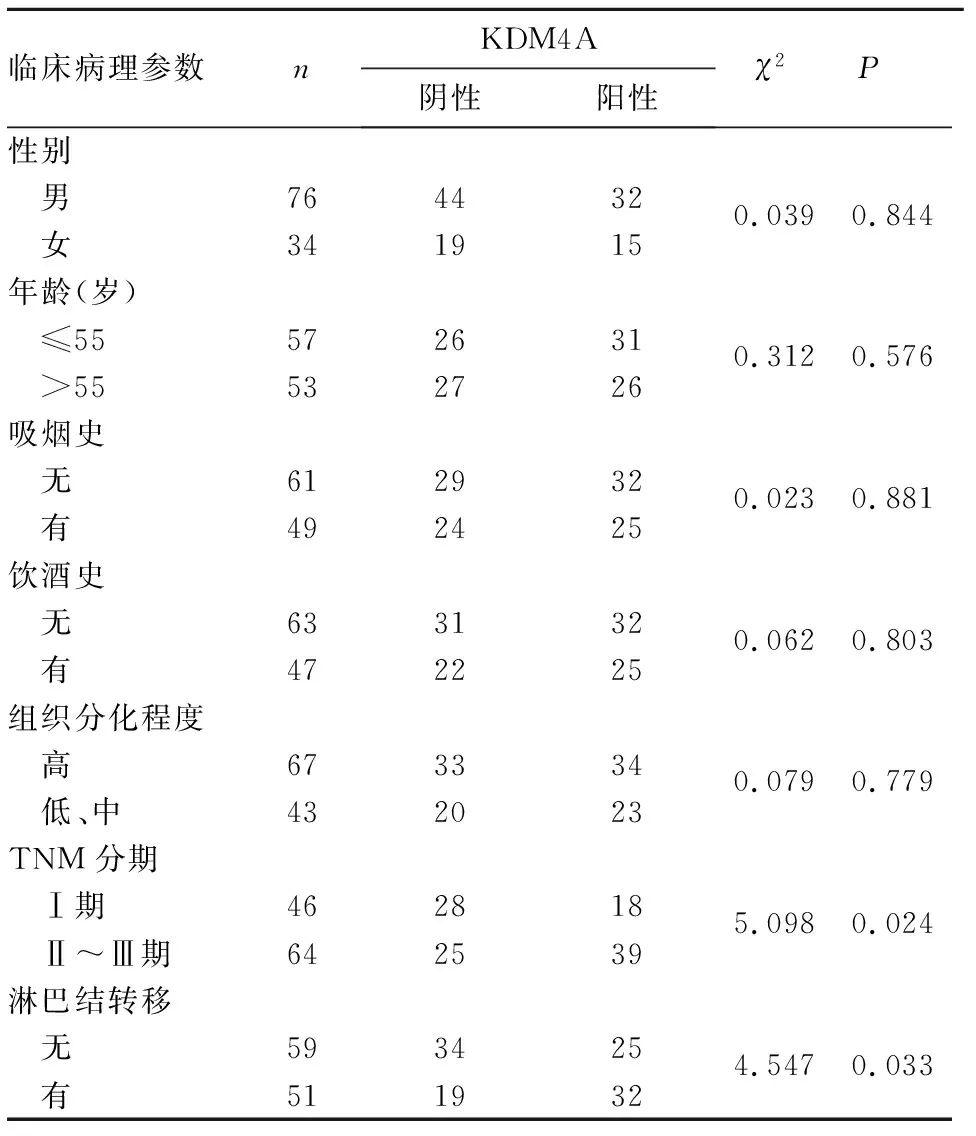
表1 KDM4A在口腔鳞癌组织中的表达与患者临床病理参数的关系(例)
2.3 KDM4A在口腔鳞癌组织中的表达与患者预后的关系 KDM4A表达阴性组患者生存率为60.38%(32/53),平均生存时间为(44.49±2.43)个月;KDM4A表达阳性组患者生存率为17.54%(10/57),平均生存时间为(33.74±2.31)个月。两组生存率与生存时间比较差异有统计学意义(χ2=21.348,P<0.05;t=23.785,P<0.05)。见图1。
3 讨论
口腔鳞癌的发生与多种因素相关,目前已知的重要影响因素有吸烟、酗酒以及HPV感染[8]。由于发生部位的特殊性,对口腔鳞癌的治疗方式选择有限,且实时监控、调整治疗方案的难度非常高。因此找寻口腔鳞癌特异性无创诊断、预后手段可能是改善临床诊疗方案、提高患者预后的一个方向。转录调控因子KDM4A基因所编码的蛋白含有一个复合活性中心,两个PHD锌指结构域,其中PHD锌指结构域的作用尚不明确[9]。目前研究认为,KDM4A通过对H3K9me3的去甲基化作用,使其形成开放染色质状态,使转录因子等更容易接近并结合相应DNA,从而调控基因的转录[10]。而基因的表达异常通常被认为是恶性肿瘤发生与发展的重要因素之一。
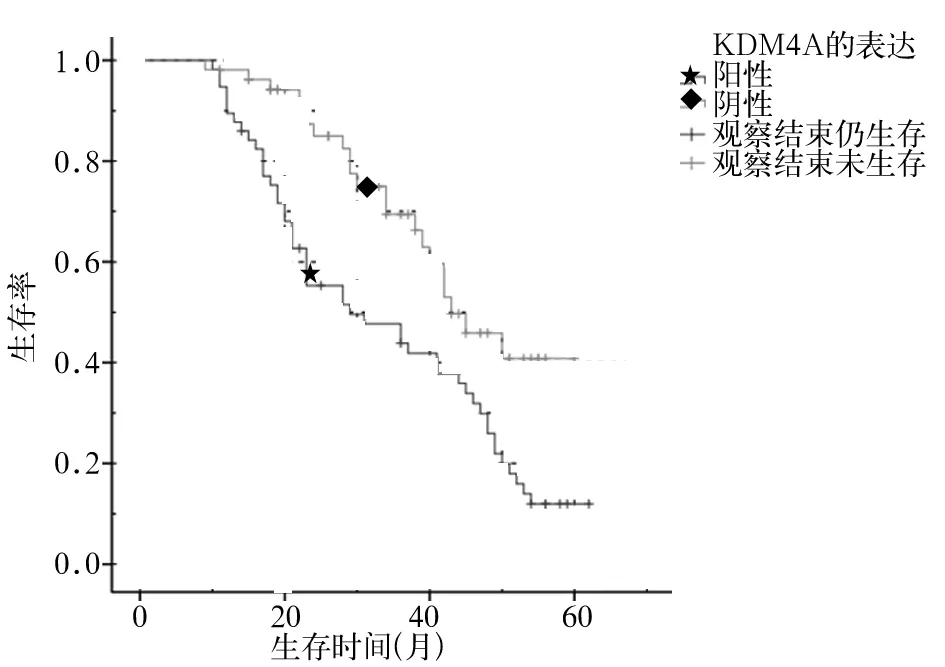
图1 KDM4A表达阳性组与阴性组患者的生存曲线
Chu等[11]发现,KDM4A在前列腺癌中明显表达异常,当研究者用特异性小分子阻断剂抑制KDM4A表达时,前列腺淋巴结癌细胞呈现出增殖抑制与凋亡增加现象。后续的研究[12]表明,当KDM4A被特定的shRNA敲除,前列腺细胞的增殖受到明显抑制,而细胞凋亡则显著增加,但这种效应并不表现于永生化的前列腺上皮细胞。Qiu等[13]对子宫内膜癌组织的研究表明,KDM4A在子宫内膜癌组织中的表达也异常提高,且与雄激素受体的表达在低雄激素细胞系中呈正相关。Li等[14]发现,KDM4A在导管癌组织中的表达异常升高,且其表达与p53、雌激素受体的表达正相关。而在与性激素无关的恶性肿瘤,例如肝癌[15]、非小细胞肺癌[16]等,KDM4A同样出现表达异常升高的现象。因此,KDM4A能够参与调控性激素信号通路依赖性基因与非性激素信号通路依赖性基因。研究[17]表明,KDM4A至少能影响细胞周期素D1与c-Jun两种癌基因的表达。
本研究发现,KDM4A在口腔鳞癌组织中的表达异常升高,这表明KDM4A同样能够影响与口腔鳞癌发生、发展相关的癌基因。而KDM4A表达仅与患者的TNM分期、淋巴结转移相关,表明KDM4A对口腔鳞癌组织中肿瘤细胞可能具有与前列腺癌细胞类似的作用,即促进其增殖、转移,从而增强肿瘤细胞的侵袭力。KDM4A表达与肿瘤细胞的组织分化程度无关,提示KDM4A并不参与细胞的分化。KDM4A表达与患者的性别无关,则表明KDM4A在口腔鳞癌中影响的癌基因与性激素信号通路无明显相关性。KDM4A表达与通常认为的致癌因素如烟、酒无关,则表明其影响的基因受烟酒影响较小。本研究后续对患者的随访结果表明,KDM4A表达阳性组的患者预后差于阴性组患者,提示对于KDM4A表达阳性患者,后续应加强监测,适当配合放疗、化疗等其他治疗手段以提高患者预后;而对于KDM4A表达阴性患者,则应在保持复诊的同时,适当减少其他抗肿瘤手段,以减少放疗、化疗等治疗方式的不良作用带给患者的生理与经济负担。
综上所述,本研究发现,KDM4A在口腔鳞癌组织中异常高表达,其表达与患者TNM分期、淋巴结转移密切相关。同时KDM4A表达阳性患者的预后较差,提示应对患者加强后续治疗以改善患者预后。因此KDM4A有望成为口腔鳞癌诊断与预后的肿瘤标记物,参与改进临床诊疗方案。
