富血小板血浆对兔膝骨关节炎模型基质金属蛋白酶-9的影响
2018-08-18刘艳西湖北科技学院湖北咸宁437100湖北科技学院第一附属医院咸宁市中心医院湖北咸宁437100
赵 泉,刘艳西,吴 剑 (1.湖北科技学院,湖北 咸宁 437100;2.湖北科技学院第一附属医院,咸宁市中心医院,湖北 咸宁 437100)
骨性关节炎(Osteoarthritis OA)的致病机理尚未完全明了,但有关软骨基质的降解已得到共识,目前认为与基质金属蛋白酶-9(MMP-9)有关。它能够特异性的裂解软骨基质中的胶原分子,破坏软骨基质的胶原网络,使软骨细胞暴露于炎性因子的攻击下进而出现凋亡[1]。富血小板血浆(platelet rich plasma,PRP)应用于临床和基础的研究越来越多,其对多种类型细胞损伤的治疗作用良好,有实验研究表明PRP对软组织损伤的愈合、韧带和骨/软骨的再生、炎性反应的消退有促进作用[2-3]。笔者前期研究发现PRP可降低骨关节炎动物模型中IL-1β[4]含量。然而,PRP在退行性炎性反应的软骨细胞中的作用仍不清楚。本文通过观察富血小板血浆对兔膝骨关节炎模型MMP-9的影响,探讨其关节软骨保护作用机理。
1 材料与方法
1.1 主要仪器和试剂:注射用青霉素(生产商:华北制药股份有限公司);氯胺酮注射液(生产商:福建古田药业有限公司)。MMP-9检测试剂盒(生产商:武汉博士得生物有限公司),MMP-9抗体、山羊抗兔HRP二抗(生产商:上海碧云天生物有限公司),Olympus光学显微镜(生产商:日本奥林巴斯公司);RM2315切片机(生产商:德国Leica公司);透射电子显微镜(生产商:日本日立公司)。
1.2 富血小板血浆的制备:整个制备过程严格无菌操作,使用10 ml带19号针头无菌注射器抽取1 ml 10%枸橼酸钠润管行新西兰大白兔(万千佳和实验动物有限公司,合格证号:0001647)耳缘静脉穿刺,抽取血液至10 ml。将血液分别放入15 ml离心管,按Aghaloo法提取富血小板血浆[5],即第1次离心215×g 10 min,取离心后白膜层以上血浆置于另一离心管,进行第2次离心,条件为863×g 10 min,收集上清即贫血小板血浆,移至另一离心管中,剩余0.8 ml吹打均匀即富血小板血浆[(1 958.33±316.41)×109/L],-80℃冰箱分装保存备用,每只兔可提取富血小板血浆(9.6±0.4)ml。
1.3 动物及分组:36只4~5个月龄新西兰大白兔(武汉市万千佳禾实验动物养殖有限公司,合格证号:0001647),体重2.5~3.0 kg,雄雌各半。随机将36只大白兔分为对照组、模型组和PRP组(n=12)。按10 mg/kg氯胺酮麻醉后,模型组、PRP组左膝关节行改良Hulth术造模,即行膝内侧4 cm的纵行切口,探查膝关节无原发病变后切断前后交叉韧带和内侧副韧带,完全切除内侧半月板,勿损伤软骨面,彻底止血,生理盐水冲洗关节腔,行抽屉试验阳性后逐层缝合关节囊、皮肤,无菌纱布包扎,不予固定;对照组仅打开关节腔,不损伤韧带和半月板,缝合皮肤。术后每天肌内注射青霉素40万U/kg,隔天伤口换药,观察伤口情况,连续7 d预防感染。根据超疲劳活动易提前出现OA的发病特点[6],手术后1周,强迫动物每天活动30 min,分两次驱赶,4周后即可获得典型的OA模型。术后第5周开始,PRP组0.5 ml PRP关节腔注射;对照组、模型组关节腔内注射等量生理盐水,连续注射6周。
1.4 样本获取及指标检测
1.4.1 免疫组织化学检测软骨及滑膜组织中MMP-9表达量:取股骨内髁软骨修成0.2 cm×0.3 cm×0.3 cm的全层软骨,10%甲醛固定,系列脱水、脱钙,石蜡包埋,切片,按免疫组织化学试剂盒方法检测软骨中MMP-9的表达情况,随机选取5个高倍视野下软骨细胞及滑膜细胞中MMP-9阳性细胞数与总细胞数的比值,即阳性细胞分数,并利用图像分析测量软件Imagepro-plus计算平均积分光密度值。
1.4.2 关节液及血清中MMP-9含量的测定:造模关节脱毛,酒精消毒,5 ml注射器行关节腔穿刺,关节腔注入1 ml无菌生理盐水,反复冲洗后抽出,装于2 ml离心管中,90 000×g下离心15 min,取上清待检;取耳中静脉血液,盛于5ml离心管中,90 000×g下离心15 min,取血清待检。按试剂盒检测方法检测关节液及血液中MMP-9含量。
对软骨与滑膜中MMP-9的阳性细胞分数进行相关性分析,对关节液中与血清中MMP-9含量进行相关性分析。
1.5 统计学分析:采用SPSS11.9软件进行统计检验,计量资料用均数±标准差()表示,各组间关节软骨及滑膜细胞中阳性细胞数及平均积分光密度的比较采用单因素方差分析,关节液及血液中MMP-9含量采用两两比较q检验,相关性采用Spearman进行检验。P<0.05为差异有统计学意义。
2 结果
2.1 软骨组织中基质金属蛋白酶-9的表达量:对照组软骨细胞只见标本表层极个别阳性细胞,见图1A,PRP组软骨标本的4层结构中,可见到少量胞浆染成深棕色的阳性细胞,见图1B。模型组软骨标本的4层结构中,均可见到胞浆染成深棕色的阳性细胞,见图1C。各组软骨细胞中阳性细胞分数平均积分光密度值,见表1。
表1 各组软骨MMP-9表达情况()

表1 各组软骨MMP-9表达情况()
注:与模型组比较,①P<0.05
组别 阳性细胞分数(%) 平均积分光密度(aIOD)对照组 15.61±1.23① 0.09±0.02①PRP组 22.39±2.09① 0.13±0.04①模型组71.65±3.25 0.50±0.08
2.2 滑膜组织中基质金属蛋白酶-9的表达量:对照组滑膜MMP-9仅在少数滑膜细胞中分布,染色淡,散在分布,见图2A。PRP组中少数滑膜细胞组织可见散在分布的淡染的阳性细胞,在关节囊的滑膜下层偶尔见到少数阳性细胞,染色均浅,见图2B。而模型组滑膜细胞层存在有大量阳性细胞,染色较深,聚集现象明显,滑膜下层也可见到大量阳性细胞,染色较试验组深,甚至可见到染成深褐色的强阳性滑膜细胞,见图2C。各组关节滑膜MMP-9含量的平均积分光密度与阳性细胞分数详见表2。
2.3 各组动物关节液中MMP-9浓度测定:显示对照组为(22.51±1.21)ng/ml,PRP组和模型组关节液中MMP-9浓度分别为(45.63±2.96)ng/ml与(84.48±2.36)ng/ml,PRP组与模型组比较,差异有统计学意义(P<0.05),PRP组与对照组比较,差异有统计学意义(P<0.05),见图3A。对各组动物血清中 MMP-9浓度测定显示对照组为(4.37±1.32)ng/ml,PRP组和模型组关节液中MMP-9浓度分别为(9.87±1.52)ng/ml与(18.82±2.38)ng/ml,PRP 组与模型组比较,差异有统计学意义(P<0.05),PRP组与对照组比较,差异有统计学意义(P<0.05),见图3B。
2.4 相关性分析:软骨与滑膜中MMP-9的阳性细胞分数高度相关,差异有显著统计学意义(P<0.01),见图4A,关节液中与血清中MMP-9含量成高度正相关,差异有显著统计学意义(P<0.05)。见图4B。
表2 各组滑膜中MMP-9表达情况()
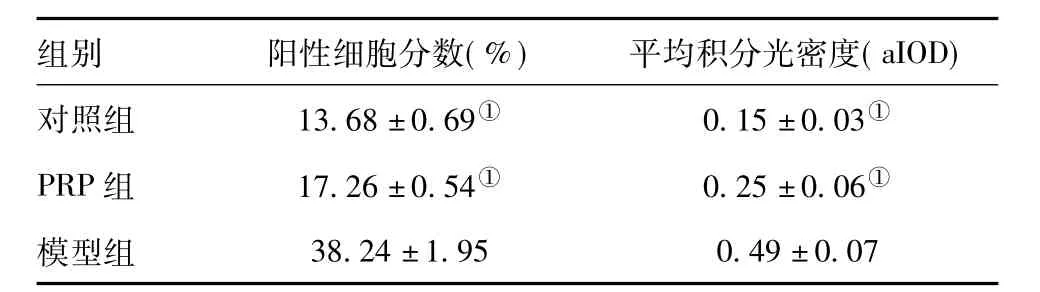
表2 各组滑膜中MMP-9表达情况()
注:与模型组比较,①P<0.05
组别 阳性细胞分数(%) 平均积分光密度(aIOD)对照组 13.68±0.69① 0.15±0.03①PRP组 17.26±0.54① 0.25±0.06①模型组38.24±1.95 0.49±0.07
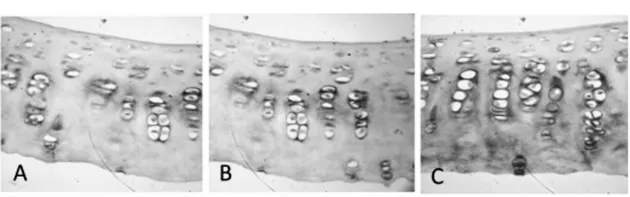
图1 图A:对照组软骨细胞MMP-9免疫组化染色(400×);图B:PRP组软骨软骨细胞MMP-9免疫组化染色(400×);图C:模型组软骨细胞MMP-9免疫组化染色(400×)

图2 图A:对照组滑膜组织MMP-9免疫组化染色(400×);图B:PRP组滑膜组织MMP-9免疫组化染色(400×);图C:模型组滑膜组织MMP-9免疫组化染色
3 讨论

图3 图A:各组动物关节液中MMP-9浓度,与对照组比较①P<0.05,与模型组比较②Pp<0.05;图B:各组动物血清中MMP-9浓度,与对照组比较③P<0.05,与模型组比较④P<0.05
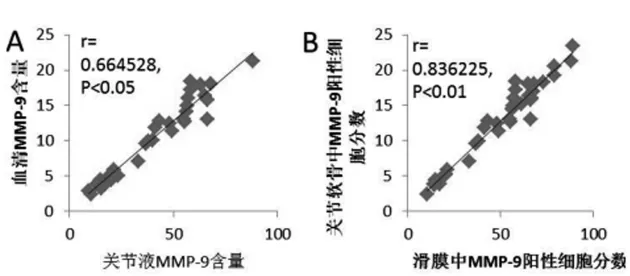
图4 图A:各组动物关节液与血清中MMP-9浓度成高度正相关(P<0.05);图B:各组动物关节软骨与滑膜组中MMP-9阳性细胞分数成高度正相关(P<0.01)
骨性关节炎(Osteoarthritis OA)的发病机制尚未完全明了,但有关软骨基质的降解已得到共识[7]。关节软骨属于一种无血管、神经及淋巴分布的透明软骨,由软骨细胞与软骨基质组成,基质主要为蛋白多糖和糖蛋白形成的固相结构,胶原纤维存在其中,构成网架结构,从而赋予关节软骨的力学特征,基质结构特征和含量的任何异常,将导致关节炎的发生[8]。目前研究证实骨关节炎的主要病理学特征之一是软骨细胞外基质的降解,而基质的降解与基质金属蛋白酶-9(Matrix metalloproteinases-9,MMP-9)有关。MMP-9对蛋白聚糖有高度的裂解活性,在实验性OA的早期,MMP-9可降解Ⅺ型胶原,可能与OA早期胶原网络水肿有关。MMP-9除能直接降解蛋白多糖的核心外,还可激活MMP-1,加速胶原的病理性降解,也使与透明质酸相连的可聚蛋白多糖由于网络的松解而丢失[9]。MMP-9能够特异性裂解软骨基质中的胶原分子,破坏软骨基质的胶原网络,使软骨细胞暴露于炎性因子的攻击下而出现凋亡,导致软骨的进行性破坏[10]。本实验中应用免疫组织化学研究发现模型组关节软骨的4层结构中,软骨细胞均可见到胞浆染成深棕色,阳性细胞明显增多,阳性反应强烈,颗粒甚至呈深褐色,还可见表层软骨大量的缺损。本实验还发现MMP-9在滑膜组织中也存在高表达,这与现有的研究发现骨关节炎中高表达MMP-9的结论是一致的。
PRP含有大量的生长因子,其丰富的生长因子中血小板源性化生长因子(platelet derived growth factor,PDGF)、细胞表皮生长因子(EGF)和转化生长因子(transforming growth factor-β,TGF-β)的含量分别为正常血液的30倍、10倍和7倍。研究发现PRP中的生物活性生长因子能有效促进骨缺损的修复,其主要机制是在骨缺损局部的微环境中释放一些生物活性成分[11]。PRP能促进软骨损伤的修复、促进骨折愈合,其机制可能是与其对干细胞间充质干细胞和成软骨细胞具有多向分化潜能的生物学特性有关[12]。随着基础生物医学与临床研究的发展,PRP在组织再生工程、软骨以及软组织修复再生等方面有着良好的生物学效应,用其来干预骨关节的病程有着较为理想的前景[13]。MMP-9抑制软骨糖蛋白的合成,促进成纤维细胞合成和基质微分子的降解,加重软骨的损伤。关节内局部高表达的MMP-9可能与其影响软骨细胞增殖、软骨损伤的反应性和增强关节炎性反应有关[14]。本实验结果显示PRP组机体内MMP-9的含量较模型组显著降低,软骨细胞破坏程度明显减轻,说明PRP可通过降低机体内MMP-9的含量,而起到保护关节软骨的作用。目前OA尚无有效的防治方法,因为很少有药物能改变OA进程。笔者的研究表明PRP能明显降低MMP-9的含量,可起到保护软骨细胞的作用。
本实验在动物模型关节腔注射PRP 6周后,PRP组关节软骨和滑膜组织中MMP-9含量较模型组减少,而与对照组比较差异有统计学意义(P<0.05),说明PRP只能延缓病程进展而不能逆转OA的病变进程。模型组兔患侧关节液中MMP-9含量明显高于对照组,目前研究表明MMP-9对关节软骨基质具有破坏作用,导致软骨细胞的凋亡增多[15]。笔者的研究结果与目前的研究是一致的。在本研究中对各组动物关节液中的MMP-9浓度进行了测定,结果显示对照组关节液中MMP-9浓度低于PRP组和模型组,PRP组关节液中MMP-9浓度明显低于模型组,差异有统计学意义(P<0.05)。本研究进一步分析了各组动物血清中MMP-9的浓度,也发现了类似关节液中MMP-9的检测结果。且血清和关节液中MMP-9含量成高度正相关,这说明骨关节炎不单是一个局部关节的病变,在全身血清中都有MMP-9存在,只是病变局部关节其浓度明显增高而已,这或许为以后MMP-9抑制剂治疗骨关节炎提供了一定的参考理论基础。
