基于别构调节机制的HIV-1整合酶抑制剂研究进展
2018-08-15邢杨叶飞杨琳张维苏希鹏刘冰冰
邢杨,叶飞,杨琳,张维,苏希鹏,刘冰冰
作者单位:100067 北京市安全生产科学技术研究院职业卫生研究中心
人类免疫缺损病毒(human immunodeficiency virus,HIV)通过入侵人类免疫系统,破坏防御体系,杀死免疫系统细胞,致使被感染者患上获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)。自 1981 年艾滋病被首次发现以来[1],其传播速度越来越快、传播范围越来越广。2017 年联合国艾滋病规划署(The Joint United Nations Programme on HIV and AIDS,UNAIDS)统计显示,全世界范围内艾滋病患者已达 3700 万人,其中接受抗逆转录病毒治疗的患者达 2100 万人,新增艾滋病患者达 180 万人[2]。由于 10% ~ 60% 的艾滋病病毒感染者在初期并未显现任何症状,大部分病毒携带者并未意识到已感染艾滋病病毒。美国疾病预防工作小组针对此问题建议对艾滋病病毒携带者及感染者进行全面筛查,其中包括青年人、老年人及孕妇[3],进而降低病毒扩散速度,尽早防范艾滋病的传播。
HIV 在体内复制包括感染、逆转录、整合、转录和包装五个过程。首先,HIV 与宿主辅助性 T 细胞表面融合并进入细胞,破裂释放 2 个核糖核酸(RNA)和 3 种酶(逆转录酶、整合酶和蛋白酶);HIV 通过逆转录酶将其 RNA信息复制到 DNA;整合酶将病毒双链 DNA 整合至宿主细胞染色体的 DNA 链中,形成前病毒基因,并通过宿主RNA 聚合酶形成一条新的 RNA 链。HIV 感染过程所需的3 种酶中,HIV-1 整合酶对病毒 DNA 整合到宿主细胞DNA 起重要作用。研发整合酶抑制剂成为治疗艾滋病及抑制病毒传播的重要方法。近年来陆续有研究表明整合酶抑制剂对治疗艾滋病有较好作用。别构抑制剂是通过改变酶分子构象起到抑制酶活的作用。通过总结基于别构调节机制的HIV-1 整合酶抑制剂研究进展,将有助于新型整合酶抑制剂的开发及艾滋病职业暴露风险评估研究。
根据 HIV-1 整合酶的作用可开发防御 HIV-1 药物。在过去的 20 年中,已发现许多 HIV-1 整合酶抑制剂[4-5]。长期服用一类药物,病毒易产生交叉耐药性,亟需开发新型化学疗法来抑制病毒对人体的侵袭。1996 年,美籍华裔科学家何大一提出高效抗逆转录治疗方法。该方法通过联合使用3 种或 3 种以上的抗病毒药物来达到治疗艾滋病的目的。它弥补了单一用药产生的抗药性的缺点,可最大限度抑制病毒复制,从而部分甚至全部恢复机体免疫功能,延缓病程,延长患者生命,提高生活质量[6]。2010 年,Nature刊登了一篇关于 DNA 链转移抑制机制的文章,它揭示了 HIV-1整合酶在艾滋病病毒复制整合的作用过程[7]。2012 年,Bojja等[8]研究了 HIV-1 整合酶多聚体的分子聚合形态,对后续开发新型整合酶抑制剂具有重要意义。整合酶结构及作用机制的发现促进了整合酶分子别构调节机制的研究。近年来,关于整合酶多聚体的定向转化调节及别构抑制剂的研发受到研究者的广泛关注。本文对近年来关于 HIV-1 整合酶结构及基于别构调节机制的 HIV-1 整合酶抑制剂研究情况进行总结。
1 HIV-1 整合酶结构
HIV-1 整合酶蛋白质分子量为 32 kD,其蛋白质分子链分为三个区域,即 N 端结构域(NTD)、核心结构域(CCD)和 C 端结构域(CTD)。HIV-1 整合酶分子存在多种聚合形式,有二聚体分子、四聚体分子、八聚体分子和高聚体分子。整合酶的三个结构域对多聚体的形成及 DNA 对整合酶吸附具有重要作用。一般来说,重组蛋白溶解性较差,很难获取原子水平的重组蛋白结构的相关信息。研究者们通过选取蛋白质分子结构中的单一区域或两个区域进行研究。2010 年科学家通过解析吸附在 DNA 链端的原型泡沫病毒整合酶结构来研究 HIV-1 整合酶分子结构[7]。研究发现HIV-1 整合酶多聚体分子中起催化整合作用的主要是四聚体分子。研究发现整合酶四聚体分子是通过两个整合酶二聚体分子聚合而成。此发现为开发别构调节抑制剂提供理论依据[8]。
研究酶的活性位点是进行生物酶动力学研究的第一步。HIV-1 整合酶分子中存在多类活性位点,如:链转移和3'-加工端反应的活性位点,影响因子 LEDGF/p75 及链转移抑制物结合的位点。此外,研究者们发现整合酶存在可供不同小分子吸附的结合位点。Wielens 等[9]发现一类小分子的结合位点,此位点包含残基 Tyr83、Try108、Asn184、Ile200和 Val201。Wielens 等[10]发现可吸附蔗糖分子的活性位点,残基包含 Asp64、Asp116、Asn144、Gln146、Gln148 和Glu153。
2 HIV-1 整合酶催化机制
HIV-1 整合酶将 HIV 的基因整合到宿主细胞 DNA链上,主要发生两类亲核反应:3'-终端过程和链转移过程[11]。不同的反应过程中,HIV-1 整合酶分子结构多聚体形态发生变化。3'-终端反应过程发生在细胞质中,两个二聚体整合酶分子分别吸附在病毒双螺旋 DNA 分子链的 3'-端,催化脱除 2 个二核苷酸分子,使活性基团羟基暴露出来,形成预整合混合物。链转移过程发生在细胞核中,吸附在病毒DNA 链两端的整合酶二聚体分子相互聚拢,形成一个新的四聚体整合酶分子。在 LEDGF/p75 作用下,整合酶切断目标 DNA 链,催化病毒 DNA 整合到宿主 DNA 链上。最后,通过宿主蛋白酶修复 DNA 链的连接端并完成 DNA序列复制,形成一条含有病毒 DNA 的分子链。在病毒基因复制过程中,整合酶的多聚体形态变化起到了重要作用。因此,可以通过干预整合酶多聚体构象变化,添加某种抑制剂定向转化多聚体,从而达到抑制整合酶催化作用。

图 1 可能存在的整合酶结合形式(白点代表核心结构域上的活性位点)
3 别构调节剂
3.1 多聚体的形成
游离在溶液中的整合酶分子存在二聚体与四聚体相互转化的动态平衡[12]。整合酶的聚合形式因分子浓度变化而变化。100 ~ 200 nmol/L 浓度下,游离状态的整合酶主要以四聚体形式存在于溶液当中。当蛋白质浓度高于 250 nmol/L时,整合酶分子易发生絮凝[13]。四聚体整合酶-DNA 混合物的形成条件是 DNA 两端的二聚体整合酶分子相互聚拢,而游离的四聚体并不会吸附在病毒 DNA 链的两端[14]。可见,病毒 DNA 两端吸附二聚体整合酶对 3'-端过程反应起重要作用,而 DNA 两端吸附的四聚体对随后的整合过程至关重要[15]。病毒 DNA 长末端重复序列可诱导病毒 DNA分子与二聚体整合酶的吸附。由于 DNA 主要与二聚体相互作用,在二聚体与四聚体动态平衡中,DNA 的存在会使体系中二聚体含量升高。HIV-1 整合酶从多聚体转化成为二聚体,同时伴有 DNA 的吸附反应。
链转移反应需要影响因子 LEDGF/p75 的参与,它可激活体内或体外细胞中吸附在 DNA 两端的整合酶形成四聚体,并绑定其共同进入宿主的染色体内。研究如何抑制链转移反应或整合酶的聚合的过程成为开发新药物的主要途径。介于 LEDGF/p75 对病毒入侵人体细胞的重要作用,IN-LEDGF/p75 也成为开发新型抗 HIV-1 药物的研究热点。LEDGF/p75 分子结构包含两个结构域,即 N-terminal Pro-Trp-Trp-Pro 结构域(PWWP)和整合酶吸附结构域(intergrase-binding domine,IBD)[16]。其中,IBD 结构域可促进 LEDGF/p75 与整合酶的吸附。
3.2 酶分子聚合形式
蛋白质基本结构单元间的连接方式有以下几种:结构域交换、非共价和共价连接。Bojja 等[8]发现 HIV-1 整合酶存在两类二聚体的结合形式,延伸二聚体和核心区结合二聚体。延伸二聚体的结构稳定性主要靠分子的两个基本结构单元的结构域紧密结合形成,这种结合包含两个方面,一方面是两个基本结构单元中的其中一个单元的 C 端结构域、N 端结构域与另一个单元的催化核心区域紧密结合,另一方面是两个结构单元的 C 端结构域紧密结合(图 1)。另一种结合叫核心区结合,主要是通过两个结构单元中核心结构域的紧密贴靠稳定分子结构。以上所提到的单个结构单元和二聚体的结合形式已在禽肉瘤病毒的单分子结构和二聚体结构中发现并报道过。在原型泡沫病毒的结晶结构中也曾发现过含有由核心结构域紧密结合而形成的二聚体结构。
整合酶四聚体分子结构如图 2 所示。由于 N 端结构域与核心结构域间的疏水作用,延伸二聚体存在区交换现象。为了获得更大的疏水结构区,N 端结构域与其他二聚体的 N 端结构域结合,形成以核心域与核心域相互作用的四聚体酶分子(图 2)。
酶是一类具有催化作用的蛋白质分子,其四级结构对蛋白质的活性起重要作用。蛋白质分子构象的稳定性与其生物学活性息息相关,外界温度和 pH 对蛋白质分子结构影响也较大。别构调节是指通过诱导蛋白质构象变化而抑制蛋白质分子活性[17]。基于蛋白质分子的这一特性研发的酶抑制剂叫作别构调节剂[18]。关于别构酶的催化动力学模型主要有 MWC(Monod-Wyman-Changeux)、KNF(Koshland-Nemethy-Filmer)和 Morpheein 模型。其中,MWC 模型由 Monod 等[19]提出。此模型适用于酶分子结构单元存在两种构象,同种构象的蛋白质结构单元可形成一个酶分子,并且两种不同构象的酶分子之间可以相互转化,底物可吸附在任一种状态的结构单元上。KNF 模型适用条件:一个酶分子的结构单元会在活性和非活性两种状态下转变,即一个酶分子中可同时存在两种状态的结构单元,且底物特异性地吸附在具有活性的结构单元上。Morpheein 模型(图 3)是研究异构酶动力学的重要模型之一,它描述了酶分子四级结构异构体相互转化的情况[20]。如图 3A 所示,酶的某种构象的结构单体可转化成另一种构象的结构单体。不同的单体又可进一步形成新的多聚体。反应的底物即可吸附于单体,也可吸附于多聚体。利用 HIV-1 整合酶构象变化研究新型抑制剂的研究方向受到广泛关注[21]。已有研究表明 HIV-1 整合酶分子存在二聚体与四聚体的形式。通过调节整合酶多聚体平衡,定向促进二聚体向四聚体转化,进而减弱游离的整合酶与 DNA 相互作用能力。此类机制下酶的动力学研究可运用 Morpheein 模型进行分析[22]。
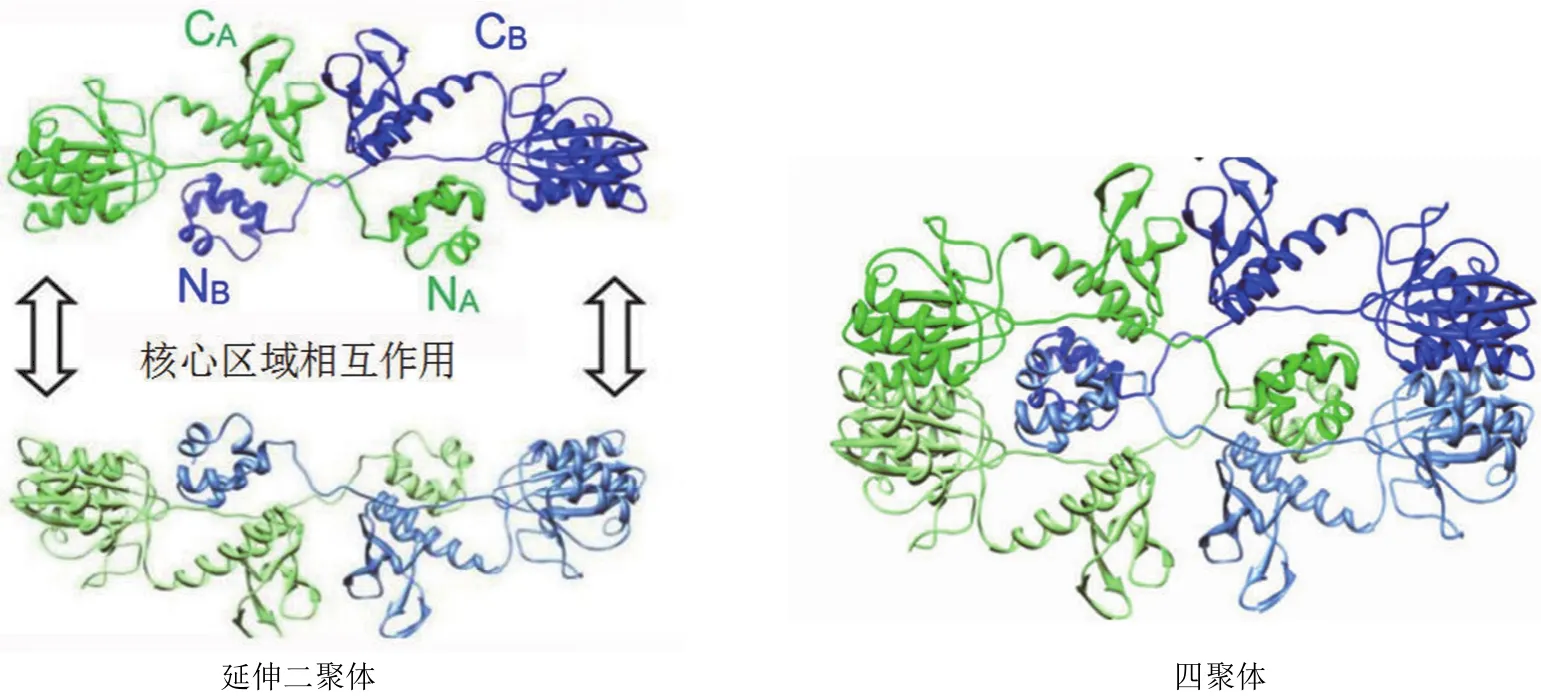
图 2 二聚体与四聚体的结构

图 3 Morpheein 模型
3.3 多肽小分子类抑制剂
根据 HIV-1 整合酶的催化特性,研究者们发现了一种可吸附于 HIV-1 整合酶四聚体上的多肽小分子[23-24],这是首次发现可以利用小分子来调节整合酶核心催化域与影响因子间的相互作用,进而抑制整合酶的催化活性。
有研究表明从 LEDGF 中截取的肽可以吸附在 HIV-1整合酶上,并抑制整合酶的活性。这类抑制物主要吸附在四聚体的核心域结合处,稳定整合酶的四聚体结构[25-26]。随着抑制剂的加入,整合酶二聚体分子不断转化为四聚体分子。由于游离的整合酶四聚体分子是不能催化病毒 DNA 整合反应,从而抑制病毒 DNA 对高活性的整合酶二聚体分子的吸附[27]。可见小分子肽也被叫作变构抑制剂或转换肽,可调节酶的活性状态与非活性状态间的转换平衡。目前,大部分研究小分子肽吸附整合酶的过程主要采用 Hill 方程进行分析。Morpheein 模型(图 3B)也可用于整合酶的动力学研究。相比于传统的 Morpheein 模型,整合酶的Morpheein 模型是多聚体间的直接转化,而不需要中间不同构象单体的转化。研究者们还从逆转录蛋白酶中成功提取小分子肽,并应用于抑制整合酶的活性研究当中。研究发现逆转录蛋白中提取的小分子肽同样可调节整合酶多聚体的动态平衡,促进整合酶的活性态向非活性态转化。2017 年8 月,一份关于 peptide 的专利被成功授权,可成功分离peptide 并用于 HIV/AIDS 的治疗[28]。
3.4 喹啉乙酸类抑制剂
Kessl 等[29]研究了两种喹啉乙酸类物质对 HIV-1 整合酶与 LEDGF 相互作用的影响。研究发现此类物质有助于整合酶多聚体的形成。喹啉乙酸类物质浓度越高,越有利于形成整合酶多聚体。2016 年俄亥俄州立大学研究者们探讨了含有吲哚结构的整合酶抑制剂的作用[30]。他们采用骨架迁越方法合成一系列变构 HIV-1 整合酶抑制剂。结果表明这类物质可以吸附在整合酶二聚体分子间的结合面,也是吸附 LEDGF/p75 的活性位点,进而调节整合酶的多态性,抑制整合酶活性。
4 展望
别构抑制剂的添加实现了 HIV-1 整合酶蛋白质分子定向转化为四聚体,可有效抑制 DNA 与 HIV-1 整合酶的相互作用。别构调节剂通过吸附 LEDGF 的结合位点或稳定四聚体构象,达到调节 HIV-1 整合酶分子构象,抑制整合过程的发生。继续研究蛋白质分子构象对开发新型药物具有重要的作用。目前绝大多数关于 HIV-1 整合酶的研究采用Hill 方程,此方法可推算出蛋白质分子结构单元数,但无法获取蛋白质在催化过程中的构象变化的相关信息。基于HIV-1 整合酶的分子结构特点,未来可采用 Morpheein 动力学模型研究 HIV-1 整合酶动力学及其构象变化,筛选最佳治疗艾滋病的药物。
