表观遗传学对肿瘤干细胞及其耐药性的影响
2018-08-15邹庚艺张晓彤李惠霞
邹庚艺,张晓彤,李惠霞
作者单位:300071 天津,南开大学医学院(邹庚艺、张晓彤);300060天津医科大学肿瘤医院国家肿瘤临床医学研究中心/天津市肿瘤防治重点实验室/天津市恶性肿瘤临床医学研究中心(李惠霞)
现如今,肿瘤仍是危害人类健康的重大疾病,对于肿瘤的起源主要有两种观点,即克隆形成学说和肿瘤干细胞模型。后者认为肿瘤是由一群包含各种表型和生物学特征的细胞组成,这些细胞具有很强的异质性[1],肿瘤形成的关键在于其中一小部分类似于成体干细胞的肿瘤细胞,它们分化程度低,致瘤能力强,具有自我增殖及多向分化的潜能,被称为肿瘤干细胞(cancer stem cells,CSCs)[2-4]。肿瘤干细胞与肿瘤的复发、进展有着密不可分的联系。其中重要的特性莫过于细胞可长期处于静息状态,肿瘤干细胞的细胞间期延长,化疗药物不能对其产生杀伤作用,当其进入分裂期的时候,会导致肿瘤复发。本文主要关注表观遗传学对肿瘤干细胞的分裂、自我更新以及扩散的影响。
1 肿瘤干细胞的来源与特征
有假说认为,肿瘤干细胞的起源是由于成体干细胞的突变以及错误的信号调节造成的。位于器官组织中的成体干细胞可以维持静息期,这对肿瘤干细胞的产生有着一定的助力[5]。近年来,不断有研究表明,肿瘤干细胞是由于成体干细胞基因错配而形成,同时肿瘤干细胞又保留了成体干细胞无限增殖的特性[6]。祖细胞是一种来源于干细胞的早期分化类型,相较于干细胞它有更为定向的细胞特征,比如较低的自我更新能力以及有限的复制性[7]。关于祖细胞的特性,很多研究显示其可以分化成为肿瘤干细胞。一个正常的祖细胞,经过诱导后可以分化成多种家系的肿瘤干细胞[8]。另一个关于肿瘤干细胞起源的说法是,体细胞可以作为肿瘤的起源细胞,这种说法首先在 Mintz 等[9]的实验中被证明,他们通过向 6 d 胎龄的小鼠胚胎中注射早期发育畸形的胚胎细胞,证明肿瘤早期可以来源于体细胞的突变。最近关于体细胞细胞核的基因重排可以发育成为诱导多能干细胞(induced pluripotent stem cells,iPSCs)的发现也同样可以证明这一假说[10]。
尽管关于肿瘤干细胞来源的方式说法不一,但是这两种理论的走向是基本一致的。无论是肿瘤始动细胞或是肿瘤干细胞,不考虑它们的来源方式,只观察其细胞功能可以发现,它们都具有自我更新的能力,可以进行自我复制,同时不会失去肿瘤的异质性。众多的肿瘤干细胞使得肿瘤组织不断地增生繁殖,从一个小的亚群,逐渐发展并占据大部分组织。
众所周知,正常的成体干细胞的主要功能就是为其所在的组织提供分化的最终产物——能够维持组织稳定性及功能的体细胞。和正常的成体干细胞一样,肿瘤干细胞的存在也是为了能够保持肿瘤组织无限的增殖和自我更新,同时分化成为具有特定功能的细胞表型。对于这类肿瘤干细胞,科研人员们有着这样的定义:肿瘤干细胞是一类能够致癌的细胞群,它们对于肿瘤的发生发展有着重要的作用,同时可以维持、调控肿瘤的固有特性,例如细胞的静息期、无限制的自我更新、对化疗和放疗的内在抗性等,以及定向分化成为子代肿瘤细胞的能力[11]。当在体外培养肿瘤干细胞时,其呈现出一种锚定-不依赖性的生长状态,对外源生长刺激因子的依赖较少、失去细胞接触抑制效应,导致永生化,这种锚定-不依赖性生长是肿瘤细胞的特征之一。静息状态下的肿瘤干细胞的永生性是其最有竞争优势的增长特征,在扩增过程中其可以无限增殖,并可以通过不平衡的增长潜能发育成两种表型的细胞,一种是可以定向分化成肿瘤的成体细胞,其并没有无限增殖的潜能;另一种是与肿瘤干细胞具有相同功能的子代细胞,它具有无限增殖的潜能,这种增殖方式被称之为自我更新,大部分肿瘤组织是由分化水平高的子代肿瘤细胞构成的。同时肿瘤干细胞还具有另一个特征就是在体外培养的克隆形成以及体内培养的成瘤特性。
总之,这些结果都表明肿瘤干细胞与正常干细胞具有较高的相似性。如前所述,干细胞的特性在很大程度上受表观遗传学的调控,由此思考表观遗传学在调节肿瘤干细胞的功能和表型中也具有重要作用。
2 表观遗传学对肿瘤干细胞的调控
在体细胞重新编码的进程中,逆转录病毒、非病毒载体或者是化学手段产生的过表达转录因子使得相应的核染色质重塑,以完成体细胞向干细胞的转换。重新编码是以循序渐进的方式进行的,首先是要重新编码的细胞因子和 DNA上与干细胞相关的转录因子结合,抑制分化的基因,使其不再表达相应的蛋白。同时染色质重构会通过调节染色质中的蛋白表达,去除大部分或者所有与细胞分化相关的分子标志物,将体细胞从已经分化的状态转化成未分化的干细胞[12]。同样的过程也会发生在肿瘤干细胞的形成中,无论是从成体干细胞、祖细胞或者是已经分化的体细胞来逐渐演变成为肿瘤干细胞,上述过程都是不可缺少的。这些与肿瘤起始相关的细胞会经历一个相似的 DNA 甲基化以及染色体重排的过程,最终形成有致癌能力的肿瘤干细胞。
因此,在肿瘤形成的过程中,表观遗传学对其的调控主要存在两种机制:①通过暴露原癌基因位点促进转录因子过表达,以调控中间产物为主,促进肿瘤的形成;②促进肿瘤发生的始动因子的过表达,成为肿瘤形成过程中的起始因素。我们现阶段对于表观遗传学是通过哪些机制,哪些通路来调控克隆细胞的增殖以及相关基因表达的知识广度以及深度是远远不够的,特别是对其中的关键事件的了解更是有限。每个肿瘤基因启动子甲基化的中位频率为 250 ~ 800,根据肿瘤的不同类型,非同义替换基因发生突变的频率不同,其最高在 150 ~ 170[13]。此外,正常细胞和肿瘤细胞中自发的突变率约为每个分区的每核苷酸碱基对的 10-10[14],与这个突变率相比,发生错配甲基的频率会高很多,每个分区的每个 CpG 双核苷酸大约为 2 × 105[15]。因此尽管原发灶与转移灶的 DNA 超甲基化相关的重要启动子是一致的,然而复制 DNA 甲基化的高错配率或许表明,在肿瘤进展的过程中表观遗传上对 DNA 的修饰比基因本身的遗传变异性更加多变难测。
因此,表观遗传变异性对肿瘤进展的确切作用仍需要更为深入的研究。表观遗传学对染色体的众多修饰过程中,甲基化能够传递到子代,同时当它精准地定位到编码区时能够直接影响基因所行使的功能,对器官以及组织的功能产生影响。因此,或许可以利用其进行克隆筛选,同时影响肿瘤异质性的形成。无论是偶然发生的表观遗传学改变或是异常转录都可以作为潜在的筛选条件对细胞的基因畸变进行遴选,包括抑癌基因的沉默或是 DNA 修复基因的缺失。这种表观遗传学的改变可以增加细胞的可塑性,在肿瘤进展的过程中,可以促进肿瘤起始亚群的形成。关于肿瘤干细胞的起源,还有一种等级假说,认为肿瘤干细胞是一群稳定的突变细胞亚群,有着诱发肿瘤发生的能力,有着不同的肿瘤细胞表型,一个肿瘤中存在不同表型的干细胞,有特定的表型能够适应当前肿瘤所提供的微环境而进行增殖,而有的细胞表型则更加适应其他的微环境。无论是根据这些理论中的哪一个或是将这些理论组合在一起来理解,肿瘤细胞群其内在固有的异质性都与表观遗传学的修饰密不可分。
等级假说理论与细胞的可塑性模型之间一直存在分争。然而现在已有证据证明,表观遗传学的修饰可以使细胞在干细胞状态和定向分化后具有功能的细胞间转化。在肿瘤中发生的上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)现象也同样会发生在正常细胞的转化过程中[16]。EMT 的过程中,间充质细胞和干细胞有很多的相似之处,例如持续的自我更新以及迁移能力。上述这些行为,在健康成人的细胞更新中同样也会发生,组织中细胞的更新需要这些反应来作为基石。这种内在的细胞行为在正常细胞和癌症相关的上皮新生细胞中都可观察到,不同的信号传导会使细胞在上皮细胞和间充质细胞之间进行转化,在特定的细胞微环境下可以改变细胞的表型[16]。相较于正常细胞,在癌变细胞中,这种转化过程会进行得更加高效。就以乳腺癌细胞为例,数据显示,类似于干细胞表型的细胞或是间充质细胞可以在肿瘤进展的任何时间点出现、转化等,使有着上皮细胞特性的肿瘤组织中的细胞表型更加丰富[17]。表观遗传学是如何调控上皮细胞间充质转化这一过程的呢?有一种假设,在任何特定的时间点上发生的上皮细胞间充质转化,其决定因素主要是关键转录因子的染色质调节及其下游分子标志物的表达[18]。
在这种假设的调节机制中,Wnt 和 TGF-β 的激活,以及 E-cadherin 的表达调节都是该通路的关键分子。在未分化状态中,存在一些基因的控制区域(或启动子),尤其是那些对于发育至关重要的基因,这些区域通过与被激活或抑制的组蛋白进行“交流”,保持可塑性,生物学家将这种状态命名为“二价状态”。为了调节染色质的表达,基因沉默在此起到了很大的作用。基因沉默被 PcG 蛋白以及其伴随的 H3K27me3 标记调控,来控制启动子的“二价状态”[19]。因此,当间充质细胞或是其他干细胞样的细胞表型在维持这种“二价状态”时,细胞中表达 E-cadherin 的基因会处在一个静息状态,当与 Wnt 和 TGF-β 激活相关的基因的表达被抑制时,维持上皮细胞表型的相关信号通路的表达就会增加,细胞可塑性的关键在于,在大多数的上皮细胞中基因通常被维持在“二价状态”。相反而言,当与Wnt 和 TGF-β 激活相关的基因的表达被激活时,会触发上皮细胞间充质转化进程。关于染色质调控的分子机制(“二价状态”的染色质与异常启动子导致的 DNA 甲基化)是现阶段在癌症中关于细胞可塑性的关键因素。同时,细胞的状态能影响肿瘤早期的进展,这一现象或许在癌前病变中就已经出现,作为起始步骤导致肿瘤的进展。这些表观遗传学的改变,令具有癌变趋势的细胞能够与慢性感染中的细胞一样,在细胞增殖过程中保留其表型[20]。在细胞代谢过程中,PcG 蛋白和 DNA 甲基化转移酶(DNMTs)的复合物能够迅速地整合进启动子、CpG 岛以及与转录沉默相关的基因中[21]。
在 DNA 损伤修复过程中,如果发生错误,当转录没有停止时,这个错误将会在每一代细胞中进行累积。所以上述的转换过程通常可以作为过渡事件来保护启动子区的正常代谢。然而,在慢性炎症和“二价状态”或是典型的 PcG标记基因所导致的低转录状态等外周环境影响下,或许会使启动子对于上述蛋白的复合物以及异常累积的 DNA 甲基化的抗性更差[22]。干细胞相关基因的染色质异常甲基化以及染色质的转录抑制能够减少细胞群的可塑性,使细胞维持异常克隆,在损失分化能力的同时保留自我更新的能力[22]。这种类型的染色质改变,也可以影响到肿瘤细胞亚群的生成,以及该亚群肿瘤细胞异质性的维持,这与肿瘤的进展和复发以及自我更新是密不可分的。这些细胞亚群有着较少的可塑性,不易逆转其细胞的干性特点,这一细胞特征就给了肿瘤在任何时间点上都有进展和复发的机会(图 1)。
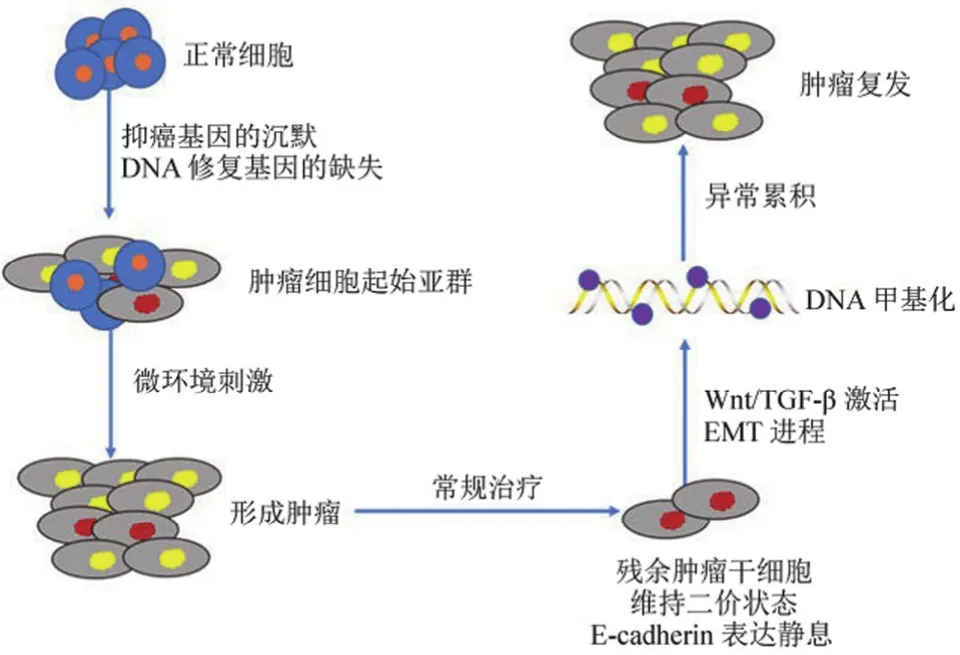
图 1 表观遗传学对肿瘤干细胞的影响
3 表观遗传学对癌症治疗及治疗抵抗的影响
通过改变肿瘤细胞的表观遗传抑制肿瘤进展是一种较为新颖的治疗方法。晚期肿瘤难以治愈的重要原因之一在于肿瘤细胞的耐药性,改变耐药肿瘤细胞的表观遗传能够改变治疗过程中的耐药性问题。如今,表观遗传学无论在开发新抑癌药物方面还是在改变肿瘤细胞的耐药性方面都已经得到了越来越多的关注。表观遗传相关的治疗在保护、延缓甚至逆转肿瘤细胞耐药性方面存在巨大的潜力。最近有综述报道,应用小分子物质能够逆转 DNA 甲基化和组蛋白的去乙酰化,提示我们选取其他靶向药物来调节染色质调控蛋白[23]。其中背景之一是近期一个令人兴奋的数据,提示染色质改变可同步出现在相关的干细胞群体中,同时提示了染色质改变在多重治疗的治疗性耐药的演变中的作用[24]。当然,对靶向治疗,这些抵抗是由靶分子在直接下游通路发生或者互补通路中直接产生的新突变造成[25]。因此,表观遗传的改变能在肿瘤细胞的耐药性中起重要作用。事实上,肿瘤细胞耐药性的可逆模型已经在实验室中成功获得。这种肿瘤细胞耐药性,在行停药处理或者组蛋白去乙酰酶抑制剂处理后可被逆转,这与有异质性的肿瘤细胞群或经诱导的肿瘤干细胞所产生的耐药性相一致。相反,在这些存在耐药性的细胞亚群中有一个共同的特点就是 H3K4me3 脱甲基酶和人赖氨酸特异性脱甲基酶 5A(JARID1A)处于非常高的水平,而 H3K4me3 在所有细胞中表达较低。JARID1A 作为相关蛋白在维护肿瘤启动细胞的功能上起着重要作用[26]。这些数据证明肿瘤细胞亚群的干细胞样表型和染色质改变是有可塑性的,这些可逆的表观遗传异常可能对有原发耐药的肿瘤亚群提供潜在的治疗策略。表观遗传相关的治疗作为一种预备治疗手段,可能对那些药物或者常规靶向化学治疗抵抗的肿瘤细胞敏感。
4 结论与展望
研究表明,表观遗传学机制在肿瘤干细胞的多向分化和调控中发挥非常重要的作用,但目前的成果并不能使我们对肿瘤干细胞的表观遗传组学特点有一个全面的了解。随着高通量测序技术的不断发展,获得了上千种肿瘤的全基因组DNA 序列,同时也推动了表观遗传学的全基因组测序,目前许多肿瘤的表观遗传学图谱已经明确,下一步,最需要的就是排除肿瘤中的异质细胞,对关键的肿瘤干细胞的表观遗传学修饰进行全基因组范围的检测,明确肿瘤干细胞表观遗传基因组,以真正推动肿瘤的临床诊断、治疗以及预防。
