抗肿瘤药物靶点Trop2研究进展
2018-08-15于群苗庆芳
于群,苗庆芳
作者单位:100050 北京,中国医学科学院医药生物技术研究所肿瘤室
Trop2 是人滋养层细胞表面糖蛋白抗原 2,又名肿瘤相关钙离子信号转导子 2(TACSTD2)、表皮糖蛋白 1(EGP-1)、胃肠肿瘤相关抗原(GA733-1)、表面标志物 1(M1S1),是由染色体 1p32 区域的Tacstd2 基因编码表达的细胞表面糖蛋白[1-2]。Trop2 属 GA733 蛋白家族,与上皮细胞黏附分子(EpCAM,又称 Trop1、TACSTD1)有较高结构序列相似性,同源性达 49%。研究证明,Trop2 可能是 EpCAM 信号通路调节中的增强子[3]。Trop2 蛋白初级结构是由 323 个氨基酸组成的 36 kD 的多肽,初级结构经N-端糖基化翻译后修饰,形成不同于 EpCAM 的 I 型细胞膜糖蛋白,即 Trop2 蛋白。Trop2 蛋白横跨细胞膜,N-端为胞外域(Trop2EC),该胞外域通过一个单向跨膜螺旋(TM)与由 26 个氨基酸残基构成的疏水性多肽的胞内短尾(Trop2IC)连接,从而固定于胞膜[4]。
目前发现 Trop2 在胚胎发育和肿瘤细胞增殖转移的过程中具有重要意义。Trop2 最初发现于滋养层细胞,并作为其表面标志物,滋养细胞源于胚胎外滋养层,Trop2 有助于胚胎着床及胎盘组织形成,并且在胚胎干细胞增殖特性维持以及器官形成发展过程中发挥重要作用[5]。值得注意的是,Trop2 还是重要的肿瘤发展因子,其高表达于多种肿瘤,如胰腺癌、乳腺癌、结肠癌、胃癌、口腔鳞癌、卵巢癌等,可促进肿瘤细胞增殖、侵袭、转移扩散等过程,其高表达与肿瘤患者生存期缩短及不良预后密切相关[6],因此以 Trop2为靶点的抗肿瘤药物研究具有重要意义。目前以 Trop2 为靶点的抗体、抗体偶联物以及联合用药等多种形式的药物正处于研发中,尤其是用于治疗 Trop2 过表达的上皮恶性肿瘤的抗体偶联药物(ADC)IMMU-132 已处于 II/III 期临床试验阶段,具有良好的发展前景。本文概述了 Trop2 参与介导的信号通路、Trop2 在各肿瘤细胞表达及以 Trop2 为靶点的抗肿瘤药物研究进展,为后续 Trop2 介导的肿瘤相关机制探究、肿瘤诊断及肿瘤靶向治疗药物研发提供参考。
1 Trop2 介导的肿瘤细胞增殖转移机制
目前 Trop2 介导的信号通路机制尚不完全明确,主要通过调节钙离子信号通路、细胞周期蛋白表达及降低纤黏蛋白黏附作用促进肿瘤细胞生长、增殖和转移。Trop2 蛋白的胞内尾部丝氨酸残基(S303)在蛋白激酶 C(PKC)作用下磷酸化,促进 4,5-二磷酸磷脂酰肌醇(PIP2)在磷脂酶(PLC)作用下水解成两部分,分别为三磷酸肌醇(IP3)和二酰基甘油(DAG),IP3 进而结合内质网表面 IP3 受体,促进内质网中储存钙离子的释放,激活丝裂原活化蛋白激酶途径(MAPK),促进细胞周期进程,而 DAG 可进一步通过激活 PKC,从而反馈调节 Trop2 磷酸化[7](图 1A)。另外胞内钙离子增加还可通过细胞周期蛋白 D1(cyclin D1)和 MAPK/ERK 激酶(MEK)途径促进环磷酸腺苷反应结合蛋白(CREB1)、Jun、NF-κB、Rb、STAT1 和 STAT3的表达,从而抑制肿瘤细胞凋亡[8]。Trop2 通过肿瘤坏死因子-α 转换酶(TACE)、y-分泌酶(y-secretase)、早老素 1/2(PS-1、PS-2)共同作用下水解成胞内区域(ICD),共定位于核内 β-连环蛋白,上调下游 cyclin D1 和原癌基因c-myc 表达,从而促进肿瘤细胞增殖[8](图 1B)。研究发现,Trop2 过表达可增加 p42/p44MAPK(ERK1/2)磷酸化,从而进一步增强下游靶点 AP-1 转录因子活性,下调 Bcl-2表达,抑制凋亡。另外,AP-1 还可增加 cyclin D1、cyclin E、细胞周期蛋白依赖性激酶(CDKs)表达,抑制 cyclin D1-CDK4 和 cyclinE-CDK4 复合物形成,促进细胞周期由G0/G1 过渡到 S 期。同时,Trop2 可上调增殖标志物 Ki-67表达,从而促进肿瘤细胞增殖[7](图 1C)。另外,Trop2 可促进胞质内蛋白激酶 C 受体 1(RACK1)富集于细胞膜,使其接近整合素 β-1(integrin β-1),减少纤黏蛋白与integrin β-1 结合,Trop2 与 integrin β-1、talin 蛋白形成复合物,共同增强局部黏着斑激酶 FAK 的作用,进而降低肿瘤细胞黏附作用,促进其转移扩散[3,9](图 1D)。此外,伪足小体是一种肌动蛋白丰富的粘连结构,可有效调节基质金属蛋白酶类的活性,促进基质重构,影响侵袭性细胞的黏附位置。Trop2 可通过增加胞内钙离子浓度间接影响伪足小体的形成,从而降低细胞黏附作用,促进肿瘤细胞转移扩散[10]。
2 Trop2 的表达与功能
Lipinski 等[5]发现,Trop2 过表达于胚胎形成过程中的人滋养层细胞,胚胎着床期间侵入子宫虹膜的 Trop2 大量富集于球状组织细胞,尤其在胚胎肠上皮始祖细胞中呈现过表达。Trop2 在胚胎始祖干细胞增殖和组织器官形成等生理过程中发挥重要作用。研究发现,经敲除膜 Trop2(mTrop2)/EpCAM基因的小鼠,由于在胚胎形成期间缺乏生长能力并伴有出血性腹泻症而迅速死亡。因此,Trop2对于生命早期形成及个体发育至关重要。然而,Trop2 在胚胎肠组织形成过程中只发挥暂时的干细胞特性维持作用,在小鼠胚胎形成 16.5 d 到出生期间,Trop2 在细胞内表达逐渐消失[11]。Trop2 在胎儿肺组织形成中也发挥重要作用,可能促进肺细胞增殖及胎儿肺组织发育。另外,有研究发现,Trop2 在正常体细胞中也有一定表达。利用膜定位检测法研究结果显示,Trop2 在分层鳞状上皮、立方状上皮、柱状上皮细胞均有表达,并在乳腺、宫颈、角膜、分泌腺上皮组织、食管、心脏、肾脏(远曲小管和集合管)、喉部组织、肺、肝脏、胰腺、前列腺、唾液腺、皮肤、胸腺、扁桃体、气管、滋养层、膀胱上皮、子宫等多种器官和组织中呈现差异性表达[12]。更令科学家们关注和感兴趣的是,Trop2 在多种肿瘤细胞中均为过表达,并可促进肿瘤细胞增殖、侵袭和转移扩散等过程,且与患者无进展生存期缩短和不良预后密切相关,可能成为一个有发展前景的潜在抗肿瘤靶点。因此,下面首先对 Trop2 在不同肿瘤中表达和功能研究进展情况进行概述。
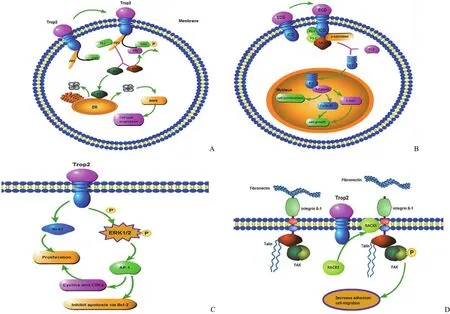
图 1 Trop2 介导的肿瘤细胞增殖转移机制(A:Trop2 的尾部结构域 PIP2 酶解后调节 Ca2+ 介导的细胞周期进程;B:Trop2通过膜内水解调节细胞周期,促进细胞增殖;C:Trop2 介导的细胞凋亡和增殖信号通路;D:Trop2 通过降低肿瘤细胞黏附作用促进其侵袭转移)
2.1 乳腺癌
研究发现,Trop2 在 ER-/HER2+乳腺癌细胞,如BT272 中的表达量明显高于 ER+/HER2-乳腺癌细胞,如MDA-MB-435、SKBR3、MDA-MB-468 等。Cyclin D1-Trop2是 Trop2 与 cyclin D1 形成的致癌融合蛋白,cyclin D1-Trop2 可联合 RAS 激活、诱导肿瘤细胞生长侵袭等生理过程。有研究发现,一种抗 Trop2 的 Fab 抗体可通过作用于凋亡相关信号通路从而抑制乳腺癌 MDA-MB-231 细胞增殖,且其在小鼠体内也有一定的抗肿瘤作用[13]。因此,Trop2 可能成为乳腺癌靶向治疗研究的重要靶点。
2.2 卵巢癌
研究表明,Trop2 高表达于上皮卵巢癌,其过表达与患者癌性腹水、肿瘤淋巴结转移及无进展生存期缩短密切相关,因此,Trop2 是上皮卵巢癌重要的预后标志[14]。免疫组化和实时定量 PCR 技术结果显示在 82% 化疗耐药的恶性卵巢癌组织中,Trop2 和 Trop2 mRNA 呈异常过表达,这可能与耐药性肿瘤的细胞侵袭逃逸能力相关[15]。
2.3 口腔鳞癌
口腔鳞癌是常见的口腔恶性肿瘤,发病机制目前尚不明确。研究发现,Trop2 高表达于口腔鳞癌细胞,微小RNA125b-1,即miR-125b-1 可结合 Trop2 基因(Tacstd2),调节其表达水平,从而导致丝裂原激活蛋白酶(MAPK)途径紊乱,因此,miR-125b-1 的缺失是口腔鳞癌发生发展的重要因素之一[16]。此外,Trop2 高表达与口腔鳞癌细胞侵袭转移及患者不良预后密切相关,可明显缩短患者无进展生存期。因此,Trop2 是口腔鳞癌重要的预后标志,也是口腔鳞癌治疗的新靶点[17]。
2.4 前列腺癌
Trop2 在前列腺癌中可促进肿瘤细胞转移扩散。Trop2通过激活 integrin β-1-RACK1-FAK-Src 通路途径调节肿瘤细胞黏附能力,通过抑制 integrin β-1 与纤黏蛋白结合增强局部黏着斑激酶 FAK 活性,从而降低黏附作用,促进肿瘤细胞转移扩散[18-19]。因此,Trop2 高表达可能是前列腺癌发生发展的重要因素,有望成为前列腺癌治疗重要靶点。
2.5 胃癌
通过实时定量 PCR 技术和组织微阵列免疫组化分别检测胃癌组织中 Trop2 mRNA 及蛋白表达情况,结果表明其在肿瘤组织中的水平明显高于癌旁组织。此外,Trop2 高表达与肿瘤异质化、肿瘤淋巴结转移及肿瘤大小密切相关,明显缩短患者无进展生存期,并与不良预后相关,有望成为胃癌诊断和治疗的重要靶点[20]。
2.6 宫颈癌
Trop2 在宫颈癌组织中的表达明显高于正常组织,并且其表达量与宫颈癌的发生发展相关,可作为宫颈癌筛查诊断的生物标志物。Trop2 在宫颈癌中过表达的机制与 cyclin D1、cyclin E、CDK2 和 CDK4 的过表达相关,并通过激活 ERK 途径下调 p27 和 E-钙黏蛋白(E-cadherin)的表达,从而促进肿瘤细胞生长和侵袭转移。Trop2 过表达与肿瘤组织学分级、淋巴转移、侵润深度、Ki-67 高表达及不良预后密切相关,可明显缩短患者无进展生存期。因此,Trop2在宫颈癌发生发展中发挥重要作用,有可能成为宫颈癌治疗的重要靶标[21]。
2.7 甲状腺癌
Trop2 可通过 ERK 和 JNK 途径诱导基质金属蛋白酶 2(MMP2)进而促进甲状腺癌的侵袭转移[22]。在甲状腺乳头状癌的临床研究中,Trop2 过表达不仅与肿瘤淋巴结转移密切相关,还与BRAF基因突变相关。BRAF突变可诱导 Trop2 表达,激活 MAPK/ERK 途径,促进肿瘤发生[23]。因此,Trop2 可能是甲状腺癌侵袭转移及发生机制的重要分子基础。
2.8 胆囊癌
研究表明,Trop2 可通过调节 PI3K/AKT 途径诱导上皮-间质转化(EMT),从而促进胆囊癌细胞增殖转移和侵袭作用。体外经敲除 Trop2 基因的胆囊癌细胞的增殖、克隆形成、侵袭转移等生理过程明显减弱。此外,Trop2 在胆囊癌细胞高表达与不良预后相关,明显缩短患者生存期,是重要的预后标志物和抗肿瘤靶点[24]。
2.9 非小细胞肺癌
Trop2 在肺鳞癌中的表达较肺腺癌略强,在正常肺组织中的表达呈阴性,其过表达与肿瘤淋巴结转移、病理分级和不良预后相关。研究发现,Trop2 在肺腺癌 A549 细胞中高表达,并可促进其增殖、转移和侵袭作用。在肺腺癌 PC-9细胞系中敲除 Trop2 基因会促进其凋亡,并抑制增殖、侵袭和转移等过程[25]。另外,Trop2 可通过激活 ERK1/2 信号途径促进肿瘤血管形成。因此,Trop2 有望成为抗非小细胞肺癌血管生成的重要靶点[26]。
2.10 胰腺癌
Trop2 高表达于胰腺癌并促进其发展及恶化。实时定量PCR 分析显示,Trop2 mRNA 在胰腺癌组织中的表达明显高于癌旁组织;免疫组化结果显示抗 Trop2 抗体可与肿瘤组织高特异性结合,而与正常胰腺组织不结合[27]。临床病理参数表明,Trop2 高表达与胰腺癌病理分级和淋巴结转移密切相关,且 Trop2 高表达的患者中位生存期比普通患者减少 5 ~ 6 个月,并且无进展生存期明显缩短。因此,Trop2是胰腺癌重要预后标志物和治疗靶标[28]。
3 以 Trop2 为靶点的抗肿瘤药物研究
3.1 抗体偶联药物 Sacituzumab govitecan(IMMU-132)
靶向 Trop2 的新型抗体偶联药物 Sacituzumab govitecan(IMMU-132)是利用人源化抗体 hRS7 作为靶向载体与伊立替康活性代谢产物 SN38 偶联而成,可用于治疗多种上皮恶性肿瘤如乳腺癌(三阴乳腺癌)、卵巢癌、小细胞肺癌等[29-30]。目前,IMMU-132 正处于临床 II/III 期试验阶段。临床数据显示,69 名多种治疗方案无效的复发难治性三阴乳腺癌患者用药后客观缓解率达 30%,中位缓解时间为8.9 个月,临床有效率为 46%。同时,免疫组化结果显示,接受治疗的患者中 88% Trop2 表达为阳性。更为突出的是该药产生疗效的平均时间仅为 1.9 个月,很大程度上提高了患者的用药依从性。IMMU-132 可延长患者无进展生存期达 6 个月,总生存期达 16.6 个月,且无致死性不良反应[31]。尤其令人振奋的是,IMMU-132 对免疫抑制剂疗法耐药且复发转移的患者都有一定的疗效。此外,在对小细胞肺癌的临床 II 期试验中,54 名晚期难治性小细胞肺癌患者在接受 IMMU-132 治疗后,客观缓解率为 19%,中位缓解时间为 6 个月,临床有效率为 43%,中位无进展生存期达 5.2 个月,中位总生存期达 9.5 个月[32],为三阴乳腺癌及难治性小细胞肺癌的患者带来了新的希望。
3.2 其他抗肿瘤药物
Ranpirnase(Rap)是一种具有抗肿瘤作用且不产生免疫反应的两栖类核糖核酶,Rap 与人源化抗 Trop2 抗体的融合蛋白在体外可高效杀伤淋巴癌细胞,该融合蛋白在抑制慢性淋巴细胞白血病(CLL)和 Raji/Burkitt 淋巴瘤中也极具潜力[33]。
hRS7 是人源化抗 Trop2 单克隆抗体,研究发现 hRS7可通过诱导 Trop2 高表达的卵巢癌、宫颈癌细胞发生强烈抗体依赖的细胞介导的细胞毒作用(ADCC)和自然杀伤细胞(NK)溶酶体杀伤作用,抑制这两种细胞的生长。在用hRS7 治疗对化疗耐药的卵巢癌中,低剂量注射白介素-2(IL-2)可明显增强 hRS7 的抗肿瘤作用[34]。
新型 IgG 免疫毒素(2L-Rap(Q)-hRS7)由突变型 Rap偶联人源化抗 Trop2 抗体(hRS7)而成,可有效抑制非小细胞肺癌移植瘤生长,延长小鼠中位生存期 55 ~ 96 d,有望用于治疗 Trop2 高表达的结肠癌、胰腺癌、卵巢癌、宫颈癌等[35]。
在乳腺癌细胞系 MDA-MB-231 中,人源化 Trop2-Fab抗体可通过下调抗凋亡因子 Bcl-2 表达和上调促凋亡因子Bax 的表达诱导细胞凋亡,从而浓度依赖性抑制细胞生长和转移[36]。在胰腺癌 BxPC3 的裸鼠移植瘤模型中,人源化Trop2-Fab 抗体与阿霉素的偶联药物的抑瘤率达 69.16%,说明人源化 Trop2-Fab 抗体是 ADC 药物的理想载体[37]。
TF12 是包含两个抗 Trop2 Fab 片段和一个抗组胺-琥珀酰-甘氨酸(HSG)Fab 片段的三价双体异性抗体,111In-IMP288 是一种放射性标记的抗半抗原肽。在小鼠前列腺癌移植瘤模型中,两者联合用药可使药物快速富集于肿瘤部位,相比于单药可明显改善生存期,且无肾毒性及血液毒性[38]。
4 结语
Trop2 高表达于多种实体肿瘤,目前关于 Trop2 介导的相关信号通路网络尚不完善,有待进步一研究探索。Trop2在肿瘤细胞中的过表达与肿瘤生长、增殖和转移扩散密切相关。近年来靶向 Trop2 的抗体偶联药物、抗体药物联合传统化疗、免疫疗法、放射免疫疗法以及化学抑制剂疗法正迅速发展并逐步应用于临床研究。目前本实验室已通过杂交瘤技术筛选得到了以 Trop2 为靶点的新型抗体,初步研究表明该抗体与抗原具有高亲和活性,能与人类多种肿瘤组织呈特异性膜结合,并且在小鼠体内可长时间富集于肿瘤部位,是肿瘤靶向药物的理想载体,下一步将继续研究以其为载体的抗体偶联药物。总之,Trop2 可作为肿瘤靶向治疗的新靶点,在新型抗肿瘤药物研究中极具研究价值和发展前景。
