血液放置时间和RNA 反复冻融对RNA 质量的影响
2018-08-15洪恩宇王雅頔任慧敏耿迪杨慧郑惠文杨业然金雅琼鲁洁郭永丽于永波
洪恩宇,王雅頔,任慧敏,耿迪,杨慧,郑惠文,杨业然,金雅琼,鲁洁,郭永丽,于永波
作者单位:100045 北京,国家儿童医学中心(北京)首都医科大学附属北京儿童医院/北京市儿科研究所/儿童耳鼻咽喉头颈外科疾病北京市重点实验室(洪恩宇、王雅頔、任慧敏、耿迪、杨慧、郑惠文、杨业然、金雅琼、鲁洁、郭永丽、于永波),儿童临床数据和样本资源库(洪恩宇、王雅頔、任慧敏、耿迪、杨慧、郭永丽、于永波)
在临床和科研工作中,血液和组织是比较容易获取的生物标本,特别适用于临床和实验室检测及生物样本库收集保存。DNA、RNA 和蛋白质是三种重要的生物大分子,其中RNA 在人类多种生理和病理过程中发挥着举足轻重的作用。RNA 通常是从组织、全血和培养的细胞中提取获得[1],高质量 RNA 可满足 RT-PCR、Northern blot、基因表达谱、转录组测序和阵列分析等生物学实验的研究需求[2-3]。由于RNA 自身结构特性[4]和环境中广泛分布核糖核酸酶(ribonuclease,RNase)[5],同时 RNA 提取质量亦受到标本类型、储存温度、储存时间、冻融次数和处理方式等影响,使得从血液、组织和培养的细胞中抽提 RNA 以及 RNA的稳定保存相对困难。
目前,有关 RNA 质量的影响因素研究主要集中于样本类型、储存温度和时间等方面,但是储存温度和时间对 RNA的影响仍然没有统一的结论[6-7],而且,RNA 反复冻融对其质量的影响也未见报道。本文从临床检测和临床资源样本库标本存储的需求出发,旨在探讨血液标本采集后在 4 ℃ 及常温放置不同时间,评估其对血液标本 RNA 质量的影响;另外,通过反复冻融 RNA,研究 RNA 冻融次数对其质量影响,以期为临床检测和样本库标本的存储提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要设备 生物安全柜和 NanoDrop 购自美国Thermo 公司;4 ℃ 和 –80 ℃ 冰箱购自 Sanyo 公司;高速冷冻离心机和恒温混匀仪购自 Eppendorf 公司;G2939A生物分析仪购自 Agilent 公司;采血管购自美国 BD 公司;RNase free 离心管和枪头购自美国 Axygen 公司;RNase free 冻存管购自德国 Sarstedt 公司。
1.1.2 主要试剂 血液(液体样本)总 RNA 快速提取试剂盒(离心柱型)购自北京百泰克生物技术有限公司;AllPrep DNA/RNA Mini Kit 购自美国 Qiagen 公司;RNA 6000 Nano 总 RNA 分析试剂盒及芯片购自美国 Agilent公司;氯仿和 β-巯基乙醇等试剂购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 标本采集与分组 在获取知情同意书后,采集首都医科大学附属北京儿童医院 3 例健康成人(志愿者)血液标本各 4 ml,使用 EDTA 抗凝管保存,采集后至生物安全柜中进行分装,以上操作均为无菌操作。组织标本为首都医科大学附属北京儿童医院手术切除的患儿组织样本(神经母细胞瘤瘤体)3 例,在组织离体 30 min 内,采集组织标本,并迅速置于液氮中保存,以上操作均为无菌操作,并已获取相关知情同意书。
1.2.2 样本分组
⑴血液样本 4 ℃ 放置组:血液样本按照 0.25 ml/管分装于 RNase free 离心管中并编号,4 ℃ 放置。样本分别在0、1、2、4、12、24、48、72 h 及 1 周时提取 RNA。
⑵血液样本常温放置组:血液样本按照 0.25 ml/管分装于 RNase free 离心管中并编号,常温放置。样本分别在 0、4、12、24 及 48 h 时提取 RNA。
⑶组织 RNA 反复冻融组:组织样本提取 RNA 后混匀,分装于 RNase free 冻存管中并编号,–80 ℃ 冰箱保存。将 RNA 置于冰上融化 1 h,待其完全融化后放回 –80 ℃保存,重复此操作(每天冻融 2 次)。我们预实验将 RNA 冻融多次(1 次、3 次、5 次和 10 次),但各冻融次数之间结果没有差异,为寻找 RNA 反复冻融后质量出现变化的临界点,我们进而增加冻融次数:即反复冻融 1 次、11 次、26 次及 41 次。
1.2.3 总 RNA 提取
⑴血液样本 RNA 提取严格按照操作说明书进行,主要操作步骤如下:每 0.25 ml 全血样本中加入 0.75 ml 裂解液裂解细胞,在 25 ℃ 下孵育 5 min,再加入 0.2 ml 氯仿离心分层,吸取无色水相和中间层置于新的离心管中,加入等体积 70% 乙醇,加入去蛋白液、漂洗液去除蛋白及残留乙醇,最后加 50 μl RNase free water 溶解 RNA,行 RNA浓度及纯度检测。
⑵组织样本 RNA 提取严格按照操作说明书进行,主要操作步骤如下:每 30 mg 组织样本加入 0.6 ml 缓冲液RLT 和 β-巯基乙醇混合液,组织研磨器破碎后离心,吸取上层匀浆至带有收集管的过滤柱中,离心,加入等体积 70%乙醇,离心,再加入缓冲液 RW1、缓冲液 RPE 去除蛋白及残留乙醇,最后加 40 μl RNase free water 溶解 RNA,行RNA 浓度及纯度检测。
1.2.4 RNA 浓度和纯度检测 取 2 μl RNA 样本,使用核酸蛋白检测仪 NanoDrop 检测 RNA 浓度及OD260/OD280值,比值在 1.8 ~ 2.1 范围内,表明 RNA 纯度较好,比值< 1.8 表明有 DNA、蛋白质污染,比值 > 2.1 表明 RNA 降解或有异硫氰酸胍等物质污染。
1.2.5 RNA 完整性检测 使用 Agilent 2100 生物分析仪检测 RNA 完整性,采用毛细管电泳法对 28S 和 18S rRNA 通过软件量化,得反映 RNA 完整性的 RIN 值。RIN值一般在 10(最佳质量)至 0(完全降解)之间[8]。
1.3 统计学处理
应用 SPSS 19.0 统计软件对实验数据进行分析,计量资料以±s表示,各组间差异比较采用单因素方差分析,设定P< 0.05 为差异有统计学意义。
2 结果
2.1 血液样本 4 ℃ 不同放置时间对 RNA 质量的影响
使用 NanoDrop 分光光度计检测 RNA 的浓度、纯度,使用生物分析仪检测 RNA 的完整性,结果如表 1 所示,RNA 浓度范围在 55.13 ~ 64.10 ng/μl 之间,并且随着时间的延长,出现下降的趋势,但是并没有统计学差异;RNA 纯度OD260/OD280比值在 1.94 ~ 2.01 间变化较小;RIN 是比OD260/OD280更灵敏的反映 RNA 质量的指标。RIN 值在7.77 ~ 10.00 之间,其中,1 周的血液 RNA 完整性与 0 h比较具有统计学差异(P< 0.05)。图 1 所示为血液样本在4 ℃ 放置不同时间对 RNA 影响的电泳图,显示随着放置时间的延长,RNA 存在降解现象。以上结果表明,血液样本 4 ℃ 放置 1 周对 RNA 的浓度和纯度没有显著性影响,但是对 RNA 的完整性有影响。
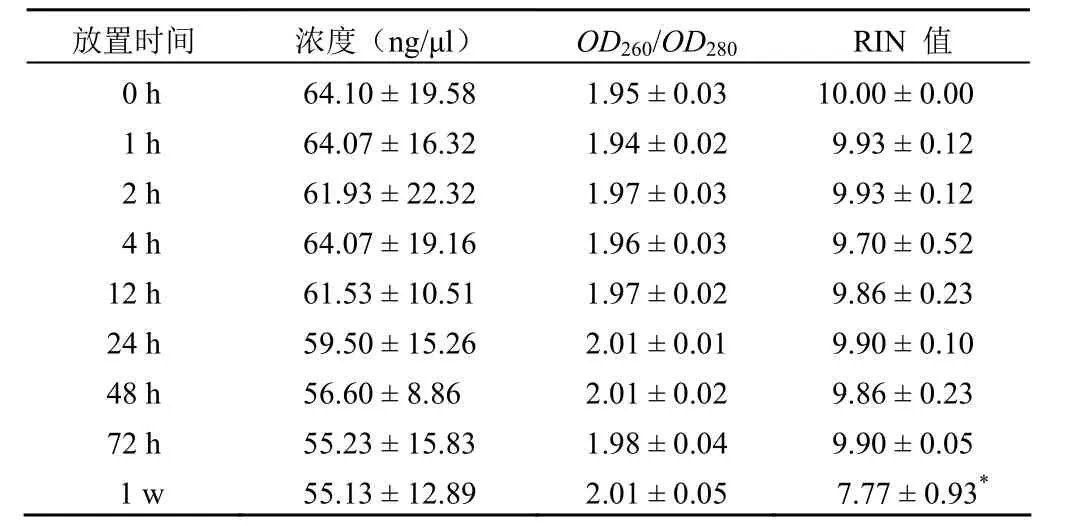
表 1 血液样本 4 ℃ 不同放置时间对 RNA 浓度、纯度及完整性影响
2.2 血液样本常温不同放置时间对 RNA 质量的影响
如表 2 所示,血液样本在常温放置 48 h 以内,RNA浓度范围在 76.60 ~ 82.54 ng/μl 之间,随着放置时间的延长呈现无规律变化,各时间组与 0 h 组相比也无统计学差异;RNA 纯度OD260/OD280值在 1.97 ~ 1.99 之间,变化不明显;RIN 值在 7.10 ~ 10.00 之间,其中,48 h 血液 RNA 完整性与 0 h 比较具有统计学差异(P< 0.05)。图 2 所示为血液样本在常温放置不同时间后对 RNA 影响的电泳图,显示随着放置时间的延长,24 h 时电泳图有杂带出现,说明RNA 存在降解现象,尤其是 48 h 组降解明显。以上结果表明,血液样本常温放置 48 h 对 RNA 的浓度和纯度没有显著性影响,但是对 RNA 的完整性有影响。
2.3 冰上反复冻融对 RNA 质量的影响
结果如表 3 所示,提取的 RNA 样本经反复冻融1 次、11 次、26 次和 41 次后,RNA 浓度范围在 411.37~ 467.03 ng/μl 之间,随着冻融次数增多,出现明显下降趋势,但是各组并没有统计学差异;RNA 纯度OD260/OD280值在 2.02 ~ 2.04 之间,变化不明显;RIN 值维持在 9.70 ~9.93 之间并且各组无统计学差异。图 3 所示为组织 RNA在冰上冻融相应次数后的 RNA 电泳图,结果显示随着组织RNA 在冰上冻融次数增加,未出现杂带,说明 RNA 在本实验中没有发生明显的降解。以上结果表明,保存在 –80 ℃冰箱中的 RNA,在冰上反复冻融后对 RNA 的浓度有一定影响,对 RNA 的纯度和完整性没有明显的影响。
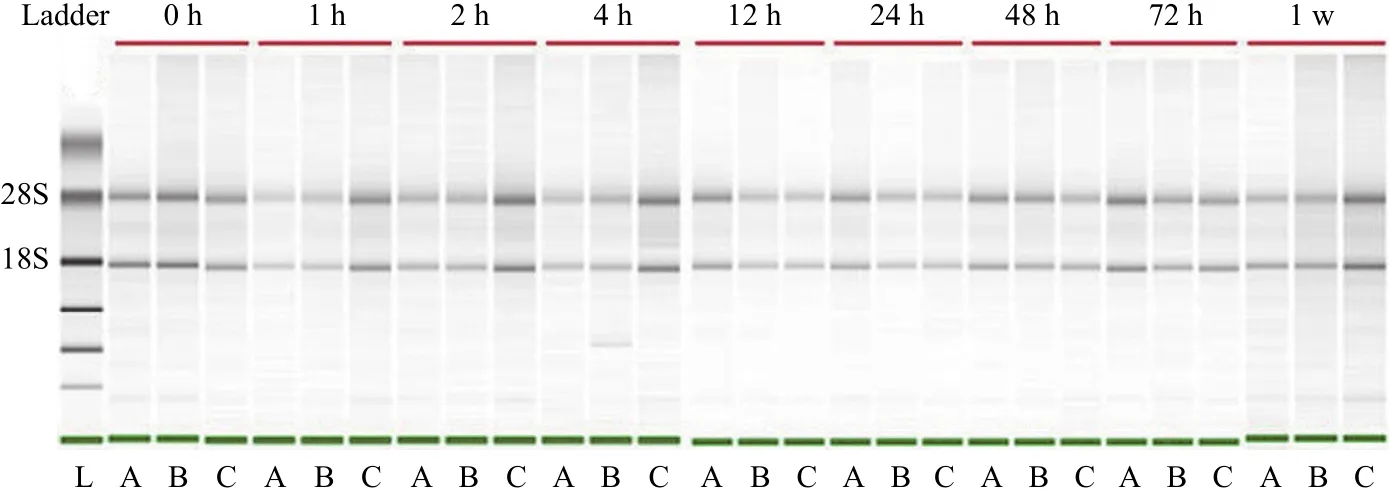
图 1 血液样本 4 ℃ 不同放置时间对 RNA 影响电泳图(A、B、C 代表 3 例血液样本)
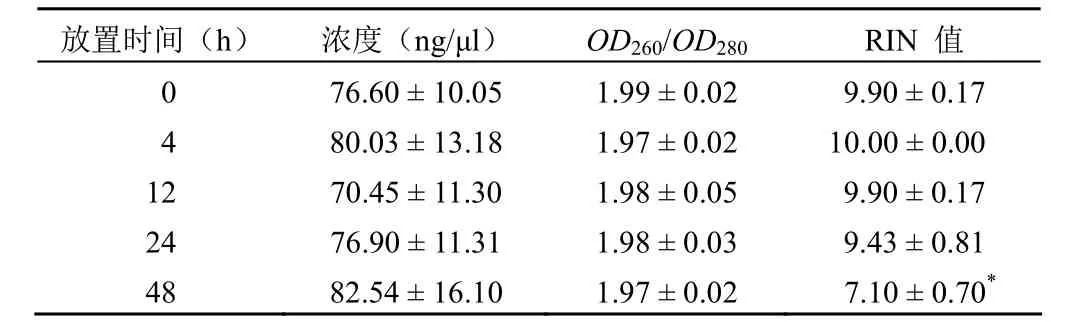
表 2 血液样本常温下不同放置时间对 RNA 浓度、纯度及完整性影响
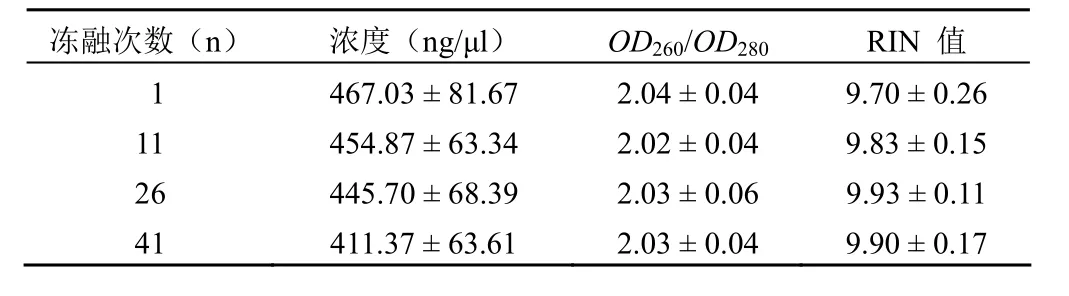
表 3 组织 RNA 冰上反复冻融对 RNA 浓度、纯度及完整性影响

图 2 血液样本常温下不同放置时间对 RNA 影响电泳图(A、B、C 代表 3 例血液样本)
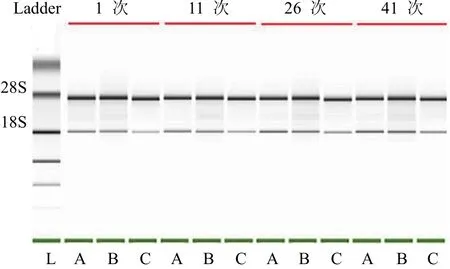
图 3 组织 RNA 冰上反复冻融对 RNA 影响电泳图(A、B、C 代表 3 例组织样本)
3 讨论
血液和组织是临床检测、科学研究和生物样本库存储的主要素材,其中 RNA 是研究基因表达和翻译的最常用材料,因此,RNA 的质量对保证科学研究的准确性具有重要意义。RNA 样本的质量检测包括浓度、纯度、完整性以及RT-PCR 反应扩增率等[9]。完整性和均一性是评价 RNA 质量的两个最关键标准[10-13]。
由于 RNA 极其容易降解,影响其质量的因素众多,血液样本存储温度和时间是影响 RNA 质量的重要因素。何松哲等[6]将血液标本置于 4 ℃ 条件下,每隔 1、3、5、7 天提取 RNA,结果显示存储温度和时间对 RNA 纯度有明显影响。吴苗等[7]将外周血细胞置于 4 ℃ 保存,每隔 1、3、10 天提取 RNA,结果显示 RNA 能稳定保存长达 10 d 且不被降解,同样的我们研究发现血液样本在 4 ℃ 条件下放置 1 周,RNA 浓度和纯度均与 0 h 没有统计学差异,说明该条件下不会影响 RNA 的浓度和纯度。RNA 完整性检测发现,血液样本在 4 ℃ 放置 1 周,RIN 值与 0 h 比较具有统计学差异。另外,通过生物分析仪检测发现,血液样本在 4 ℃ 放置 1 周电泳图出现明显的杂带,说明 RNA存在降解现象。同时,我们还发现血液样本在常温放置 48 h与在 4 ℃ 条件下放置 1 周结果一致。究其原因,血液样本在离体后立即提取 RNA 可保证 RNA 的质量,但是随着放置时间的延长,RNA 因其化学结构不稳定以及内源性、外源性 RNA 酶的酶解作用导致其含量下降,全血中的红细胞会发生裂解,其释放的蛋白同样也会影响总 RNA 纯化[14],有可能导致 RNA 完整性下降。在本研究中,血液样本在 4 ℃ 放置 1 周和常温放置 48 h 时出现降解,但是OD260/OD280比值并未发生明显变化,而 RIN 值出现显著性差异,说明使用生物分析仪检测 RIN 值是评估 RNA 质量更为敏感的指标。综上所述,为了获得完整性好、质量高的 RNA,采集后的血液样本应及时放入 4 ℃ 冰箱中或在24 h 内及时处理。
新鲜冰冻的组织也是常用的生物样本,但由于成分复杂,组织样品在解冻后的几分钟甚至几秒钟就启动 RNA 降解程序[15],导致 RNA 的浓度和纯度降低。另外,在实际的临床检测和科学研究过程中,存在对某一样品 RNA 重复检测的需求,因此,探讨 RNA 反复冻融对 RNA 质量的影响具有现实意义。目前,有关 RNA 反复冻融对 RNA 的浓度、纯度及完整性影响的研究鲜有报道。本研究完全模拟日常实验,将 RNA 冻融多次(1 次、11 次、26 次和41 次),结果显示随着冻融次数的增多,RNA 浓度均值出现下降趋势,但是各组并没有统计学差异,可认为反复冻融对 RNA 浓度无影响;RIN 值始终维持在 9.70 ~ 9.90 之间,电泳图也未见杂带出现,提示 RNA 未降解,完整性未受冻融的影响。出现上述结果的原因我们认为 RNA 浓度也是影响 RNA 稳定性和质量的因素,本研究中浓度较高(> 400 ng/μl)的 RNA 反复冻融后即使存在 RNA 降解,高 RNA 浓度也可能会掩盖 RNA 的降解。但是 RNA 反复冻融对低浓度 RNA 质量的影响尚缺乏相关研究,课题组后续会设计系列实验加以证实。本研究说明在较高浓度条件下,保存在 –80 ℃ 冰箱中的 RNA 反复冻融后对 RNA 的浓度有一定影响,但对 RNA 的纯度和完整性影响不大。
本研究结果显示血液样本在 4 ℃ 条件下放置 1 周和常温放置 48 h,不会对 RNA 浓度和纯度造成明显影响,但是会造成 RNA 降解,影响 RNA 的完整性;较高浓度的 RNA 反复冻融会降低 RNA 的浓度,但是不会影响RNA 的纯度和 RNA 完整性。提示我们在临床检测、科学研究和样本存储时,血液样本在 4 ℃ 放置不要超过 72 h,在常温放置不要超过 24 h。在常规实验中,高浓度 RNA 的反复冻融不会影响 RNA 质量。
