乳腺癌腋窝淋巴结转移影像学诊断的研究进展
2018-08-14林周谊张群霞冉海涛
林周谊,张群霞,冉海涛
重庆医科大学附属第二医院超声研究所,重庆 400016;
腋窝淋巴结(axillary lymph node,ALN)是否转移是临床评估乳腺癌预后的重要因素。传统ALN清扫术(axillary lymph node dissection,ALND)对乳腺癌的分期起决定性作用[1];但易导致严重术后并发症,影响术后恢复。前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)在评估患者ALN分期及制订治疗方案中具有重要作用。但SLNB手术创伤大,且需结合准确的术前定位及精确的病理诊断结果,易出现假阴性结果。因此,寻找一种简便、有效的诊断方法尤为重要。影像学检查作为一种无创检查方法广泛应用于临床诊断与治疗,可有效诊断ALN,避免不必要的SLNB。本文拟对诊断ALN转移的影像学检查方案进行综述。
1 超声
超声是评价 ALN性质的常用成像方法,具有实时动态、操作简便、经济、无创伤等优势,能够多角度、多方位探查ALN。近年发展的超声引导下针刺活检术(ultrasound-guided needle biopsy,UNB)、超声造影(contrast enhanced ultrasound,CEUS)及弹性成像(ultrasound elastography,UE)丰富了超声诊断ALN的内容。
1.1 常规超声 正常ALN在常规超声下呈近肾形,由低回声的皮质及高回声的髓质组成。转移性淋巴结在常规超声下表现为圆形低回声、淋巴门部分或完全消失、轮廓不清等(图1)[2]。既往研究发现,淋巴结大小与诊断淋巴结是否转移并无相关性[3-4]。
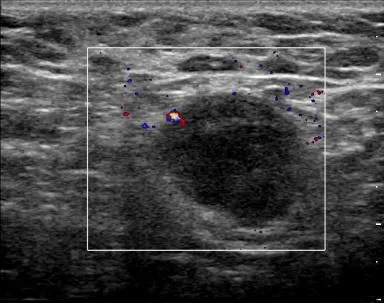
图1 女,47岁,乳腺癌。常规超声下ALN表现为边界不清、圆形低回声、淋巴门消失
乳腺肿瘤细胞的转移通常通过输入淋巴管到达皮质并沉积于被膜下淋巴窦,经过副皮质,最后进入淋巴门[5]。因此,转移性ALN早期常规超声表现为局部皮质隆起或偏心性皮质增厚。随着肿瘤细胞的增殖,逐渐表现为淋巴门部分或完全消失,最终呈圆形低回声改变。期间伴随的肿瘤新生血管形成可能是彩色多普勒造成非门性皮质血流特点的一个重要原因。既往有研究对皮质的厚度进行分类以评估淋巴结的恶性程度,淋巴门缺失呈圆形低回声是诊断恶性的最重要标志[6-7]。
Gipponi等[1]以淋巴结表现为诊断标准检测 ALN转移,其灵敏度与特异性分别为 54.3%和 100%。因此,超声诊断ALN具有较高的特异性,但灵敏度差。淋巴结微转移与常规超声检查对于技术和仪器的依赖性均是造成灵敏度不足的重要原因。
1.2 UNB 与常规超声相比,UNB结合病理活检结果诊断 ALN转移更为准确有效。作为乳腺癌患者术前评估 ALN情况不可或缺的一种影像学与病理学结合的方法,对超声诊断可疑的淋巴结进行 UNB可提高诊断 ALN转移的准确性。其中阳性患者可直接行ALND;阴性患者可先行SLNB后根据病理结果决定是否进一步行 ALND,这种分类避免了不必要的SLNB。Gipponi等[1]利用常规超声结合UNB研究ALN性质,对常规超声表现异常患者行 UNB诊断淋巴结性质的灵敏度、特异性、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)及准确性分别为44.1%、100%、100%、79.4%、82.2%。其中14%的UNB阳性患者直接行ALND,避免不必要的SLNB。Houssami等[8]研究发现超声引导下UNB诊断ALN转移的灵敏度、特异性、PPV分别为79.6%、98.3%、97.1%。由于微转移及分离性肿瘤细胞的存在,使UNB具有较高的假阴性率,灵敏度较低,活检后阴性结果的患者仍然不能避免SLNB[9]。
1.3 CEUS CEUS是在常规超声的基础上使用超声造影剂使组织成像。目前使用直径仅为 1~4 μm的微泡作为造影剂可顺利通过人体内微血管使组织显影。良性淋巴结通常表现为快速和均匀增强。肿瘤细胞浸润 ALN导致新生血管生成,形成不均匀增强的灌注模式。肿瘤细胞增殖进一步堵塞血管或淋巴管可表现为不增强,见图2。Yu等[10]以不均匀增强及不增强为恶性指标诊断恶性淋巴结的灵敏度与特异性分别为84%和79%。刘健等[11]研究证实,炎症细胞浸润的淋巴结表现为快速、均匀增强,具有癌转移的淋巴细胞表现为不增强或灌注缺损,良性组显影时间明显快于恶性组,差异有统计学意义。CEUS诊断ALN具有很高的诊断效能,但成本高、缺乏客观性。

图2 女,51岁,乳腺癌。转移性ALN造影呈不均匀增强(箭)
Steppan等[12]研究发现与良性淋巴结相比,恶性淋巴结的最大强度和持续时间更高;而Yu等[10]得出相反结论,认为良、恶性淋巴结最大强度差异无统计学意义,恶性淋巴结和淋巴瘤的达峰时间和曲线下面积均小于良性淋巴结。良、恶性淋巴结最大强度目前尚无完全统一的结果,仍需进一步研究。
CEUS可有效诊断转移性ALN,并可准确定位前哨淋巴结(sentinel lymph node,SLN),较其他影像学检查具有特殊优势。SLN是乳腺癌淋巴转移的第1个或第1组淋巴结,多位于腋窝,其性质对ALN具有明显的指示作用。CEUS下可清晰显示淋巴管走行,较其他检查方法具有可有效定位及诊断SLN的优势。
1.4 UE UE是一种以彩色图像或剪切波速度展现,通过评估组织硬度诊断组织良恶性的检查,包括弹性评分法(elasticity score,ES)及应变比值(strain ratio,SR)。既往研究利用ES及SR术前评估乳腺癌ALN是否转移,转移性淋巴结具有更高的评分和应变比[13-15]。但ES及SR易受所加外力影响,主观及客观因素影响大,对操作者的依赖性较高。剪切波弹性成像(shear wave elastography,SWE)通过剪切波速度评估组织硬度,可避免操作者及图像因素,是一种新型的定量分析技术。既往研究根据分析SWE平均值、最大值、最小值得到转移性淋巴结具有较高的弹性指数,具有良好的诊断性能[16-17]。但目前国际上运用SWE诊断ALN的研究较少,SWE也具有其局限性:①易受患者呼吸及邻近大动脉波动影响;②剪切波为横波,不能在液体中传播,淋巴结中如有液化坏死,会造成弹性信号缺失;③量程小,过硬或过软的组织测量均易出现缺失。因此SWE仍需进一步完善研究。
2 MRI
MRI具有极高的软组织分辨力,且可以多序列成像,从而提高疾病的检出率;具有多方位任意切层的能力,且对人体无害。近年临床上利用扩散加权成像(DWI)、动态增强 MRI(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)等诊断ALN,具有重要临床意义。
2.1 常规MRI序列 目前,MRI已成为临床主要辅助检查方法。与超声相比,MRI无仪器依赖性,可全面深层次、双侧腋窝对比观察,较PET/CT避免了放射性辐射,具有更好的安全性及经济性。Baltzer等[18]利用全身MRI对乳腺癌患者ALN表现进行比较,发现联合“不对称”和“不规则的边缘”是诊断转移淋巴结最准确的预测因子(PPV:100%),而“对称”和“均匀的皮质”的阴性预测价值最高(NPV:94.3%),见图3。Arslan等[19]观察术前MRI下ALN的形态特征,发现与反应性淋巴结相比,转移性淋巴结的短径更长,以淋巴门缺失为标准诊断转移性 ALN的灵敏度、特异性、准确性、PPV、NPV分别为60%、100%、82.86%、100%、76.92%。MRI能全面展示双侧腋窝结构,提高异常ALN的发现率,尤其是数量、形态、大小异于对侧的转移性淋巴结,还提高了锁骨上下、胸骨旁、纵隔区异常淋巴结的发现率。

图3 女,52岁,乳腺癌。T1相及T2相见增大、边缘不规则的ALN(箭,A、B)
2.2 DWI DWI是一种无创性地检测活体中水分子扩散运动的方法,可在一定程度上反映组织内水分子运动的受限情况。在 DWI影像上扩散受到限制的区域将呈现为高信号,低表观扩散系数(ADC)可量化水分子扩散,利用 ADC值和 ADC比值区分转移性ALN及非转移性ALN[20]。Razek[21]对37例ALN肿大的乳腺癌患者行DWI,发现以淋巴结在DWI中呈高信号为检测因子诊断转移性 ALN具有较好的效能。以 ADC<1.3×10-3mm2/s作为转移性淋巴结的诊断标准,其灵敏度与特异性分别为 93%和 100%;以短轴及长轴比>0.6作为诊断标准,其灵敏度与特异性分别为100%和85.7%;合并2项诊断标准预测腋窝转移性淋巴结的灵敏度及特异性均为 100%。既往研究发现,转移性淋巴结的平均ADC值低于非转移性淋巴结[7,22];但ADC值提示转移性ALN的阈值尚无统一标准。通常b值越高,ADC值诊断转移性ALN越准确,但高b值易降低信噪比及图像分辨率,因此探索最佳的b值以得到最准确的ADC值尚需进一步研究。
2.3 DCE-MRI DCE-MRI是在快速注射造影剂的同时进行扫描,得到信号强度-时间曲线,从而反映病变组织的微循环、灌注和毛细血管通透性的变化。既往研究指出,DCE-MRI检测ALN转移的灵敏度、特异性、PPV、NPV分别为100%、56%、38%、100%[23]。由此可见,DCE-MRI由于检测ALN的特异性低,不能作为诊断 ALN转移的准确依据,但 DCE-MRI的NPV极高,可用于排除ALN转移。另外,DCE-MRI仍具有扫描时间长、扫描图像受呼吸运动影响等缺点。
DCE-MRI是以造影剂在组织中的扩散速度为基础,静脉注射造影剂后恶性组织表现为快速、明显的增强(图4)。近年来,超小顺磁性氧化铁颗粒(ultrasmall superparamagnetic iron oxide,USPIO)作为新型对比剂研究热点之一,其原理是造影剂在正常人体内被巨噬细胞吞噬后显像,而恶性淋巴结内巨噬细胞被肿瘤细胞代替,并改变淋巴结的结构,淋巴结缺乏USPIO的吸收,则在造影剂给药后保持高信号[24]。Lahaye等[25]研究发现,高信号面积越大,恶性程度越高。淋巴结内白色区域即高信号的估计面积>30%对于所涉及的淋巴结具有高度预测价值,其灵敏度与特异性分别达93%和96%。由此可见,USPIO作为对比剂的DCE-MRI是同时具有高灵敏度及高特异性的辅助检查方式,在 ALN转移的应用中值得进一步深入研究。

图4 女,52岁,乳腺癌。右侧腋窝见不规则肿大淋巴结(箭,A、B);动态增强扫描见该淋巴结快速、明显增强(箭,C)
3 正电子发射计算机断层显像(PET/CT)
PET是利用正电子核素标记葡萄糖等人体代谢物作为显像剂,通过病灶对显像剂的摄取反映其代谢变化,利用正常组织与肿瘤组织代谢上的差异对肿瘤做出诊断。联合CT具有早期、快速、准确、全面发现病灶的优点。利用人体氟代脱氧葡萄糖(fluorodeoxyglucose,FDG)摄取量的差异,摄取量高提示恶性细胞侵犯可能。Cooper等[26]对26篇评估PET或PET/CT的研究进行系统性统计,发现该方法对诊断 ALN转移的灵敏度较低(63%),而特异性较高(94%)。PET/CT灵敏度低的原因可能是空间分辨率低,不能识别直径正常的异常ALN。
然而,PET/CT作为一种全身性影像学检查,可同时扫查胸部、腹部、骨骼等系统,其在检测骨骼有无转移时比骨扫描更准确[27]。因此,PET/CT用于乳腺癌患者术前检查的主要意义在于判断内乳淋巴结、锁骨上淋巴结、胸骨旁淋巴结及远处器官有无转移。但PET/CT诊断ALN转移的低灵敏度始终不可忽视,在转移性淋巴结的诊断中缺乏明确标准化,在操作技术方面致使研究结果有所差异。
4 展望
目前常用的辅助检查方法均存在灵敏度低、无法探测所有可疑淋巴结等缺陷,可能的原因之一是微转移的存在所致形态学改变不足以引起影像学上的明显变化;但特异性较高,对已发现的异常淋巴结诊断准确性高。因此,PET/CT联合超声或MRI是较好的检查方法,可成为临床术前诊断 ALN转移可优先选择的方案。
