乳腺MRI非肿块样强化病变的影像学诊断进展
2018-08-14李晶英赵殿江
李晶英,赵殿江
北京大学国际医院放射科,北京 102206;
乳腺癌是一种常见的恶性肿瘤,对女性健康产生极大威胁。目前乳腺癌的发病率呈不断升高趋势[1]。青年人发生非肿块样乳腺癌的比例更高[2]。因此,及早发现并采取有效的治疗措施可显著提高乳腺癌患者的生存率。MRI检查软组织分辨率极佳,除可以显示形态学变化外,还能进行功能成像、提供血液动力学特点和生化代谢分析,且不受乳腺致密度的影响。近年来,随着乳腺MRI技术的逐渐发展,尤其是动态增强乳腺容积成像及扩散加权成像(DWI)技术的完善,MRI在诊断乳腺病变中具有独特的优势[3]。非肿块样强化(non-mass-like enhancement,NMLE)病变缺乏典型的影像表现,临床上容易漏诊或误诊,且病理类型广泛,是乳腺影像诊断的重点及难点之一。目前国内外对NMLE病变的研究及报道较少,对其诊断及鉴别诊断缺乏系统性认识。本文对NMLE病变的病理及影像学诊断进展进行综述。
1 NMLE病变的定义
美国放射学会组织编写的 MRI乳腺影像报告与数据系统(breast imaging report and data system,BIRADS)依据动态增强扫描后异常强化病灶的形态学特征将乳腺病变分为即点状(点/多点)病灶、肿块及NMLE 病变[4]。
NMLE病变指不具备肿块特征的一个强化区域,无占位效应和明确边界,瘤灶内常夹杂正常的乳腺腺体及脂肪组织(图1~3)。MRI BI-RADS依据NMLE病变的分布方式、内部强化特征对其进行描述,分布方式主要有局灶、线样、小叶节段样、区域、多区域及弥漫分布6类。2013年版BI-RADS删除了导管样分布,以线样分布代之。局灶强化指单个、体积小、局限不超过1/4象限的异常强化灶,其与点状强化不同,后者指<5 mm的强化灶,且局灶性强化区域内通常有散在分布的脂肪或正常腺体组织[4]。线状强化指强化呈线条状,可与导管走行不一致,在三维图像或冠状面图像上可看作一个面而非一条线,或可能沿非导管分布从左至右横穿乳腺[4];节段性强化呈以乳头为尖端的三角形或圆锥形,范围为一支导管及其分支;区域性强化指范围更大的强化,且与导管分布不一致,呈地图样,与周围组织界限不清;多区域性强化指出现多个区域强化,多个区域之间隔以脂肪组织或正常腺体;弥漫性强化指病灶弥漫、散在、广泛分布,甚至占据整个乳腺。内部强化特征主要有均匀、混杂、簇集样及簇状环形强化等,其中簇状环形强化是2013年版BI-RADS增加的一种类型,同时删除了较少使用的“网状强化”和“树枝状强化”[5]。均匀强化是融合一致的强化;而混杂强化是由正常乳腺腺体或脂肪组织随机分隔而导致的非均一性强化;簇集状强化指如鹅卵石融合般的肿块或病灶的汇集;簇状环形强化由Tozaki提出,并可分为由多个病灶围成的环形强化和不均匀强化区域内出现了聚集的环形强化[6]。

图1 女,45岁,乳腺高级别导管原位癌,右乳NMLE病变,BI-RADS 5级,小叶节段样分布、簇集样强化。DCE矢状位、冠状位及轴位均显示病灶呈尖段指向乳头的三角形,呈簇集样强化(A~C)
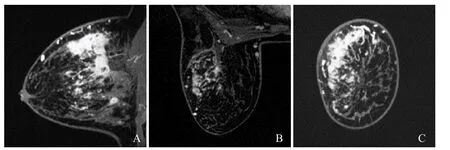
图2 女,49岁,乳腺炎伴多发乳腺脓肿,右乳NMLE病变,BI-RADS 5级,区域分布、混杂强化伴簇集环形强化。DCE矢状位、轴位及冠状位示病灶与脂肪、乳腺腺体间杂,分布范围大>1/4象限,内部呈不均匀强化(A~C)
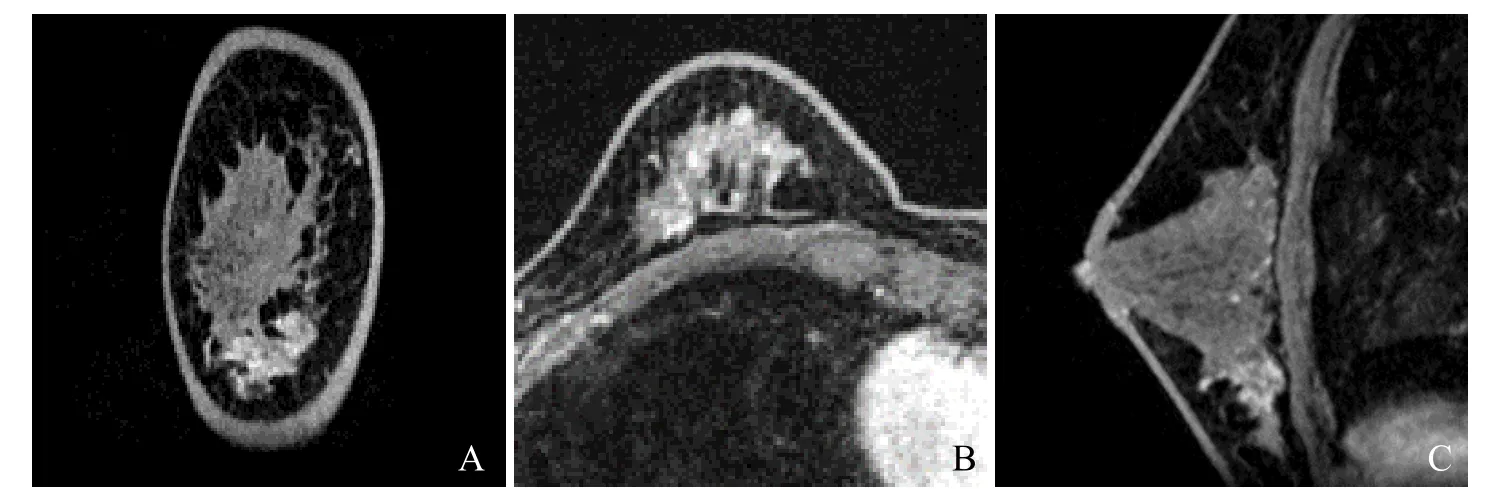
图3 女,36岁,乳腺腺病,右乳NMLE病变,BI-RADS 4级,局灶分布、混杂强化。DCE冠状位、轴位、矢状位示病灶<1/4象限(A~C)
2 乳腺NMLE病变的影像学与病理对照研究
NMLE的良性病变多为乳腺腺病、乳腺纤维囊性增生、纤维腺瘤、乳腺炎、脂肪坏死、乳腺内淋巴结等。常见的恶性病变主要包括导管原位癌(ductal carcinoma in situ,DCIS)、小叶原位癌、浸润性导管癌、浸润性小叶癌等;高危病变也可表现为NMLE,常见有导管不典型增生、小叶不典型增生及不典型乳头状瘤等[7-10]。李晓等[7]对 80例 NMLE病变进行研究,发现良性病变占36.2%,恶性病变占63.8%;其中单纯乳腺导管内癌(DCIS)占恶性病变的37.3%,浸润性导管癌占恶性病变的 56.9%。多项研究发现,NMLE病变的分布方式中,节段样强化最多见,且其阳性预测值最高,可达 67%~100%[8,11]。既往研究发现,NMLE病变表现为节段样、导管样分布时,常提示恶性征象,可能为DCIS、浸润性小叶癌或不典型导管增生,最常见于DCIS[12-13]。形态学标准中节段样强化是诊断DCIS的标志性征象[14]。Facius等[15]对74例导管原位癌的增强扫描后形态分析发现,表现为节段样分布的病灶占67.6%,其次为导管样强化。尽管节段样分布在良、恶性病变的鉴别中差异有统计学意义,但乳腺腺病、浆细胞乳腺炎(乳腺导管扩张症)、纤维囊性增生、乳头状瘤等良性病变也可表现为节段样分布,易导致过度诊断[15]。因此,当NMLE病变表现为节段样分布时,则需要依据患者年龄、相关症状及体征、内部强化特征、强化曲线、表观扩散系数(ADC)值等综合分析[8]。区域性强化可能为正常乳腺组织,也可见于乳腺囊性增生等良性病变。van Den Bosch等[16]报道,14例纤维囊性病变患者中,6例表现为区域性分布;Schnall等[17]报道区域性强化有21%的可能性为癌,且更常见于DCIS或浸润性小叶癌,很少在浸润性导管癌中出现。多区域性强化及弥漫性强化多见于乳腺增生等良性病变,但多中心导管原位癌亦可表现为弥漫性强化。病灶的强化特征有助于NMLE病变良恶性的鉴别诊断,均匀强化常见于良性病变,而簇状环形强化则提示恶性病变。
3 乳腺NMLE病变的影像学研究现状
3.1 超声 超声是乳腺病变的首选影像学检查方法,在乳腺病变的诊断中起着重要作用。超声无放射性损害,广泛应用于乳腺病变的诊断,在鉴别肿物囊实性方面具有独特优势,正确率可高达 96%~100%[1]。NMLE病变的定义来自于MRI BI-RADS,在超声和X线钼靶的BI-RADS词汇中无NMLE病变的概念[18-19]。Sotome等[20]研究发现,超声声像图中 95%的非肿块样乳腺癌在 MRI上也表现为 NMLE,这些乳腺癌的病理类型为浸润性小叶癌39%、DCIS 17%、侵袭性导管癌(导管内成分占优势)17%及侵袭性导管癌23%。超声检查主要依据病灶内部回声强度、边缘形态、血流信号、周围正常组织是否侵犯判断病灶的性质。NMLE病变在声像图上主要表现为片状低回声或中等回声区,伴或不伴钙化,有时也可表现为结构扭曲[21-22]。由于灰阶差异不显著,因此不易被发现,对病灶性质的判断很大程度上依赖于呈现为强回声的微钙化灶;然而超声对微小钙化灶的敏感性较低,导致诊断敏感度降低,且超声对于设备及检查医师存在依赖性[23]。随着超声技术和设备的快速发展,图像的分辨率越来越高,从二维灰阶超声和三维全容积成像、彩色多普勒超声到超声造影、弹性成像等技术的大力发展和应用使超声对NMLE病变的诊断准确率明显提高。
3.2 乳腺X线摄影(mammography,MG) MG操作简单,费用低,是乳腺疾病常用的检查方法。NMLE病变在MG图像上可表现为多种征象,如微钙化、结构扭曲紊乱、局灶性不对称致密、弥漫性腺体密度增高等,也可见部分伴随征象,如皮肤或乳头回缩、皮肤弥漫或局限性增厚、小梁增粗、腋窝淋巴结肿大等。伴随征象可单独出现或与钙化、结构紊乱伴发[4]。在致密型乳腺中,结构扭曲紊乱、局灶性不对称致密显示效能较差,易漏诊[24]。李晓等[7]研究发现,MG诊断敏感度较低(41.2%),主要原因为致密型腺体较多(77.5%)。MG对乳腺内钙化非常敏感,在检测钙化方面其他影像学检查方法无法比拟,而钙化的形态、分布对乳腺癌的诊断具有重要价值。然而MG检查尚存在一定的局限性,如假阴性率达10%~15%。针对目前MG存在的局限性,又推出了数字化乳腺断层合成摄影和对比增强能量谱MG技术。因此,超声和MG作为乳腺病变的首要检查手段不可替代。不能确定病变性质时,应该考虑采用MRI进一步检查。
3.3 动态增强 NMLE病变在MRI常规T1WI、T2WI中一般与正常腺体信号相似,故难以显示。DCE可显示病灶的血供情况,勾画肿瘤的轮廓,区别病变组织与正常组织,发现平扫不能显示的微小病变以及进行灌注成像[25-26]。DCE主要从形态特征和时间-信号强度曲线(time-intensity curve,TIC)方面对病灶进行评估。形态学分析在乳腺良恶性病变的诊断中有重要意义;而TIC和早期强化率是主要、直观的评价指标。TIC分为以下类型,I型:流入型,即整个过程持续强化,无明确峰值出现;II型:平台型,增强早期信号上升,中后期信号强度维持在一个平台水平,上升或下降幅度不超过10%,强化峰值在120~240 s;III型:流出型,即早期快速明显强化,中晚期信号强度明显下降超过早期强化峰值的10%。一般认为,I型曲线良性可能性大,III型曲线恶性可能性大,而II型良、恶性病变均有可能[27]。TIC类型对乳腺肿块的诊断具有重要价值,但对NMLE的良恶性鉴别诊断意义不大,其原因可能为:①NMLE病变内常含有部分正常腺体组织及脂肪成分,会导致测量的部分容积效应,而不能准确反映病灶的血流动力学特征;②NMLE恶性病变中大部分为DCIS,其缺乏血供、多钙化,此特点导致NMLE病变中各 TIC类型均可见[28]。王增奎等[11]对 70例NMLE病变进行研究,发现良性病变28例,其中TIC I型占 25.0%(7/28)、II型 46.4%(13/28)、III型 28.6%(8/28);恶性病变 42例,其中 TIC I型占 26.2%(11/42)、II型 52.4%(22/42)、III型 21.4%(9/42),差异无统计学意义。但也有文献认为早期强化率对NMLE病变的诊断具有重要价值。Jansen等[29]通过对697例乳腺病例的DCE图像进行分析发现,早期强化率对肿块性及NMLE的诊断具有重要价值,良性肿块性强化病变初始强化率较低、达峰时间较长、信号增强率较低,与恶性NMLE比较,良性NMLE具有较低的信号增强率。既往研究探讨乳腺灌注定量测量与表达方式,如利用两室药动学模型,通过测定血管内外对比剂的时间-浓度曲线,计算对比剂的容量转移常数(Ktrans)、速率常数(Kep),利用定量参数 Ktrans、Kep值对NMLE乳腺癌进行研究,通过分析NMLE乳腺癌内部的强化特征发现,动态增强定量参数对NMLE乳腺癌的诊断有参考价值[30-31]。Schmitz等[32]应用MRI最大强度投影技术对病灶相邻的血管数量进行评分,将MRI BI-RADS的特异性从74%提高到87%。
3.4 DWI DWI通过检测组织中水分子扩散受限的方向和程度可得到微观的水分子流动扩散情况,间接了解组织微观结构的变化。DWI扫描速度快、不需注射造影剂,并可同时选择多个参数,目前是乳腺方面应用最广泛的功能MRI技术[33-35]。乳腺恶性肿瘤的细胞繁殖旺盛,排列紧密,细胞核增大,细胞外容积减少,导致瘤内水分子扩散运动受限,使DWI呈高信号,对应ADC值减低。NMLE病变在DWI上可呈线样、小叶节段样、导管样、区域性或多区域高信号,DWI对于NMLE病变良恶性的鉴别诊断价值较低,但相对应的ADC值可作为一项定量指标。恶性病变的ADC值显著低于良性病变[36],故 ADC值有助于鉴别良恶性病变。王增奎等[11]通过分析70例NMLE病变发现,恶性组平均ADC值为(1.09±0.22)×10-3mm2/s,低良性组为(1.36±0.27)×10-3mm2/s,差异有统计学意义。尽管DWI速度快、敏感性高,但其空间分辨率较低,不能全面观察病灶,因此不能单独做诊断,需与具有较高空间分辨率的DCE相结合。
3.5 多种成像参数及多种影像学检查联合应用 MRI DCE及DWI对NMLE病变的诊断均具有一定价值,联合应用可进一步提高诊断准确性。Yabuuchi等[12]对一组NMLE病例分析发现,节段性、分隔样强化并ADC值<1.3×10-3mm2/s时多提示恶性征象,敏感性、特异性、阳性预测值、阴性预测值及准确率分别为87%、86%、93%、75%及 86%。Pinker等[37]研究发现,联合应用DCE和DWI对乳腺病变具有较高的特异性,尤其是对NMLE病变,从而提高诊断准确率。
乳腺超声和X线钼靶作为乳腺病变筛查的一线检查手段不可替代。随着超声仪器的发展、技术的进步以及图像分辨率的提高,X线钼靶对乳腺微钙化的检出具有独特的优势。在诊断效能方面,超声和钼靶有一定的互补性。联合应用超声、X线钼靶能够提高乳腺MRI对NMLE病变的诊断准确性。
综上所述,目前国内外对于乳腺肿块样病变的研究已经较为成熟,且有统一的诊断标准。NMLE病变缺乏典型的影像表现,临床容易漏诊或过度诊断。将DCE形态学特征、TIC曲线、DWI ADC值或其他影像学检查联合诊断可以提高其诊断准确率。
