钆塞酸二钠增强MRI与肝细胞肝癌分化程度的相关分析*
2018-08-11熊廷伟龚明福廖翠薇张启川
熊廷伟,龚明福,廖翠薇,张启川,张 冬
(中国人民解放军陆军军医大学第二附属医院放射科,重庆 400037)
肝细胞肝癌(HCC) 是临床上常见的恶性肿瘤之一,全球发病率居于恶性肿瘤的第5位,致死率居于第3位[1]。我国90%以上的HCC患者常伴有乙型病毒性肝炎(HBV)或丙型病毒性肝炎(HCV)或肝硬化[2]。早诊断、早治疗是提高肝癌患者生存率的重中之重。穿刺活检是术前诊断HCC的金标准,但它具有有创、存在偏倚、易导致并发症等缺点,因此急需探索一种无创、准确、方便的诊断方法。磁共振成像(MRI) 具有软组织分辨率高,多参数、多方位成像,无X 射线辐射等优点,MRI肝胆特异性对比剂钆塞酸二钠(Gd-EOB-DTPA,商品名为普美显) 是由德国拜耳医药保健有限公司生产的MRI对比剂,具有能被正常功能的肝细胞所摄取的特性,一方面具有与普通对比剂类似的生物学特性;另一方面,注射一段时间后,普美显可通过肝细胞膜表面的有机阴离子转运系统(OATP)进入肝细胞内,可滞留数小时,甚至24 h之久,从而为MRI检查提供一个相当长的扫描时间窗,再通过胆道系统排出体外;Gd-EOB-DTPA增强MRI检查不但可以采集动态期图像以显示病灶的血供情况;而且可以采集肝胆期图像以评估肝细胞的功能,只有有功能的肝细胞才摄取Gd-EOB-DTPA,并在肝胆期呈高信号,没有功能的肝细胞不摄取Gd-EOB-DTPA,肝胆期呈低信号。有研究显示在小肝癌(SHCC)的诊断及发现病灶能力方面Gd-EOB-DTPA有其独特的优势[3],文献[4-5]报道,Gd-EOB-DTPA增强MRI 检查在诊断HCC方面的灵敏度和特异度较多排螺旋CT(MDCT)及钆喷酸葡胺(Gd-DTPA)高,更具优势。也有研究表明HCC分化程度是影响患者预后的重要因素[6],现笔者以病理学结果为金标准,探索Gd-EOB-DTPA增强MRI平扫及肝胆期信号与HCC分化程度的关系。
1 资料与方法
1.1一般资料 收集本院2014年5月至2016年5月因临床、实验室检查和(或)其他的影像学检查诊断为HCC的32例患者,其中男30例,女2例;年龄39~70岁;分为肝硬化组17例,非肝硬化组15例;根据WHO消化系统肿瘤分类将32例患者的40个肿瘤分为高、中、低分化3组,其中高分化组10个,中分化组22个,低分化组8个。纳入标准:(1)经术后病理学检查确诊的患者;(2)患者Child-Turcotte-Pugh(CTP)分级均为A级。排除标准:(1)有MRI检查禁忌证者;(2)合并严重系统性疾病或肝肾功能不全者;(3)对钆类对比剂过敏者;(4)图像质量不符合阅片要求者。
1.2方法
1.2.1MRI检查设备及参数 MRI检查采用GE3.0T MR扫描仪。患者取仰卧位,扫描范围为膈肌至肝下缘。采用高压注射器经肘静脉团注Gd-EOB-DTPA,剂量为0.1 mL/kg,注射速度为2 mL/s。注射对比剂后立即用20 mL生理盐水以相同注射速率冲洗,以确保对比剂全部进入患者体内。平扫、动态期及肝胆期均采用肝脏容积加速采集(LAVA)三维动态增强扫,动脉期为注射对比剂后20 s,门脉期60 s,平衡期120 s,肝胆期为注射对比剂后20 min行全肝扫描。具体参数如下:TR为2.6 ms,TE为1.2 ms,矩阵为256×224,FOV为38~38 mm,重建层厚为3.0 mm,层间距为-1.5 mm,带宽为125 KHz。
1.2.2图像分析 所有图像均传输至图像存储与传输系统(PACS)进行分析。由1位腹部影像诊断医师和1位副教授在GE公司4.4后处理工作站独立测量肿瘤信号强度值及病灶最大径,整个过程严格遵循盲法。在平扫和肝胆期的图像上采用圆形感兴趣区(ROI)法测量病灶内的信号强度,测量指标包括病灶信号强度(SILes)、周围正常肝实质信号强度(SILiv)、背景噪声的标准差(SDBack)。背景噪声的ROI置于右前腹壁以外处,因该处与肝脏部位的运动伪影最接近[6]。ROI直径为20~30 mm,不能超出病灶范围,同时避开液化坏死区、血管区及有伪影的区域,对于信号较均匀的病灶进行3次测量并取平均值,对于没有液化且病灶信号不均匀的病灶均行3次以上多处、多次测量并取平均值,每个指标的最终结果为2位测量者测量结果的平均值。分别计算肿瘤的信号噪声比(SNR)、强化率(ER)、相对强化率(RER)和相对信号强度比(RIR)。计算公式如下[6-8]:SNR=(SILes-SILiv)/SDBack×100%;ER=(SILes肝胆期-SILes平扫)/SILes平扫×100%;RER=(SILes肝胆期-SILiv肝胆期)/(SILes平扫-SILiv平扫)×100%;RIR=SILes/SILiv×100%。
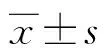
2 结 果
2.1不同分化程度HCC的影像学及病理表现 32例患者(40个病灶)中,分化程度为高分化10个、中分化22个、低分化8个,见图1~3。图1患者男,39岁,为高分化HCC患者。图2患者男,51岁,为中分化HCC患者。图3患者男,42岁,为低分化HCC患者。

注:1A为高分化HCC(白箭头)肝胆期信号表现,病灶表现为低信号;1B为病理图片(HE×200)
图1高分化HCC
2.22组患者各项指标比较 肝硬化组与非肝硬化组各项指标比较,差异无统计学意义(P>0.05)。见表1。
2.3各项指标与HCC分化程度的相关分析 肝硬化组分化程度与对应SNR、ER、RER、RIR、年龄、血清AFP水平及病灶最大径之间无相关性(P>0.05)。见表2。非肝硬化分化程度与相应RER、年龄之间存在相关性(P<0.05),而与SNR、ER、RIR及血清AFP水平及病灶最大径之间无相关性(P>0.05)。见表3。总体样本分析HCC分化程度与对应RER之间存在相关性(P<0.05),而与SNR、ER、RIR及年龄、血清AFP水平及病灶最大径之间无相关性(P>0.05)。见表4。
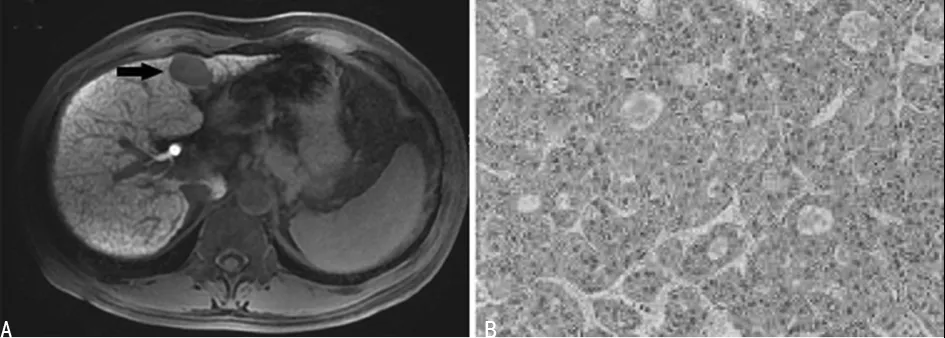
注:2A为中分化HCC(黑箭头)肝胆期信号表现,病灶表现为低信号;2B为病理图片(HE×200)
图2中分化HCC
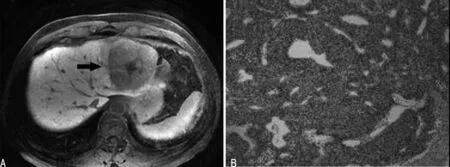
注:3A为低分化HCC(黑箭头)肝胆期信号表现,病灶变现为稍高信号;3B为病理图片(HE×100)
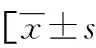
图3 低分化HCC
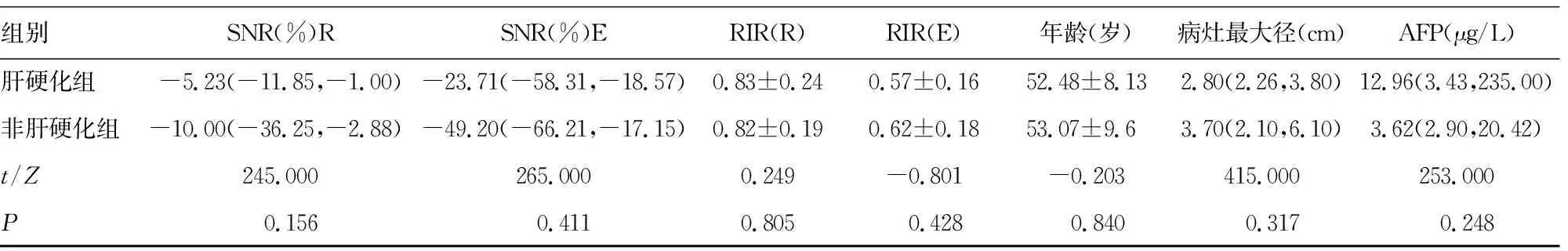
组别SNR(%)RSNR(%)ERIR(R)RIR(E)年龄(岁)病灶最大径(cm)AFP(μg/L)肝硬化组-5.23(-11.85,-1.00)-23.71(-58.31,-18.57)0.83±0.240.57±0.1652.48±8.132.80(2.26,3.80)12.96(3.43,235.00)非肝硬化组-10.00(-36.25,-2.88)-49.20(-66.21,-17.15)0.82±0.190.62±0.1853.07±9.63.70(2.10,6.10)3.62(2.90,20.42)t/Z245.000265.0000.249-0.801-0.203415.000253.000P0.1560.4110.8050.4280.8400.3170.248
注:LesR为平扫病灶信号强度值;LivR为平扫正常肝组织信号强度值;LesE为肝胆期病灶信号强度值;LivE为肝胆期病灶信号强度值;ER为强化率;RER为相对强化率;RIR(R)为平扫病灶、肝组织信号强度比;RIR(E)为肝胆期病灶、肝组织信号强度比;SNR(R)为平扫信噪比;SNR(E)为肝胆期信噪比;AFP为甲胎蛋白

表2 肝硬化组HCC分化程度与各指标的相关分析

续表2 肝硬化组HCC分化程度与各指标的相关分析
注:同表1

表3 非肝硬化组HCC分化程度与各指标的相关分析
注:同表1
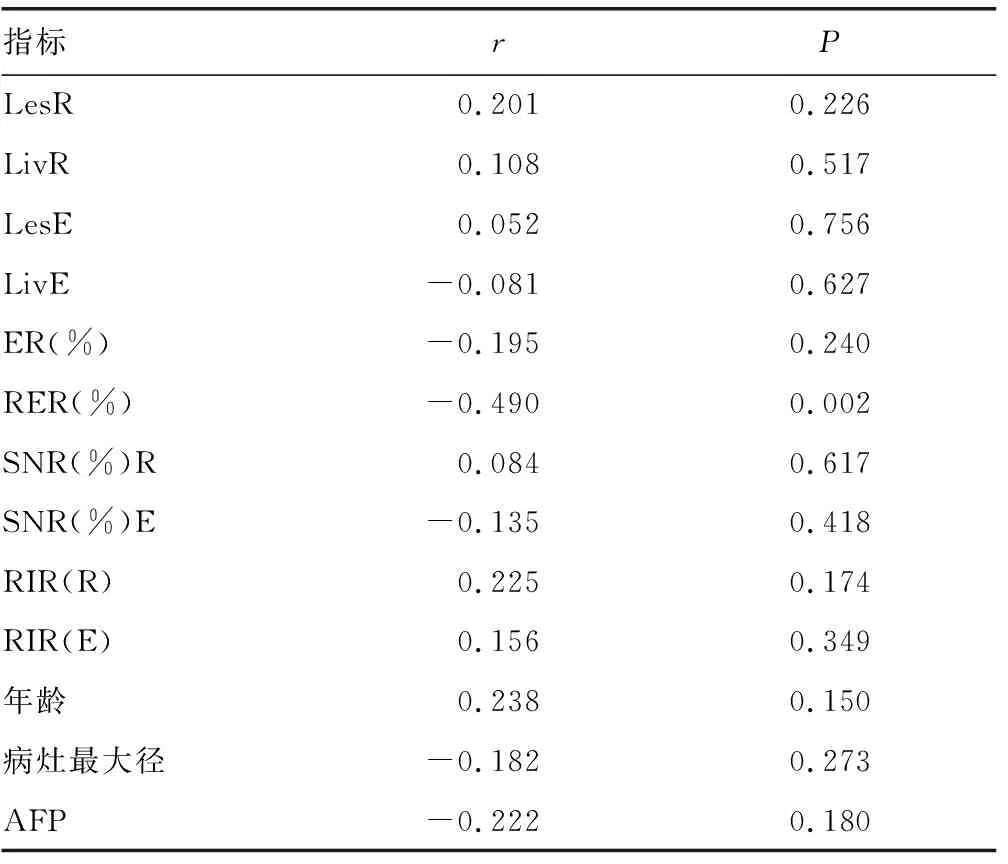
表4 所有研究对象HCC分化程度与各指标的相关分析
注:同表1
3 讨 论
HCC是原发性肝癌中最常见的一类。术前准确评价HCC的恶性程度,有利于治疗方案的制订及预后的准确评估。目前对术前HCC分化程度评估手段较少,且存在一定局限性。本研究中,首先进行肝硬化组与非肝硬化组基线资料比较,结果显示各项指标间存在可比性;然后对总体样本、肝硬化组及非肝硬化组各项指标进行独立的统计分析。其次笔者将SNR、ER、RER、RIR、年龄、血清AFP水平及病灶最大径与HCC分化程度进行相关分析,这样可以通过多因素分析、增加结果的真实性、可信性,旨在探索术前无创评估HCC分化程度。KIM等[7]对81例肝硬化、肝功能A级的HCC患者(共包括122个HCC病灶)Gd-EOB-DTPA增强肝胆期RIR、RER分析表明高分化HCC肝胆期RIR及RER明显高于中、低分化HCC。而本研究结果显示肝硬化组中RER、RIR等各项指标与HCC分化程度间无相关性(P>0.05),分析原因笔者认为肝硬化本身会导致肝细胞功能下降,从而影响肝细胞摄取功能,而肝硬化HCC的Gd-EOB-DTDA增强肝胆期信号就可能受到肝硬化、HCC本身细胞功能及不同分化程度HCC的多重因素影响,具体原因有待进一步研究。而本研究中非肝硬化组RER与HCC分化程度呈负相关(r=-0.66,P=0.007),分析结果可以看出部分HCC肝胆期也可以摄取Gd-EOB-DTPA,根据文献[9]分析其分子机制可能为病灶中肝细胞膜表面OATP的表达。MIURA等[10]对77例HCC患者进行基因分析,其中分化程度高的HCC有14例,分化程度低的HCC有63例,结果显示在分化程度高的HCC中OATP的基因表达呈强阳性,而在分化低的63例HCC中只有2例OATP的基因表达呈阳性,其余61例均为阴性。通过以上研究可以看出不仅是分化程度高的HCC,而且有小部分分化程度低的HCC细胞OATP的表达也会上调,而OATP是Gd-EOB-DTPA分子进入肝细胞的主要载体,所以笔者认为这种因素可能会影响肝胆期HCC的信号强度。而本研究非肝硬化组中除RER与HCC分化程度存在相关性外,肝胆期病灶信号强度、ER、RIR与HCC分化程度均不存在相关性,原因有待进一步研究。有研究表明肝胆期低信号HCC恶性程度较高,而且肝胆期低信号HCC患者血清AFP水平较高信号者高[11],而本研究结果显示肝胆期病灶信号强度及血清AFP水平与HCC分化程度均未见相关性。NORIHIDE等[12]提出HCC患者血清AFP水平可能与β-连环蛋白的表达有关,基于本研究样本量较小,所以笔者认为可以在AFP基因表达方面通过大量本做进一步研究、探索,或许能解决这方面的问题。
综上所述,笔者认为Gd-EOB-DTPA增强MRI肝胆期信号预测非肝硬化患者HCC分化程度有一定的价值,而对预测肝硬化患者HCC分化程度的价值有限。分析原因笔者认为本研究存在以下不足:(1)纳入患者时存在选择性偏倚,本组仅纳入了CTPA级的患者;(2)样本量较小,这可能会导致统计结果存在偏倚,因此仍需大样本进一步研究。
