山竹果皮浸泡酒的活性成分及抗氧化活性变化
2018-08-10农仲文刘晓静于立梅陈海光
农仲文,刘晓静,于立梅*,陈海光
(仲恺农业工程学院 轻工食品学院,广东 广州 510225)
山竹(Garcinia mangostana)又叫倒捻子、凤果、莽吉柿,属于藤黄科藤黄属,是一种间杂交的异源多倍体果实,原产地为马来西亚和印度尼西亚,主要分布于一些东南亚国家(如菲律宾、泰国、越南等),我国广东、广西、云南、福建等地也有种植,是一种典型的热带水果[1-3]。其果肉浅白而透明,清香爽滑,酸甜可口,可溶性固形物含量为16.8%,碳水化合物含量约为14.3%~15.6%,蛋白质、脂肪、矿物质元素含量丰富,被誉为“果后”[4-5]。果皮呈紫红色或紫褐色,质量占单个果实鲜质量的52%~68%,是为数不多的几种厚皮果实之一[6]。山竹主要以果肉作为食用部分,果皮一般不用于食用,但由于果皮中含有大量的果胶和粗纤维及丰富的植物多酚类物质,具有非常高的药用价值,因而被广泛应用于腹痛、腹泻、痢疾、化脓、感染性创伤等疾病的治疗[7-8]。随着生活水平的提高,人们越来越重视食品中的天然成分对人体健康的作用。浸泡酒是一种传统的酒类加工工艺,由于其制作方便,易于保存,一直以来得到十分广泛的应用。据中医药理分析,酒具有通血脉的作用,山竹浸泡酒可使山竹果皮与酒的效用协同发挥。
本试验以山竹果皮为原料,研究浸泡过程中多酚、黄酮、色度、花色苷等活性物质含量的动态变化,并以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力和铁离子还原能力(ferric ion reducing antioxidant power,FRAP)为评价指标,探讨山竹果皮浸泡酒浸泡期间抗氧化能力变化规律,以期能制备出一种能够清除人体内多余自由基的浸泡酒。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
山竹:市售。
1.1.2 试剂
二锅头酒(酒精度55%vol):北京市新京酿酒厂;福林酚试剂、1,1-二苯基-2-三硝基苯肼(DPPH)、三吡啶基三嗪(2,4,6-tris(2-pyridyl)-1,3,5-triazine,TPTZ)、芸香叶苷标准品(纯度>98%):美国Sigma公司;无水乙醇、浓硫酸、苯酚、冰乙酸、甲醇、乙酸乙酯、香草醛(均为分析纯):广州一码生物科技公司
1.2 仪器与设备
DK-S22电热恒温水浴锅:广东环凯微生物科技有限公司;DGSB/20-002A台式干燥箱:重庆试验设备厂制造;WFZ800-D3B紫外分光光度计:上海汇质精密仪器有限公司;SHB-3循环水多用真空泵:郑州杜甫仪器厂;JJ-2B组织捣碎机:常州德杜仪器精密仪器有限公司;PH-3C数字型酸度计:上海雷磁仪器厂。
1.3 实验方法
1.3.1 浸泡方法
将山竹果皮和果肉分离,果皮均匀切片(5 cm×3 cm),分为两份(一份为鲜样,另一份45℃烘箱中烘至质量恒定),不同前处理的果皮分别放入细口瓶中,用白酒浸泡,加盖密封后25℃避光贮存。定期检测酒样多酚、黄酮、花色苷含量、色度及DPPH自由基清除率和铁离子还原力。取样时间间隔1 d。
1.3.2 测定方法
多酚含量[9-10]:移取0.5 mL稀释至一定倍数的样品液,样品液中加入试剂,并在波长760 nm处测定吸光度值。利用绘制的标准曲线计算样品液中所含的多酚含量。样品中的多酚含量以每毫升浸泡酒中所含没食子酸微克数计。
色度的测定[8,11]:移取约4 mL样品液于比色皿中,以蒸馏水为空白,分别于波长420 nm、520 nm处测定吸光度值,色度值=A420nm+A520nm。
黄酮的测定[12]:精确称取0.01 g芦丁溶解于无水乙醇中并定容至10 mL,得到质量浓度为1 mg/mL的芦丁标准液。分别吸取芦丁标准溶液0、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL于5 mL比色管中,分别加入体积分数30%的乙醇溶液定容至2.5 mL,再加入5%亚硝酸钠溶液0.15 mL,混匀后放置5min,加入10%硝酸铝溶液0.15mL,摇匀,放置6min后再加入1 mol/L NaOH溶液1 mL,用体积分数30%的乙醇溶液定容至5 mL,混匀,静置15 min,于波长510 nm处测定吸光度值。以芦丁含量(x)为横坐标,吸光度值(y)为纵坐标绘制标准曲线,标准曲线为y=0.273x+0.028。移取1 mL样品液,将样品液加入试剂,于波长510 nm波长处测定吸光度值并根据芦丁标准曲线计算出黄酮含量。
花色苷含量的测定:参考文献[13]的方法并做了修改。将样品液分别用pH1.0与pH4.5的缓冲溶液稀释至适当的倍数,避光放置15 min。分别于波长510 nm、700 nm处测定吸光度值,以蒸馏水作为空白。计算样品液中花色苷含量,其计算公式如下:

式中:A为吸光度值差值;M花色苷相对分子质量,449.2,mg/mol;n=为样品液的稀释倍数;ε为花色苷摩尔吸光系数,26 900。
DPPH自由基清除率[14]:准确移取样品液0.2 mL,加入DPPH标准溶液4 mL,对照用0.2 mL酒精度55%vol的白酒代替样品液,准确反应20 min,以无水乙醇作为空白,于波长517 nm处测定吸光度值,计算样品的DPPH清除率,其计算公式如下:
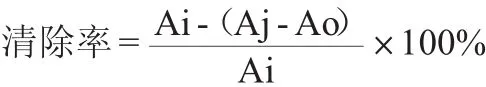
式中:Ai为0.2 mL样品液加4 mL DPPH标准液的吸光度值;Aj为0.2 mL样品液加4 mL无水乙醇的吸光度值;Ao为0.2 mL酒精度55%vol白酒加4 mL DPPH标准液的吸光度值。
铁离子还原能力[15-16]:准确称取0.278 g FeSO4·7H2O,用蒸馏水溶解并定容至100 mL,得到浓度为10 mmol/L的FeSO4溶液,从溶液中分别移取1mL、2mL、4mL、6mL、8mL、10 mL并分别定容至100 mL,即得到浓度为0.1 mmol/L、0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L的FeSO4溶液。分别移取0.1mL各浓度的标准液,加入0.3mL蒸馏水与3 mL铁离子还原能力测定工作液,混匀,置于37℃水浴中保温10min,于波长593nm处测定吸光度值,空白用蒸馏水代替标准液。以Fe2+含量(x)为横坐标,吸光度值(y)为纵坐标绘制标准曲线,标准曲线为y=0.644x-0.018。准确移取稀释至一定倍数的待测样液0.1 mL,按照标准曲线绘制的方法加入试剂,于37℃水浴保温10 min,于波长593 nm处测定吸光度值。样品FRAP还原能力以达到同样吸光度值所需的FeSO4的毫摩尔数表示。
1.3.3 数据分析
每个试验测定重复3次,获得平均值和标准偏差。应用SPSS 19.0软件对所有试验最终数据进行分析,检验差异显著性(P<0.05表示差异显著,P<0.01表示差异极显著)。
2 结果与分析
2.1 活性物质的变化
2.1.1 山竹果皮浸泡过程中多酚含量的变化

图1 不同处理的山竹果皮浸泡过程中多酚含量的变化Fig.1 Changes of polyphenols contents during the soaking process of mangosteen peel with different treatments
由图1可以看出,随着浸泡时间的延长,鲜样品及烘干样品浸泡酒中的多酚含量逐渐上升,第7天后上升速度趋势较平缓。因为原料颗粒溶质的溶解扩散有一定的速度,随着浸提时间的延长,固液两相中的多酚含量逐渐趋于平衡。7~9d多酚含量的变化平缓,主要是由于浸泡时间越长,溶剂渗透原料越充分,溶出量越大。经过7d的浸泡,大部分多酚基本溶出,鲜样品浸泡酒中多酚含量由26.02 μg/mL升至453.45 μg/mL,提高了427.43 μg/mL;烘干样品浸泡酒中多酚含量由45.81 μg/mL升至480.82 μg/mL,提高了435.01 μg/mL。使用烘干样品浸泡的多酚含量始终高于鲜样浸泡。因此,选用烘干样品浸泡7 d,酒的多酚含量较高。2.1.2山竹果皮浸泡过程中花色苷含量的变化

图2 不同处理的山竹果皮浸泡过程中花色苷含量的变化Fig.2 Changes of anthocyanin contents during the soaking process of mangosteen peel with different treatments
由图2可以看出,浸泡酒中的花色苷含量随着浸泡时间的延长增加,当浸泡3 d时溶出量达到最佳,此时鲜样品浸泡酒中花色苷含量为1.43 mg/L,烘干样品浸泡酒中花色苷含量为1.76 mg/L。继续延长浸泡时间,鲜样品浸泡酒中的花色苷含量在7 d下降幅度大,说明鲜样花色苷不稳定,易受到温度、光照等因素影响而改变,因此随着浸提时间增加,酒中花色苷含量增加,但浸提时间过长,溶解到酒中的花色苷受到外界环境的影响,则会发生分解、转化,从而导致其含量下降;烘干样品浸泡酒的花色苷含量在浸泡3 d后略有下降,但一直都高于鲜样品浸泡酒中花色苷含量,因此,选用烘干样品浸泡3 d,酒的花色苷含量较高。
2.1.3 山竹果皮浸泡过程中黄酮含量的变化

图3 不同处理的山竹果皮浸泡过程中黄酮含量的变化Fig.3 Changes of flavonoid contents during the immersing process of mangosteen peel with different treatments
由图3可以看出,浸泡酒中的黄酮含量随着浸泡时间的延长增加,在浸泡前3天黄酮含量变化显著,此后3~7 d黄酮含量变化不显著(P>0.05),当浸泡时间达到7 d时,鲜样品的黄酮量为1.94 mg/mL,烘干样品为2.43 mg/mL,浸泡9 d后黄酮含量略有下降。因此,选用烘干样品浸泡7 d,酒的黄酮含量较高。
2.1.4 山竹果皮浸泡过程中酒色度的变化

图4 不同处理的山竹果皮浸泡过程中酒色度值的变化Fig.4 Changes of chromaticity value during the soaking process of mangosteen peel with different treatments
由图4可以看出,酒的色度值随浸泡时间延长而升高,当浸泡5d时酒色度值达到最高,鲜样品色度值为0.32,烘干样品色度为0.34;继续延长浸泡时间,酒的色度稍有下降。色度值反映的是酒所呈现的颜色,主要由酚类物质花色苷、单宁含量决定,同时受酒液pH等其他因素的影响[17]。结合活性物质的溶出量,可以看出,色度值与多酚、黄酮、花色苷溶出量的变化趋势相似,说明浸出物含量少时,多酚、单宁浸出量少,酒体颜色较浅。因此,选用烘干样品浸泡5 d,酒的色度较好。
从两种样品浸泡酒的多酚、花色苷和黄酮含量变化来看,烘干样品并不会使原料中的活性物质减少,反而稍高。黄酮与多酚都是醇溶性物质,容易溶解于乙醇中而被提取出来。由于黄酮与多酚一样具有清除自由基和对抗各种心脑血管疾病的效果,而烘干样品后的黄酮量更多,故认为浸泡前将原料预先进行烘干更好,原料也容易保藏。因此综合考虑,选用烘干样品浸泡7 d时活性物质溶出效果较好。
2.2 抗氧化活性
2.2.1 浸泡过程中DPPH自由基清除率变化

图5 山竹果皮浸泡过程中DPPH自由基清除率变化Fig.5 Changes of DPPH free radical clearing rate during the soaking process of mangosteen peel
由图5可以看出,在开始浸泡的3 d内,酒中的DPPH自由基清除能力迅速上升,在第3天时鲜样品的自由基清除率为76.64%,烘干样品为77.77%;随着浸泡时间的延长,DPPH自由基清除率趋于稳定,由于浸泡过程中溶出的许多物质(如多酚、黄酮等)都具有抗氧化能力,这些具有抗氧化能力的物质共同作用会使样品的抗氧化效果增加。故当浸泡时间达到3 d时,样品中的抗氧化能力已经达到稳定。烘干样品不会对DPPH清除率造成影响,两种样品抗氧化能力无显著性差异(P>0.05)。这与酒中多酚、黄酮、花色苷等活性成分含量变化的趋势一致。因此,为使山竹酒清除DPPH自由基能力较高,选用烘干样品,浸泡的时间为3 d即可。
2.2.2 浸泡过程中FRAP值的变化

图6 山竹果皮浸泡过程中FRAP值的变化Fig.6 Changes of FRAP values during the soaking process of mangosteen peel
从图6可以看出,在浸泡过程中,酒的FRAP值逐渐上升,并在浸泡7 d达到最高值,随后稍有下降。当浸泡时间达到7 d时,鲜样品的FRAP值为3.73×10-4mmol,烘干样品的FRAP值为6.422×10-4mmol。虽然FRAP值与DPPH自由基清除能力一样反映的是样品的抗氧化能力,但结合两幅图来看,两种方法得到结果并不同步。也许是由于外界环境或者样品中存在的其他物质对其中一个方法的效果产生一定的影响,所以会显示出不一样的趋势。因此,选用烘干样品浸泡7 d较为合适。
上述结果说明山竹酒的抗氧化能力是溶在其中的多酚、黄酮、花色苷等多种活性成分综合作用的结果。山竹果皮浸泡酒的DPPH自由基清除率与总含量、黄酮含量呈强正相关。烘干样品DPPH清除率和多酚、黄酮含量的相关系数0.969,0.939。铁离子还原力与多酚含量、黄酮含量和花色苷含量均呈正相关,相关系数分别为0.723、0.661、0.829。综合上述实验结果,烘干的山竹果皮用白酒浸泡7 d后,得到的酒液中主要活性成分含量较高,抗氧化活性较好。
3 结论
山竹果皮富含多种活性成分,山竹浸泡酒可使山竹果皮与酒的效用协同发挥。研究山竹果皮浸泡过程中多酚、黄酮、色度、花色苷等活性物质含量的动态变化及抗氧化活性,可以丰富山竹果的综合利用。果皮浸泡过程中活性成分溶出量均随浸泡时间的延长而增加,且烘干样品效果较好。其中花色苷含量在浸泡3 d时较高,为1.76 mg/L;黄酮、多酚含量在浸泡7 d时较高,含量分别为2.43 mg/mL、480.82 μg/mL;浸泡5 d时酒色度达到最高,为0.34。抗氧化活性实验结果表明,在浸泡过程中,DPPH自由基清除率在3 d达到稳定,为77.77%,而还原能力在第7天达到稳定,FRAP值为6.422×10-4mmol。山竹酒的抗氧化能力与多酚含量、黄酮含量和花色苷含量均呈正相关。因此,烘干的山竹果皮用白酒浸泡7 d后,得到的酒液中主要活性成分含量较高,抗氧化活性较好。
