开菲尔直投式发酵剂在益生菌干酪生产中的应用研究
2018-08-10陈旭峰史改玲樊伟鑫
陈旭峰,史改玲,樊伟鑫,许 女*
(1.山西农业大学 实验教学中心,山西 太谷 030801;2.山西农业大学 食品科学与工程学院,山西 太谷 030801)
开菲尔是利用天然存在的混菌发酵体系(开菲尔粒)对牛羊乳等进行发酵得到的一种发酵乳,又称牛奶酒或酸乳酒,起源于高加索地区,在我国,开菲尔主要在青藏高原、新疆、内蒙等地区流行[1-2]。开菲尔粒是一种由微生物细胞及其代谢产物同蛋白质和碳水化合物所组成的呈乳白至乳黄色、形状不规则的凝胶状弹性颗粒,其表面和内部均富含多样化的益生菌群,主要是乳酸菌(干酪乳杆菌乳脂乳球菌(Lactococcus lactisssp.cremoris)、乳酸乳球菌(Lactococcuslactis)、嗜热链球菌(Streptococcusthermophilus)等)、醋酸菌(Acetobactersyzygii、Gluconobacteraponicas等)和酵母菌(酿酒酵母(Saccharomyces cerevisiae)、克鲁维酵母(Kluyveromyces)等)[3-5],存在着复杂的共生关系和协同代谢机制。开菲尔具有较强的环境适应能力和抗污染能力,富含多种微量元素、叶酸、泛酸、各种游离脂肪酸,具有抗肿瘤、抗氧化、提高免疫力、调节血脂血糖、保护胃肠道、抑菌等生理功能[6-7],因此开菲尔成为国内外研究的热点。
目前关于开菲尔的研究主要集中在微生物多样性、动态变化;益生菌种分离、鉴定;营养保健、生理功能;发酵酸奶、豆奶、奶酒、饮料等方面[6-8]。开菲尔是重要的益生菌菌群资源,而干酪较高的pH值、脂肪含量和特殊的空间网络结构,可以为益生菌提供一个较长而且稳定的存活环境,相比传统发酵乳制品(酸奶、乳饮料等)更适合做益生菌的载体[9]。DIMITRELLOU D等[10]将开菲尔菌粒分离菌株冻干粉应用在Feta干酪和乳清干酪的生产中,发现开菲尔发酵剂可以加速干酪的成熟,改善风味。GONCU A等[11]考察了开菲尔粒、普通酸奶发酵剂Rhodia TMA 081(包括保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜热链球菌)及商业干酪发酵剂SM 306和SM 309(包括乳酸乳球菌乳酸亚种(Lactococcus lactissubsplactis)和乳酸乳球菌乳脂亚种(Lactococcus lactissspcremoris))对白色盐腌干酪成熟过程中理化和感官的影响,最终证明开菲尔白腌干酪的感官评价最优,显示出开菲尔粒作为干酪发酵剂的良好潜力。KATECHAKI E等[12-13]通过热风干燥工艺成功制备出活性高、成本低的固定化开菲尔混合菌株干粉发酵剂,并将其应用在硬质干酪和乳清干酪的生产中,考察了其对干酪基础理化、挥发性香气和感官的影响,证明了开菲尔干酪具有作为益生菌良好载体的产品优势。
纵观以往研究,利用开菲尔源分离菌种作为发酵剂应用于干酪生产,存在菌种分离不全的缺陷,最终形成的发酵产品与开菲尔全粒发酵成品具有品质、风味和益生功能上的差距。而采用开菲尔整粒发酵生产干酪的研究多见于国外,开菲尔的地域来源不同,菌相构成差异很大,国内鲜有关于将西藏开菲尔整粒发酵剂应用于益生菌干酪的研究。因此,本研究主要以FD-DVS R-704商业干酪发酵剂(嗜热链球菌∶保加利亚乳杆菌=1∶1)为对照,将西藏来源的开菲尔整粒经真空冷冻干燥制备成直投式发酵剂应用于硬质干酪的生产中,并对其基础理化指标、挥发性香气成分、质构特性和感官指标进行测定与评价,以期为新型的开菲尔粒益生菌干酪的开发奠定一定理论基础,并拓宽开菲尔粒的应用范围。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌种
原料乳(脂肪3.5%,蛋白质3.2%):山西农业大学牧站;开菲尔粒:西藏传统农家;FD-DVS R-704商业干酪发酵剂(嗜热链球菌∶保加利亚乳杆菌=1∶1):丹麦科汉森公司。
1.1.2 试剂
凝乳酶(3 333.3 U/g):丹麦科汉森公司;脱脂奶粉:完达山乳业股份有限公司;海藻糖(食品级):广州华柏食品添加剂有限公司;山梨醇(食品级):北京中泰天盟化工产品有限公司;麦芽糊精(食品级):河北华辰淀粉糖有限公司;乳清粉(食品级):湖南维兴生物科技有限公司。
1.1.3 培养基
细菌计数琼脂(plate count agar,PCA)培养基、马铃薯萄葡糖琼脂(potato dextrose agar,PDA)培养基、乳酸细菌(deMan Rogosa Sharpe,MRS)培养基、醋酸菌培养基:均购自山东青岛海博生物技术有限公司。
开菲尔粒活化培养基:原料乳(脂肪3.5%,蛋白质3.2%),高压115℃灭菌15 min。
乳清液:取40 g乳清粉溶解于1 000 mL蒸馏水中,调pH值至5.5,沸水浴加热40 min,冷却至4℃,8 000 r/min离心20 min,上清液即乳清液。
开菲尔粒增殖培养基:30 mL乳清液,2 g葡萄糖,1 g蛋白胨,1 g酵母膏,0.2 g(NH4)2SO4,0.2 g KH2PO4,0.02 g MgSO4·7H2O,用蒸馏水定容至100 mL,高压115 ℃灭菌20 min。
1.2 仪器与设备
PYX-DHS-50X65-BS-Y恒温培养箱:上海联进医疗器械厂;RE-201D旋转蒸发仪:巩义市英峪仪器厂;TA.XTplus质构仪:英国Stable Micro Systems公司;Trace1300气相色谱-TraceISQ质谱(gas chromatography-mass spectrometer,GC-MS)联用仪、HP-5-MS毛细管柱:赛默飞世尔科技(中国)有限公司;PB-10 pH计:德国Sartorius公司;722G可见分光光度计:上海精密科学仪器有限公司;TDL-4低速离心机:上海安亭科学仪器厂。
1.3 试验方法
1.3.1 开菲尔直投式发酵剂的制备
开菲尔粒的活化:将开菲尔粒浸泡于无菌生理盐水中,5 h后用无菌纱布过滤出开菲尔粒,并用无菌水反复冲洗后按4%(W/V)的接种量接种于开菲尔粒活化培养基中,25℃培养,每隔4 h晃动一次,培养48 h。相同条件传代3次,再滤出开菲尔粒,即为活化好的开菲尔粒。
开菲尔粒的增殖培养:将活化的开菲尔粒按4%(W/V)的接种量接种于增殖培养基中,在25℃恒温培养箱中培养,每隔4 h晃动一次,培养48 h。
开菲尔直投式发酵剂(directed vat set,DVS)的制备:将开菲尔粒过滤捞出,4℃、8 000 r/min离心10 min,收集菌体,按照菌泥与保护剂质量比为3∶1的比例添加保护剂,制备菌悬液,将上述菌悬液在-80℃的冰箱中预冻3 h,然后在冷阱温度-51℃、真空度9 Pa条件下,真空冷冻干燥30 h,制得开菲尔直投式发酵剂。
保护剂:脱脂奶粉10 g(高压115℃灭菌15 min),海藻糖1.5 g、甘油0.5 g、山梨醇2 g、麦芽糊精1 g、蒸馏水100 mL(高压121℃灭菌15 min)。
1.3.2 开菲尔直投式发酵剂稳定性检测
分别在4℃和25℃条件下保存开菲尔直投式发酵剂,每隔3个月测定开菲尔粒冻干菌粉中的细菌、乳酸菌、醋酸菌和酵母菌活菌数。细菌、乳酸菌、醋酸菌和酵母菌分别采用PCA培养基、MRS培养基、醋酸菌培养基和PDA培养基进行稀释平板菌落计数。
1.3.3 干酪加工工艺流程及操作要点
干酪加工工艺流程:
原料乳标准化→杀菌及冷却→添加发酵剂→添加CaCl2→添加凝乳酶→切割、搅拌排乳清→堆积排乳清→加盐入模→压榨成型→真空包装
具体操作要点:
(1)原料乳标准化处理:滤除去牛乳中的杂质和泡沫,对原料乳进行标准化处理,调整酪蛋白/脂肪为1∶0.7;
(2)杀菌及冷却:63℃巴氏杀菌30 min,然后迅速降低至发酵温度(30℃);
(3)添加发酵剂:上述冷却后的牛乳中添加开菲尔直投式发酵剂或FD-DVS R-704商业干酪发酵剂,添加量为0.015%(W/V);
(4)添加CaCl2:以10%CaCl2溶液的形式缓缓加入,并搅拌均匀,添加量为0.01%(V/V);
(5)添加凝乳酶:凝乳酶提前用2%的盐溶液配制成1%的凝乳酶溶液,在28~30℃的温水中保温25 min左右,添加了发酵剂和CaCl2的牛乳pH降至6.4~6.5时,添加0.5%(V/V)的凝乳酶;
(6)切割、搅拌排乳清:添加凝乳酶使凝乳充分形成后,将凝乳切割成1 cm3大小的凝块,切割后的凝块需要在32℃搅拌25~30 min,之后以1℃/5 min速度进行加温搅拌,当升至40℃后停止加温继续搅拌50~60 min,排乳清;
(7)堆积排乳清:切割后堆积2.25 h,排乳清;
(8)加盐入模:将干酪在20%的盐水10℃条件下浸泡24 h,中间翻转一次;
(9)压榨成型:盐水浸泡后的干酪沥干后切成方砖形,装入成型器中先进行预压榨,压力0.2~0.3 MPa,时间20~30 min,再将干酪反转后装入成型器内,以0.4~0.5 MPa的压力在15~20℃条件下再压榨12~24 h。
(10)真空包装:成型后的干酪进行真空包装。
1.3.4 干酪理化指标的测定
按照文献[14]中的方法测定干酪中水分、脂肪、可溶性氮(soluble nitrogen,SN)(包括pH 4.6-SN、12%三氯乙酸(TCA)-SN)、总游离氨基酸(total free amino acids,TFAA)的含量和pH值。采用GC-MS法[15]测定游离脂肪酸的种类及含量,具体方法如下:
参考文献[14]中的方法的方法提取干酪中的游离脂肪酸。气相色谱条件:色谱柱HP-5-MS(30 m×0.25 mm×0.25 μm);进样口温度200℃;载气为氦气(He);载气流速1.0 mL/min;程序升温:130℃,1 min;以65℃/min升至170℃;以27℃/min升至215℃,保持12 min;以10℃/min升至280℃,保持3min;不分流进样。质谱条件:溶剂延迟时间2.0 min;传输线温度280℃;离子源温度220℃;离子化模式为电子电离(electron ionization,EI)源;电子能量70 eV;发射电流10 μA;扫描模式为全扫描,质量扫描范围为29~200 m/z。
定性定量方法:根据物质峰面积由大到小筛选100种物质,通过计算机检索,并与美国国家标准与技术研究院(national institute of standards and technology,NIST)质谱库提供的标准质谱图对照,根据匹配度的大小确定化合物的名称,通过归一化积分法得到化合物的相对百分含量。
1.3.5 干酪中挥发性香气成分的测定
参考文献[16]中的方法对干酪中的香气成分进行提取。色谱条件:HP-5-MS石英毛细柱(30 m×0.25 mm×0.50 μm);升温程序:50℃保持1 min,以5℃/min升温至220℃,保持10 min;进样口温度250℃;载气为氦气(He);载气流速1 mL/min;进样量1 μL;不分流进样。质谱条件:电离方式为电子电离;电子能量70 eV;传输线温度250℃;离子源温度230℃;扫描模式为全扫描,质量范围15~550 m/z。
定性定量的方法:同1.3.4。
1.3.6 干酪质构的测定
将干酪切成边长为2 cm的正方体进行质构(硬度、弹性、内聚性、胶黏性和咀嚼性)分析,每项测试重复3次。
测定模式与类型:质地剖面分析(textureprofileanalysis,TPA),测前速度5mm/s,测试速度1mm/s,测后速度5mm/s,间隔时间10 s,触发力0.4 N,探头直径2 cm。
1.3.7 干酪感官评价
国标GB 5420—2003《干酪卫生标准》[17]要求干酪色泽呈白色或乳黄色,表面均匀、有光泽,如添加色素则为该色素应有的颜色;组织细腻,质地均匀,具有该类产品应有的硬度;具有该类产品特有的滋味和气味,具有奶油味、风味良好。
2 结果与分析
2.1 开菲尔直投式发酵剂稳定性检测结果
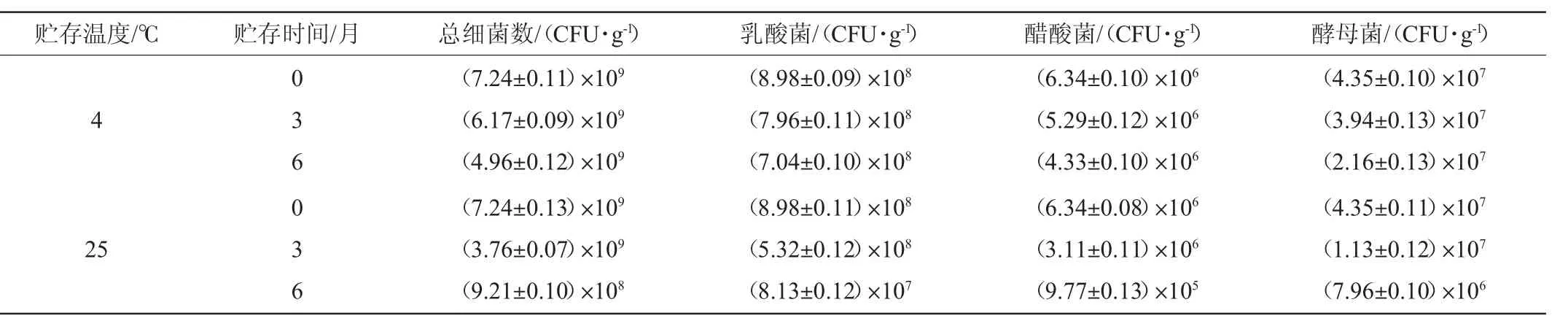
表1 开菲尔发酵剂贮存过程中微生物活菌数测定结果Table 1 Determination results of viable count of kefir DVS starter during the storage
开菲尔直投式发酵剂在4℃和25℃条件下保存6个月后,其中总细菌、乳酸菌、醋酸菌和酵母菌活菌数检测结果见表1。
由表1可知,开菲尔直投式发酵剂在4℃条件下保存6个月后,其总细菌、乳酸菌、醋酸菌和酵母菌活菌数分别维持在109CFU/g、108CFU/g、106CFU/g、107CFU/g水平,达到了联合国粮农组织(food and agriculture organization of the united nations,FAO)和世界卫生组织(world health organization,WHO)的要求,建议食品益生菌活菌数应在106~107CFU/g以上,表明该直投式发酵剂稳定性良好。25℃条件下保存6个月后,其总细菌、乳酸菌、醋酸菌和酵母菌活菌数分别下降了1个数量级。
2.2 干酪中水分、pH、脂肪、可溶性氮及总游离氨基酸含量的测定
干酪中水分、pH值、脂肪、pH4.6-可溶性氮、12%TCA-可溶性氮及总游离氨基酸的测定结果如图1所示。
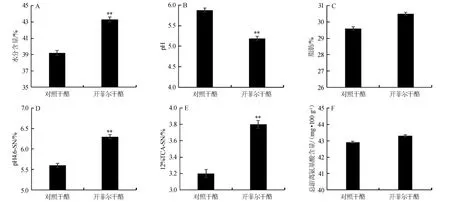
图1 两种干酪中水分(A)、pH值(B)、脂肪(C)、可溶性氮(D、E)及总游离氨基酸(F)的测定Fig.1 Determination of water content(A),pH value(B),fat(C),soluble nitrogen(D,E)and total free amino acid(F)in two kinds of cheese
由图1A可知,开菲尔干酪的水分含量(43.3%)极显著高于普通对照干酪(39.2%)(P<0.01),可能是由于开菲尔干酪中的微生物数较普通干酪多,各种代谢活动(如蛋白质、脂肪的降解,糖酵解和代谢产物间的生化反应等)较为旺盛,弱化干酪生产中凝乳酶形成的凝胶,进而提高了干酪中的水分含量[18]。
干酪的pH主要由发酵剂中乳酸菌发酵,以及残留在凝块中的乳糖形成的乳酸决定[19]。由图1B可知,开菲尔干酪的pH值(5.19)极显著低于普通对照干酪(5.88)(P<0.01),分析原因可能是开菲尔粒中的乳酸菌和醋酸菌代谢产生大量有机酸,使得开菲尔干酪的pH值较低。
脂肪含量的多少影响着干酪的组织状态,脂肪还被认为是干酪芳香和风味物质的来源[20]。由图1C可知,开菲尔干酪和普通对照干酪的粗脂肪比例分别为30.5%和29.6%,差异不显著(P>0.05)。
由图1D和图1E可知,开菲尔干酪和普通对照干酪的pH 4.6-SN含量分别为6.3%和5.6%,12%TCA-SN含量分别为3.8%和3.2%,开菲尔发酵剂极显著提高了干酪中的pH4.6-SN和12%TCA-SN的相对含量(P<0.01)。分析原因可能是开菲尔粒中的菌相丰富,不乏含有一些产蛋白酶和肽酶活性较强的菌,使得开菲尔干酪的蛋白水解程度提高,加快成熟。
游离氨基酸也是干酪风味的重要组成成分,主要是蛋白酶使β-酪蛋白发生强烈水解而产生,其含量的测定不仅可以评价蛋白质降解的程度,而且对于合理控制干酪产生良好风味和质地有很重要的意义。由图1F可知,开菲尔干酪和普通对照干酪总游离氨基酸含量分别为43.3 mg/100 g和42.9 mg/100 g,差异不显著(P>0.05)。
2.3 干酪中游离脂肪酸种类及含量的测定
干酪中游离脂肪酸含量的测定,对干酪特征风味的产生及不良风味产生的控制都有重要意义。干酪中FFA、饱和脂肪酸(saturatedfattyacid,SFA)、不饱和脂肪酸(unsaturated fattyacid,UFA)的种类和相对含量分别见表2~表4。由表2可知,两种干酪中检测出的饱和脂肪酸主要有癸酸、月桂酸、肉豆蔻酸、棕榈酸和硬脂酸等,这些中长链脂肪酸使得干酪的整体风味更加圆润。检测出的不饱和脂肪酸主要有反式肉豆蔻酸、11-十八碳烯酸、9-十八碳烯酸等,不饱和脂肪酸更有利于降低血清胆固醇和预防心血管病、高血压、高血糖等,提高干酪的营养价值[21]。由表3和表4可知,开菲尔干酪中饱和脂肪酸含量显著低于普通对照干酪(P<0.05),而不饱和脂肪酸的含量显著高于普通对照干酪(P<0.05)。
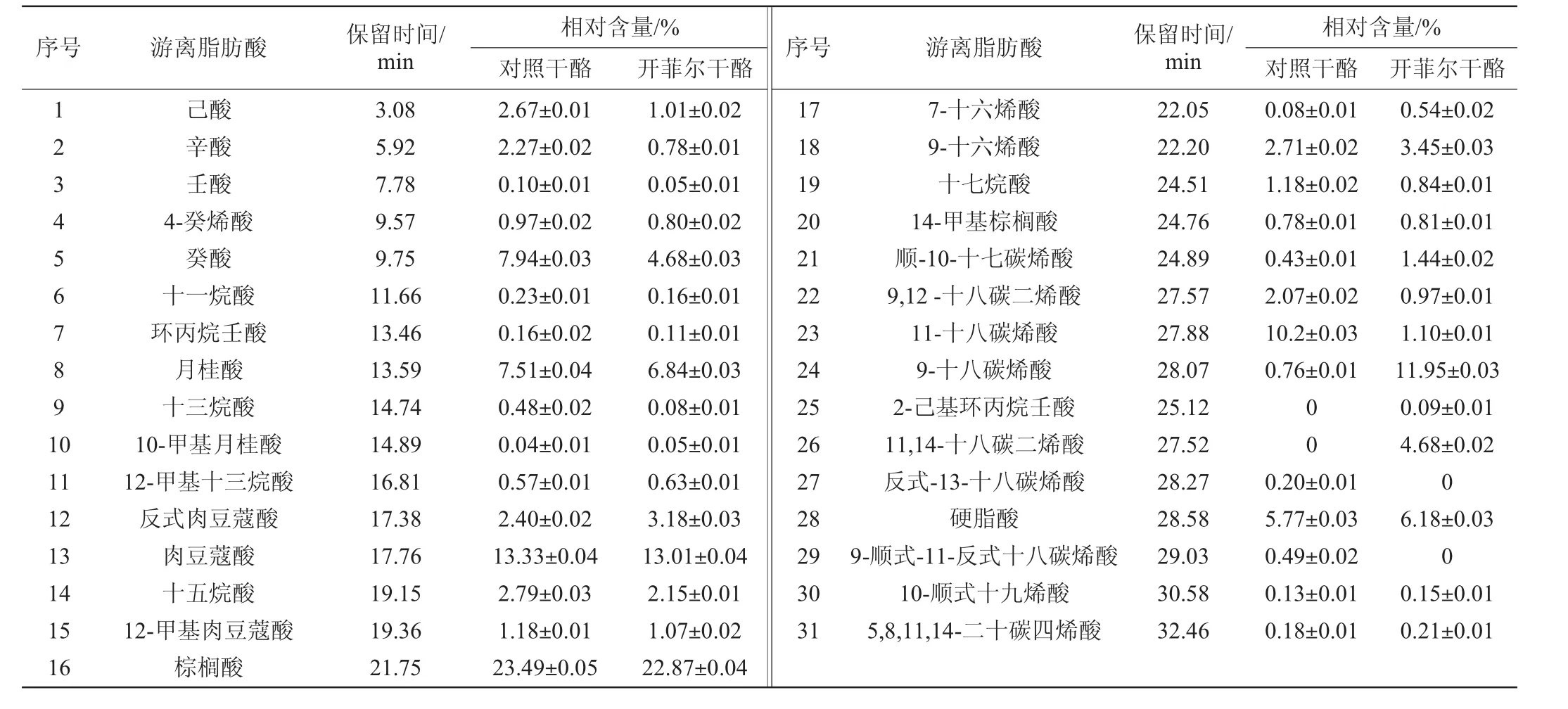
表2 两种干酪中游离脂肪酸的种类及相对含量Table 2 The kinds and relative content of free fatty acids in two kinds of cheese
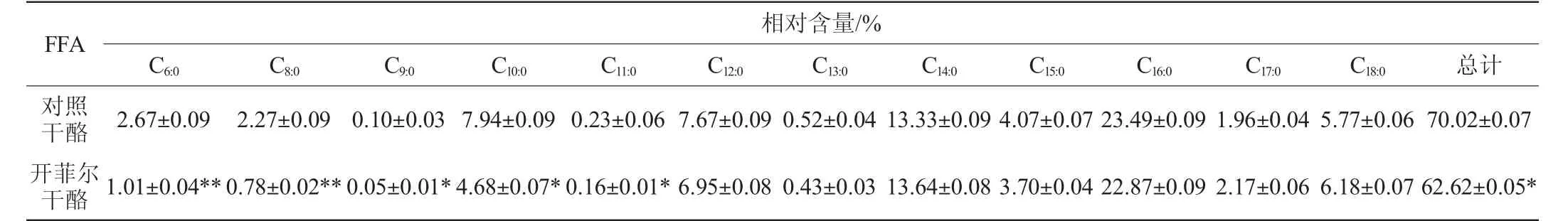
表3 两种干酪中饱和脂肪酸的相对含量Table 3 Relative content of saturated free fatty acids in two kinds of cheese
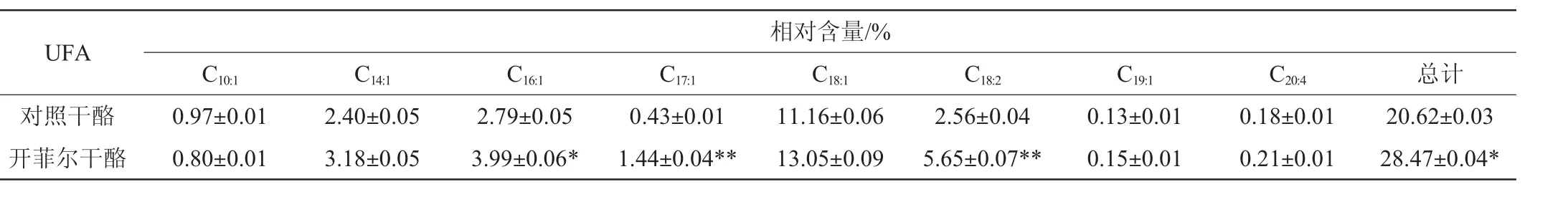
表4 干酪中不饱和脂肪酸的相对含量Table 4 Relative content of unsaturated free fatty acids in two kinds of cheese
2.4 干酪中挥发性香气物质的测定
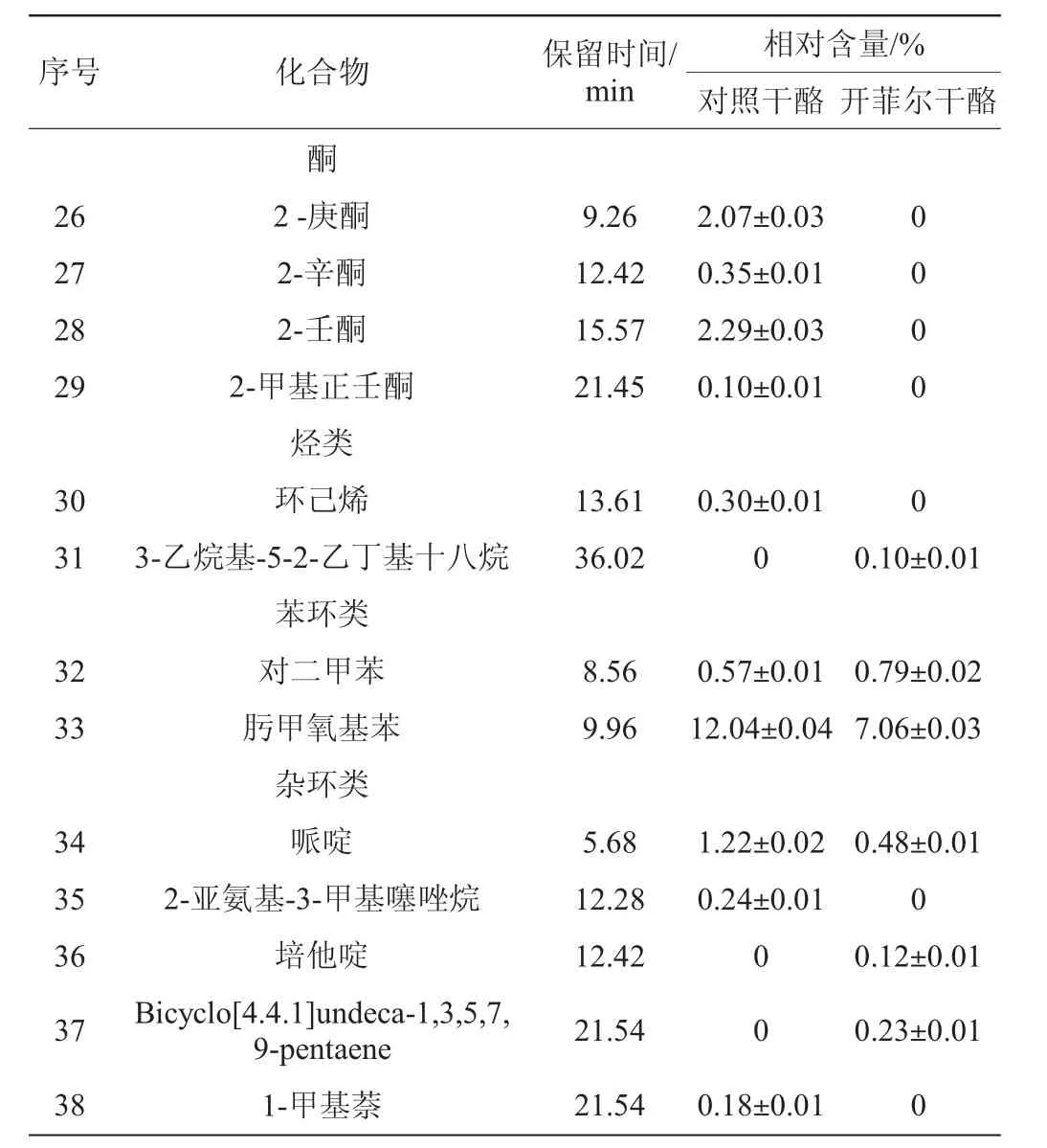
干酪风味是多组分构成的风味体系,其物质既包括原料乳中的风味化合物,又包括加工处理时乳成分在酶及微生物代谢时产生的代谢产物以及成熟过程中乳蛋白质、脂肪降解和糖酵解产物[22]。通过GC-MS分别检测两种干酪中的挥发性风味成分,各物质相对含量如表5所示。由表5可知,普通对照干酪中共检测出22种挥发性香气成分,包括4种醇类物质、5种酯类物质、3种醛类物质、4酮类物质、1种烃类物质、2种苯环类物质以及3种杂环类物质;开菲尔干酪中共检测出28种挥发性香气成分,包括1种羧酸类物质、10种醇类物质、9种酯类物质、4种醛类物质、1种烃类物质、2种苯环类物质以及3种杂环类物质。
有香味活性的酯主要通过酶促反应途径、醇解反应和酯化反应途径形成[23]。干酪中的酯类大部分为甲基酯和乙基酯,这些酯类主要是干酪中的脂肪水解形成的游离脂肪酸与乙醇和甲醇反应形成[24]。开菲尔干酪中的酯类物质种类(9种)远高于普通干酪(5种),具有白兰地酒香味的辛酸乙酯、威士忌酒香的乙酸苯乙酯、果香和脂香的3-甲硫基乙酸丙酯等酯类物质在两种干酪中均能检出。此外,在开菲尔干酪中还检测出2,3-二甲基丙酸丁酯、癸酸乙酯、月桂酸乙酯等其他酯类,分别赋予开菲尔干酪果香、椰子香、坚果等香气。一方面开菲尔粒中的微生物直接代谢产生酯类物质;另一方面,开菲尔粒中乳酸菌和醋酸菌代谢产生的有机酸与酵母菌代谢生成的醇类物质通过酯化反应也是酯类物质形成的另一主要原因。干酪中的醇类是由微生物代谢和醛还原产生[25-26]。开菲尔干酪中检测到10种醇类物质,而普通干酪中仅检测到4种,3-甲基正丁醇、2,3-丁二醇、3-甲硫基正丙醇和2-乙基己醇在两种干酪中均能检出,此外,开菲尔干酪中还检测到2-丁醇、2-庚醇、1-戊醇、1,3-丙二醇2-庚醇、苯乙醇等醇类物质。开菲尔粒中的酵母菌,如酿酒酵母、克鲁维酵母、单孢酿酒酵母、假丝酵母等代谢产生大量醇类物质,极大得丰富了开菲尔干酪中醇类物质的种类,提高其含量,赋予干酪果香味、甜味及酒精味。

表5 两种干酪中挥发性香气物质的种类及相对含量Table 5 The kinds and relative contents of volatile aromatic substances in two kinds of cheese
序号 化合物 保留时间/min相对含量/%对照干酪 开菲尔干酪酮26 27 28 29 9.26 12.42 15.57 21.45 2.07±0.03 0.35±0.01 2.29±0.03 0.10±0.01 30 31 13.61 36.02 0.30±0.01 0 0 0 0 0 0 0.10±0.01 32 33 8.56 9.96 0.57±0.01 12.04±0.04 0.79±0.02 7.06±0.03 34 35 36 37 38 2-庚酮2-辛酮2-壬酮2-甲基正壬酮烃类环己烯3-乙烷基-5-2-乙丁基十八烷苯环类对二甲苯肟甲氧基苯杂环类哌啶2-亚氨基-3-甲基噻唑烷培他啶Bicyclo[4.4.1]undeca-1,3,5,7,9-pentaene 1-甲基萘5.68 12.28 12.42 21.54 21.54 1.22±0.02 0.24±0.01 0 0 0.18±0.01 0.48±0.01 0 0.12±0.01 0.23±0.01 0
干酪中的醛类物质是由干酪中微生物产生的脱氨酶、脱羧酶、转氨酶或其他酶类作用于氨基酸,通过Strecker降解形成[27]。开菲尔粒作为发酵剂,可能含有更多可以产生作用于氨基酸和脂肪酸的酶类微生物,既而生成更多醛类物质。苯甲醛赋予干酪坚果香味、苦杏仁香味和焦味。壬醛和癸醛分别赋予干酪强烈的油脂味和柑橘香气。仅在开菲尔干酪中检测到的苯乙醛,赋予开菲尔干酪特殊的玉簪花香气。
开菲尔干酪中未检测出酮类物质,可能是由于一些醇类物质未被还原,而是先与酸类物质发生酯化反应生成了酯。而普通干酪中检测出的2-庚酮、2-辛酮和2-壬酮等酮类物质,这些物质主要是通过微生物的酯解作用和脂肪酸的代谢形成的[26],分别赋予干酪类似梨的水果香味、奶油香气及药草似香气[28]。
2.5 干酪质构的测定
质构是影响消费者购买干酪最关键的品质之一。干酪质构的测定可解释干酪的组织特性、品质及嗜好特性。干酪的质构特性测定结果见表6。由表6可知,较对照干酪,开菲尔干酪的硬度和咀嚼性极显著降低(P<0.01),胶黏性极显著增大(P<0.01),内聚性和弹性无明显差异(P>0.05),这与文献[29]报道的结果(可溶性氮含量越高,硬度、内聚性、咀嚼性越小,而胶黏性、弹性越大)一致。分析原因可能是与蛋白质基质的特性及脂肪的分布有关,蛋白质水解作用会使蛋白质基质结构的完整性破坏,导致凝聚性降低。此外,由于干酪凝块pH值减小与酪蛋白逐渐降解有关,所以较低的pH值也可能导致内聚性进一步降低。

表6 两种干酪的质构特性测定结果Table 6 Determination results of texture properties in two kinds of cheese
2.6 干酪的感官评价
由表7可知,两种干酪均为乳白色,表面均匀、有光泽,都具有干酪特有的滋味和气味,质地均匀,软硬适度,且开菲尔益生菌干酪具有开菲尔发酵乳的特有风味,带有适宜的酒香味。

表7 两种干酪的感官评价Table 7 Sensory evaluation of two kinds of cheese
3 结论
本研究将开菲尔粒制备成直投式发酵剂应用于益生菌干酪生产中,相比于FD-DVS R-704商业干酪发酵剂制作的干酪,开菲尔益生菌干酪的水分含量、pH4.6-SN及12%TCA-SN的含量极显著升高(P<0.01)、pH值极显著降低(P<0.01),而粗脂肪比例和TFAA无显著差异(P>0.05),不饱和脂肪酸含量显著增高(P<0.05);醇类和酯类物质的种类增多;硬度和咀嚼性极显著降低(P<0.01),胶黏性极显著增大(P<0.01),内聚性和弹性大无明显差异(P>0.05);开菲尔干酪呈乳白色,表面有光泽,不仅具有干酪特有的滋味和气味,且具有开菲尔发酵乳的特有风味,带有适宜的酒香味,说明开菲尔益生菌干酪具有良好的生产开发前景,为新型的益生菌干酪的开发奠定一定理论基础,并拓宽开菲尔粒的应用范围。
