小鼠心脏缺血再灌注模型中心肌树突状细胞的流式细胞评价
2018-08-08王大英张文全徐佑龙金惠根刘宗军
刘 鸣 王大英 张文全 徐佑龙 金惠根 刘宗军
(上海中医药大学附属普陀医院心内科 上海 200062)
急性心肌梗死是临床常见的危重症,对急性闭塞血管行再灌注治疗是挽救缺血心肌及改善临床预后最有效的方法,但同时也会造成心肌的缺血再灌注损伤(ischemic-reperfusion injury,IRI),严重影响疗效。不论是血流中断、缺氧引起的心肌细胞坏死,还是再灌注后的氧化应激等机制引起的心肌损伤,或是本身即富含炎症免疫成分的血流灌注,以上早期即可引发局部及全身的非特异性炎症免疫反应,贯穿并直接影响心肌损伤及修复的全过程[1-3]。单核细胞、巨噬细胞、中性粒细胞、树突状细胞(dendritic cell,DC)等炎症细胞是IRI相关炎症免疫反应的关键环节,是识别损伤、调节免疫炎症反应的主体[4]。早在1993年Zhang等[5]在大鼠心肌梗死模型的免疫组化研究中发现缺血梗死的心肌边缘有大量DC浸润,临床研究发现心肌梗死急性期患者外周血DC急剧减少[6-7],与早期预后有关;但DC在梗死心肌的定量分析、在总体炎症细胞中所占比例以及与时间相关的变化规律,仍缺乏相关研究。针对这一问题,我们采用小鼠心脏单个细胞悬液制备方法,在小鼠心脏IRI模型中对心肌DC进行定量分析,选择CD11c作为流式细胞检测的特异性标记,同时研究单核细胞的Ly6C标记,以期为IRI的相关免疫炎症反应这一庞大炎症机制网络提供重要补充。
材 料 和 方 法
材料实验动物:10~12周龄SPF级雄性C57BL/6小鼠,由上海斯莱克实验动物有限责任公司提供(批准号:SCXK沪2012-0002)。主要试剂及仪器:RPMI-1640培养基、胶原酶Ⅰ购自美国Gibco公司,DNase Ⅰ购自美国MBI公司,流式细胞抗体PE-Cy5 anti-mouse CD45、PE anti-mouse CD11c及同型对照购自美国eBioscience公司,FITC Rat Anti-Mouse Ly6C及同型对照购自美国BD公司;流式细胞仪购自美国BD公司。
动物模型制备小鼠经乙醚麻醉后行气管插管,连接呼吸机,设定呼吸机潮气量200~300μL,频率120次/min,连接心电图。取左前胸部切开,逐层分离皮下组织,在第3肋间用胸廓撑开器暴露手术视野,打开心包,暴露心脏,以左心耳及肺动脉圆锥为标志寻找前降支,以8-0丝线在左心耳下1~2 mm处进针。假手术组仅穿线不结扎,IRI手术组穿线后绕两圈打一个活结,肉眼观察结扎线至心尖部位的心肌变苍白,活动减弱,心电图出现特征性ST段抬高并与增宽的QRS波群融合,说明结扎成功。留取较长的活结线头至胸外以备松解。缝合胸壁后继续呼吸机辅助呼吸及乙醚麻醉,结扎30 min后拉胸外的活结线头进行松解,心电图ST段逐渐回落,证明心脏IRI模型制备成功(图1)。分别在再灌注1、2、4和7天时摘取小鼠心脏制备心脏单个细胞悬液。每个实验组3~7只小鼠。
心肌单个细胞悬液制备配置心脏消化液:在RPMI-1640培养基溶液,加入1.6 mg/mL胶原酶Ⅰ和0.2 mg/mL DNase,每个心脏标本用量约11 mL。小鼠心脏摘取后PBS冲洗去除血液,于2 mL离心管中加入1 mL心脏消化液,尽量剪碎;移至15 mL离心管中,加入10 mL心脏消化液,室温放置60 min,间断混匀。140目滤网过滤,收集滤过液于15 mL离心管中,114×g离心10 min,去上清,加入200μL PBS悬浮+2 mL红细胞裂解液放置5 min,114×g离心5 min,去上清后用1 mL PBS悬浮。对心肌单个细胞悬液行细胞计数。
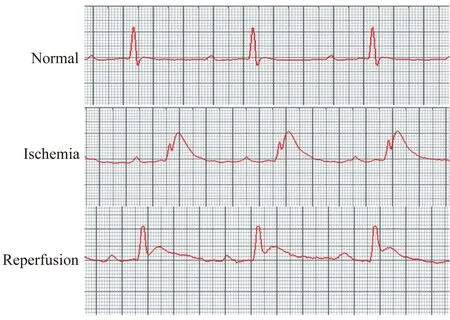
图1 正常、缺血及再灌注小鼠心电图
流式细胞检测与分析策略以CD45标记白细胞(图2A),选取CD45阳性细胞进一步以CD11c和Ly6C标记细胞亚群(图2B,纵轴CD11c,横轴Ly6C)。取200μL悬浮液同时加入CD45、CD11c、Ly6C抗体或同型对照,10 min后PBS洗1次,避光待流式细胞检测,同型对照管只在最初测试抗体特异性时设置。获取200 000~700 000个细胞(根据其中CD45阳性细胞比例调整)。
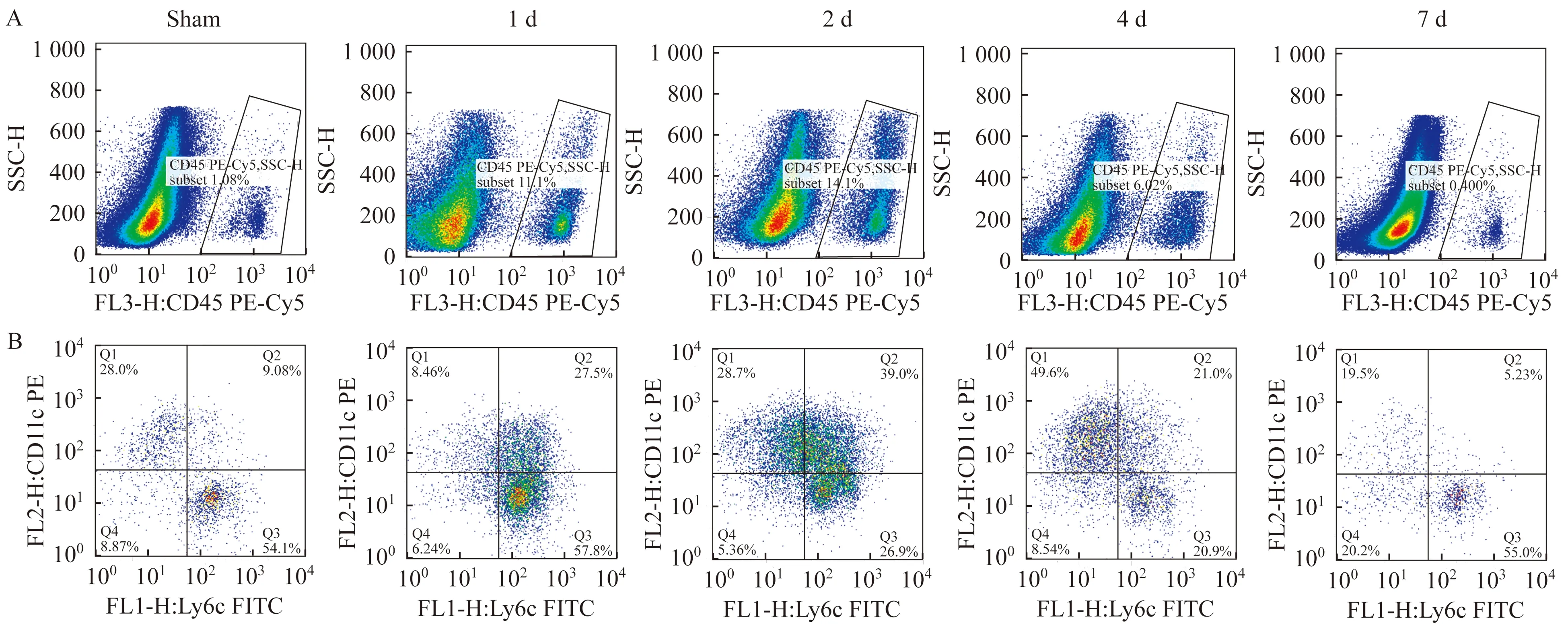
A:Leukocyte;B:DCs and monocyte subpopulation.
图2假手术组及心脏IRI组术后不同时间点小鼠心脏单个细胞悬液的流式细胞检测图
Fig2Flowcytometryforsinglecellsuspensionsfrommice’sheartinthesham-operatedgroupandcardiacIRIgroupatdifferenttimepoints
结 果
细胞计数每个心脏标本制备所得的单个细胞悬液获得的细胞总数为(1~2)×106个。
各组细胞的比例变化CD45阳性细胞占心肌细胞的比例、CD45阳性细胞中CD11c和Ly6C标记的4组细胞的相对比例如表1所示。对假手术组、不同缺血再灌注时间的IRI组进行组间比较,结果显示以下指标在组间具有显著差异:CD45细胞比例、CD11c+Ly6C-、CD11c+Ly6C+、CD11c-Ly6C+细胞相对比例(表1);CD11c-Ly6C-细胞相对比例在组间未见差异有统计学意义。变化规律如下:(1)CD45阳性细胞占总细胞数的比例在再灌注1天时即达到高峰,之后逐渐恢复至对照组水平(其中1天时为13.88%,较对照组的0.90%,P<0.05;2、4和7天时与对照组间差异无统计学意义。(2)CD45阳性细胞群中CD11c和Ly6C标记的细胞亚群的相对比例不同。对照组CD11c+Ly6C+细胞相对比例最低为6.87%、CD11c-Ly6C+最高为56.72%。小鼠心脏IRI模型中CD11c+Ly6C+DC动态变化最为明显,持续升高(1、2和4天与对照组相比,P均<0.05),7天时恢复至对照组水平(P>0.05);与之相反,CD11c-Ly6C+单核细胞比例在再灌注后降低(2和4天分别与对照组相比,P均<0.05),7天时恢复至对照组水平(P>0.05);CD11c+Ly6C-DC相对比例的变化呈降低后再升高的趋势(2和4天分别较1天升高,P均<0.05),7天时恢复至对照组水平(P>0.05);CD11c-Ly6C-细胞无显著变化(组间比较P>0.05)。再灌注2天时CD11c+Ly6C-、CD11c+Ly6C+、CD11c-Ly6C+约各占CD45阳性细胞的1/3。
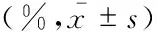

LeukocyteShamIRI 1 dIRI 2 dIRI 4 dIRI 7 dχ2PCD45+0.90±0.2513.88±10.70(1)10.68±3.863.44±1.610.87±0.5117.620.001Q1 (CD11c+Ly6C-)25.58±15.7011.73±1.8429.06±5.3640.73±9.0921.00±5.5812.590.013Q2 (CD11c+Ly6C+)6.87±3.3230.53±3.70(1)32.74±4.09(1)19.80±1.21(1)6.46±1.3018.250.001Q3 (CD11c-Ly6C+)56.72±19.9050.03±5.0830.36±5.00(1)30.80±9.77(1)57.83±5.8614.300.006Q4 (CD11c-Ly6C-)10.81±4.237.72±2.157.84±1.768.68±0.8814.70±3.247.550.109
(1)vs.Sham,P<0.05.
各组细胞占总细胞数的百分比变化CD11c、Ly6C标记的4组细胞在总心肌细胞中的百分比,即各组在CD45阳性细胞中的相对比例×CD45阳性细胞在总心肌细胞比例。对假手术组和不同时间点的IRI组进行组间比较,结果显示各细胞亚群在总心肌细胞中的百分比差异均有统计学意义。再将IRI不同时间点的各组细胞亚群百分比与假手术组进行两两比较,在1~2天较对照组均有显著升高(P<0.05),除1天时CD11c-Ly6C+单核细胞的7.06%较对照组的0.50%有升高趋势(P=0.05,表2),各组的达峰时间在1~2天,7天时恢复至对照组水平(图3)。
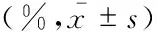

LeukocyteShamIRI 1 dIRI 2 dIRI 4 dIRI 7 dχ2PCD45+0.90±0.2513.88±10.70(1)10.68±3.863.44±1.610.87±0.5117.620.001Q1 (CD11c+Ly6C-)0.24±0.171.63±1.233.05±1.01(1)1.49±0.980.18±0.0916.910.002Q2 (CD11c+Ly6C+)0.06±0.034.18±3.11(1)3.46±1.240.69±0.370.05±0.0218.010.001Q3 (CD11c-Ly6C+)0.50±0.167.06±5.953.33±1.680.96±0.110.36±0.2118.430.001Q4 (CD11c-Ly6C-)0.096±0.0391.01±0.69(1)0.83±0.320.3±0.160.068±0.03916.940.002
(1)vs.Sham,P<0.05.

图3 各组细胞占总细胞数的百分比变化Fig 3 Percentage of cell populations in total heart cells in the sham-operated and IRI mice
讨 论
本实验首次通过制备心肌组织的单个细胞悬液对小鼠心脏IRI模型的心肌DC进行了定量分析,经流式细胞检测明确其随时间的变化规律。以CD45标记缺血损伤时浸润心肌的白细胞,再以CD11c和Ly6C双标记研究了浸润细胞中的DC和单核细胞的标记漂移情况,定量、直观、动态地表现出了心肌缺血1周的标记转变。对照组小鼠的心肌单个细胞悬液中白细胞比例低(CD45阳性比例0.9%),以CD11c+和Ly6C+单阳性细胞为主(CD11c-Ly6C+占56.72%、CD11c+Ly6C-占25.58%、CD11c+Ly6C+占6.87%、CD11c-Ly6C-占10.81%)。IRI后CD45+细胞比例明显增加(术后1天时13.88%),Ly6C和CD11c标记的4组细胞比例几乎均显著升高,1~2天时达峰,7天时恢复正常水平;在CD45+细胞中,CD11c和Ly6C双标记的细胞亚群分析提示Ly6C+CD11c+双阳性细胞升高最为明显,相对比例在对照组为6.87%,术后2天时升至峰值32.7%,术后2天时和4天的相对比例亦均较对照组小鼠显著升高,其他各细胞亚群的相对比例未见升高;由于该组细胞急剧升高,Ly6C+、CD11c+单阳性细胞的相对比例有下降,各组的相对比例在7天时恢复至对照组水平。CD11c+Ly6C+双阳性细胞的急剧变化也是本研究的重要发现。
既往研究发现,成年小鼠心脏消化后经流式细胞检测约56%为心肌细胞,27%为成纤维细胞,10%为血管平滑肌细胞,7%为内皮细胞,而免疫炎症细胞比例极低[8]。心肌缺血等损伤后白细胞向局部聚集浸润,数量明显增多。在本实验中小鼠心脏缺血再灌注模型的心肌CD45阳性细胞计数在1天时达到高峰,达到对照组10余倍,之后减少,7天时恢复正常;在这一过程中CD11c+DC在心肌中也明显增加,CD11c+Ly6C+细胞亚群在术后2天时达到峰值,提示DC在早期即参与IRI相关的免疫炎症反应。既往小鼠心梗模型的心肌免疫荧光染色提示CD11c+DC在心梗后3天时增多,7天时达到高峰[9],较此次IRI模型中的达峰时间明显延迟,考虑与不同的动物模型有关(心梗与缺血再灌注);病理研究提示DC主要聚集在梗死心肌及梗死边缘,非梗死区域的心肌DC并无增加[5,9],心梗和IRI模型的心肌改变均为局灶性,既往心梗动物模型的DC分布规律可供参考,本实验中未包括病理学研究。由于病理学研究易受取材误差干扰,且无法选择多种抗体标记,故本研究选择将小鼠的完整心脏消化后获得单个细胞悬液行流式细胞检测,可以更为精确地对目的细胞亚群进行区分及定量研究。
缺血损伤相关的免疫炎症反应中DC的来源、标记、功能仍存在争议。心肌DC的来源可能为自外周迁移或细胞间相互转换。动物实验中经嵌合体方法发现心梗后心肌CD11c+DC主要为自外周血迁移,去除DC导致心梗后28天小鼠的心功能下降,伴有白细胞、巨噬细胞、单核细胞的浸润增多,促炎因子分泌增多,提示DC对心梗后炎症反应、心肌重构具有保护作用[9]。小鼠脑IRI模型中发现24 h时缺血坏死脑组织边缘的DC增多,主要为组织内固有的DC[10]。小鼠肾脏IRI模型研究则发现DC的促炎功能,证实同时表达巨噬细胞标记F4/80的DC是早期分泌TNF-α的主要来源[11]。我们的研究提示IRI相关炎症发生后CD11c阳性细胞增多,细胞表面标记发生急剧变化;对照组小鼠心脏CD11c+Ly6C-较CD11c+Ly6C+细胞多,前者是后者的3~4倍,IRI后24 h比例发生逆转,同时表达单核细胞标记Ly6C的DC (CD11c+Ly6C+)明显增多,是前者的2~3倍,除了外周血向心肌组织的迁移,重叠的细胞表面标记也提示可能存在细胞间相互转变。在感染或炎症性疾病的动物实验中发现,局部浸润的单核细胞可转化为炎症性DC,表面标记为MHCⅡ+CD11b+CD11c+F4/80+Ly6C+,它同时与炎症部位聚集的其他细胞,如巨噬细胞、单核细胞及其他种类的DC,存在表面标记的部分重叠。炎症性DC可大量合成TNFα和iNOS参与炎症反应[12-13]。本研究结果显示CD11c+Ly6C+在IRI相关炎症时明显增多,相对比例最高,流式细胞检测图(图2)提示细胞亚群之间相互延续,DC与Ly6C标记的单核细胞关系密切,故除了自外周迁移,细胞转换也是可信的来源之一。虽然实验中没有进行全面的细胞表面标记研究,但CD11c+Ly6C+这样的标记组合也指向炎症性DC。
本研究明确了CD11c+DC在小鼠心脏IRI模型中的动态变化,同时研究了单核细胞表面标记Ly6C,结果提示CD11c+Ly6C+DC在早期即明显增多,提示可能存在DC与单核细胞的转化,DC参与IRI免疫炎症的机制和功能还需要进一步的研究。
