恶性周围神经鞘膜瘤伴有原始神经外胚层样分化:1例报道及文献复习
2018-08-08杜尊国张海涛戚向群
杜尊国 张海涛 戚向群 熊 佶 汪 寅 唐 峰
(1复旦大学附属华山医院病理科 上海 200040 ; 2云南省丘北县人民医院外科 丘北 663200;3上海市浦南医院口腔科 上海 200125)
恶性周围神经鞘膜瘤(malignant peripheral nerve sheath tumor,MPNST)是一种起自周围神经,或先前存在的神经鞘膜肿瘤,显示神经鞘膜成分分化的梭形细胞肉瘤。曾被称为恶性神经鞘瘤或施万细胞瘤、神经纤维肉瘤及神经源性肉瘤,临床少见,约占全身软组织肉瘤的5%,且超过50%伴有神经纤维瘤病1型(neurafibromatosis 1,NF1)[1-2]。MPNST组织成分复杂多变,部分病例可见异源性成分,如横纹肌、骨、软骨和腺体等常有报道[1,3]。而呈现原始神经外胚层样小圆细胞分化的病例报道极为罕见,在此我们报道1例发生于NF1患者颌面部的MPNST伴有原始神经外胚层样成分分化病例。
临床资料转诊病例,患者男性,37岁,发现右侧耳前颌面深部肿块9年,逐渐增大,约5 cm,1年前出现口角下斜等面神经压迫症状,稍有肿胀感,张口适中;体格检查发现肿块质硬,边界清,活动度尚可,口腔黏膜未见异常,颈部、躯干及四肢弥漫多发性皮肤结节,大小不一,皮肤表面散在咖啡色斑(图1A),额骨部宽大,颈部及颌下未触及肿大淋巴结。曾于3年前外院行小腿皮肤肿块切除术,术后诊断神经纤维瘤。辅助检查B超显示腮腺区深部低回声占位,血供丰富,边界清;MRI检查显示腮腺深部巨大占位,T1WI等信号(图1B),T2WI高信号,增强后不均匀强化。术中见肿块附着于面神经,与周围少许粘连,保留面神经情况下肿块完整切除。患者拒绝进一步分子检测。术后4个月,恢复良好,右腮腺区B超示术后改变。
方法手术切除标本经4%中性甲醛溶液固定,石蜡包埋,常规切片与HE染色;免疫组化采用SP法染色,一抗包括AE1/AE3、EMA、Vimentin、S100、SOX-10、CD99、CD34、STAT-6、GFAP、Chromogranin-A (CgA)、Synapsin(Syn)、Desmin、α-actin、Neuron-specific enolase(NSE)、FLI-1、INI-1和Ki67,DAB显色,镜下观察。
结果巨检显示灰白淡黄肿块6 cm×3.5 cm×3 cm,有包膜,切面有光泽,质中,局灶区鱼肉状及出血。
镜检显示梭形细胞肉瘤样改变,细胞束状排列,细胞密度从中等到丰富不均一;中等密度区,瘤细胞呈席纹状排列,胞质丰富(图1C);细胞丰富区,似纤维肉瘤样改变,瘤细胞密集呈鱼骨状排列(图1D),淡染区与深染区交错模糊可见。瘤细胞胞质嗜酸性,界限不清,核呈不对称锥杆状,“弹头样”,波浪感不明显,偶有弯曲,染色质颗粒状偏深染,核仁不明显,可见少量多形性改变,核分裂象极多见(>20/10HPF)。可见瘤细胞围绕血管聚集,伴明显出血,类似血管内皮瘤样改变。少量肿瘤性成骨分化,类似骨肉瘤(图1E),横纹肌分化未见。局灶区见有片巢状小圆细胞聚集,胞质空泡化,核深染,圆或不规则(图1F、G),偶见一不典型菊形团样结构。片状肿瘤性坏死可见。
免疫组化显示,上皮标记AE1/AE3和EMA阴性,CgA、CD34、STAT-6、Desmin、α-actin和GFAP阴性,间叶标记Vimentin阳性,S100和SOX-10散在阳性,小圆细胞区NSE和FLI-1弥漫强阳性,Syn弱阳性(图1H),CD99胞质弱阳性(个别膜阳性,图1I),INI-1不缺失,Ki67增殖指数约15%~28%。病理诊断:MPNST(高级别)伴有原始神经外胚层样成分分化,合并NF1。
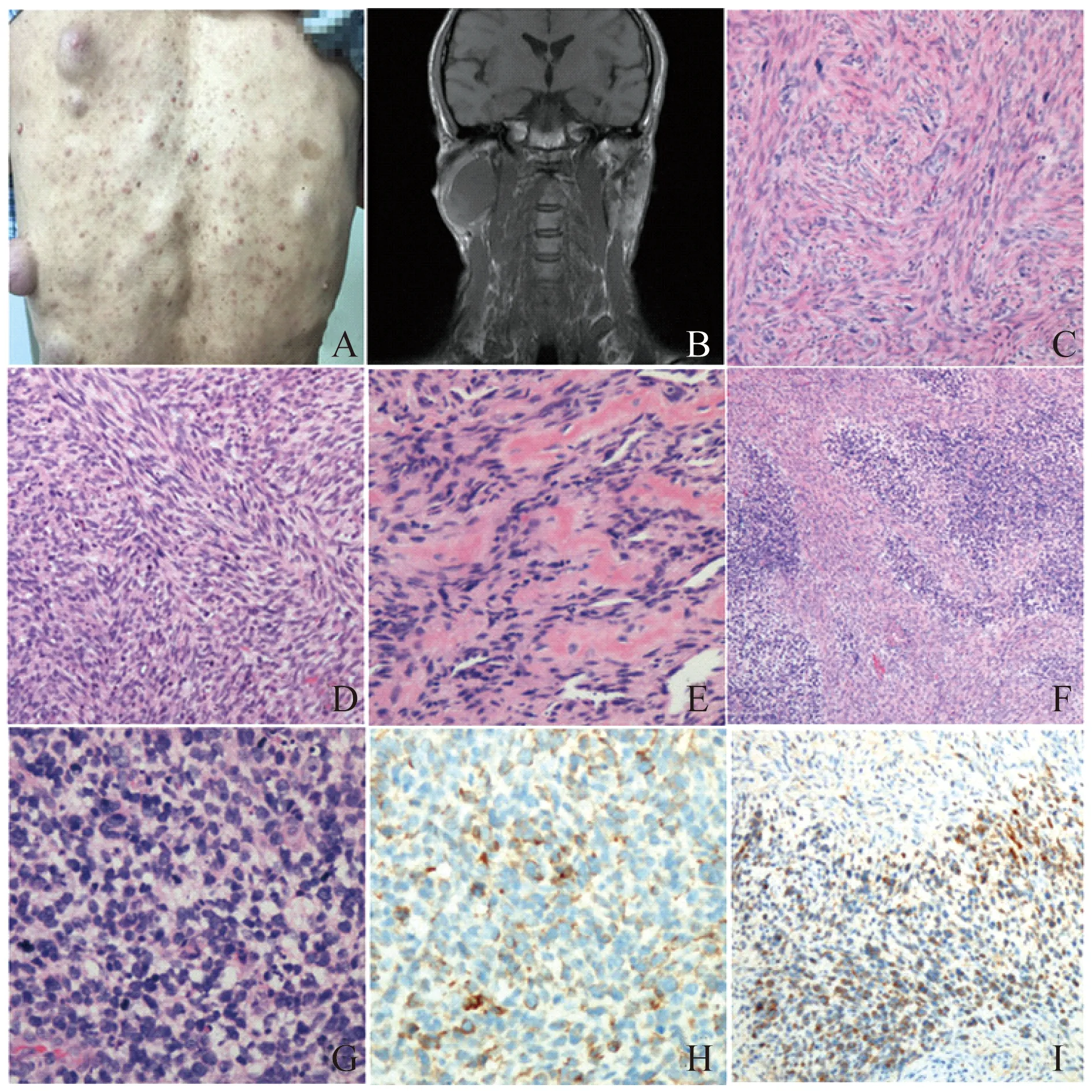
A:Multiplecutanous neurofibromas and café-au-lait spots;B:MRI showing a mass in the right parotid gland.C:Spindle tumor cells arranged in fascicular pattern(HE,100×);D:Tumor cells arranged in herringbone pattern (HE,100×);E:Osteosarcoma-like area (HE,200×);F:Small round cells area (HE,100×);G:Small round cells showing round and dark nuclei and vacuolar cytoplasm (HE,400×);H:Immunostaining of Syn (400×);I:Immunostaining of CD99 (200×).
图1临床与病理学改变
Fig1Theclinicalandpathologicalchanges
讨论NF1是一种常染色体显性遗传病,是由于17号染色体长臂(17q11.2)NF-1基因突变和缺失导致功能丢失而引起[2-3]。MPNST具有高度异质性,与普通神经鞘瘤及神经纤维瘤相似性很少,甚至完全不同[1,4]。超过50%的MPNST病例发生于NF1,近10%可能与放疗有关,剩余者多为散发病例,以20~50岁成年人为主,四肢、颈部和躯干多见,而发生于口腔颌面部者少见[1-4]。组织学上MPNST常见有异源性分化,如肌源性、骨或软骨源性以及腺上皮性等[1,4],但原始神经外胚层样小圆细胞分化者却极为罕见,文献上仅有数十余例报道,以儿童病例为多,成人少见,绝大多数为男性患者,且往往不伴有NF1病史[5-10],其病理学改变的独特性主要体现在其小圆细胞成分上(表1)。
MPNST具有复杂的形态与免疫表型,且与其他软组织良恶性肿瘤(包括黑色素瘤)具有组织学相似性,缺乏特异性诊断标准,因此病理诊断极其困难。组织学上束状分布的梭形细胞,细胞密集区与水肿或黏液变的稀疏区交错,围绕血管密集排列,锥杆或纺锤形的弯曲核,少许细胞多形性,明显的核分裂象,结合临床有否NF1病史,与神经等的解剖关系,提示神经鞘膜分化的免疫表型,绝大多数可以明确诊断[1,3-4]。本例病变具有上述特点,形态学诊断基本符合MPNST,包括其小灶性的异源性骨肉瘤成分。梭形细胞肉瘤改变,是普通型MPNST最常见的组织学改变,但其多样的形态变异亚型亦可见,如上皮样型、色素性型、腺样型、恶性蝾螈瘤等[1,3-4]。因此,许多肿瘤必须纳入其组织学鉴别诊断之中,主要包括良性神经鞘膜肿瘤(如富于细胞的神经鞘瘤和非典型性神经纤维瘤)、滑膜肉瘤、孤立性纤维性肿瘤、纤维肉瘤、胃肠间质瘤、梭形细胞黑色素瘤以及其他梭形细胞肉瘤等。
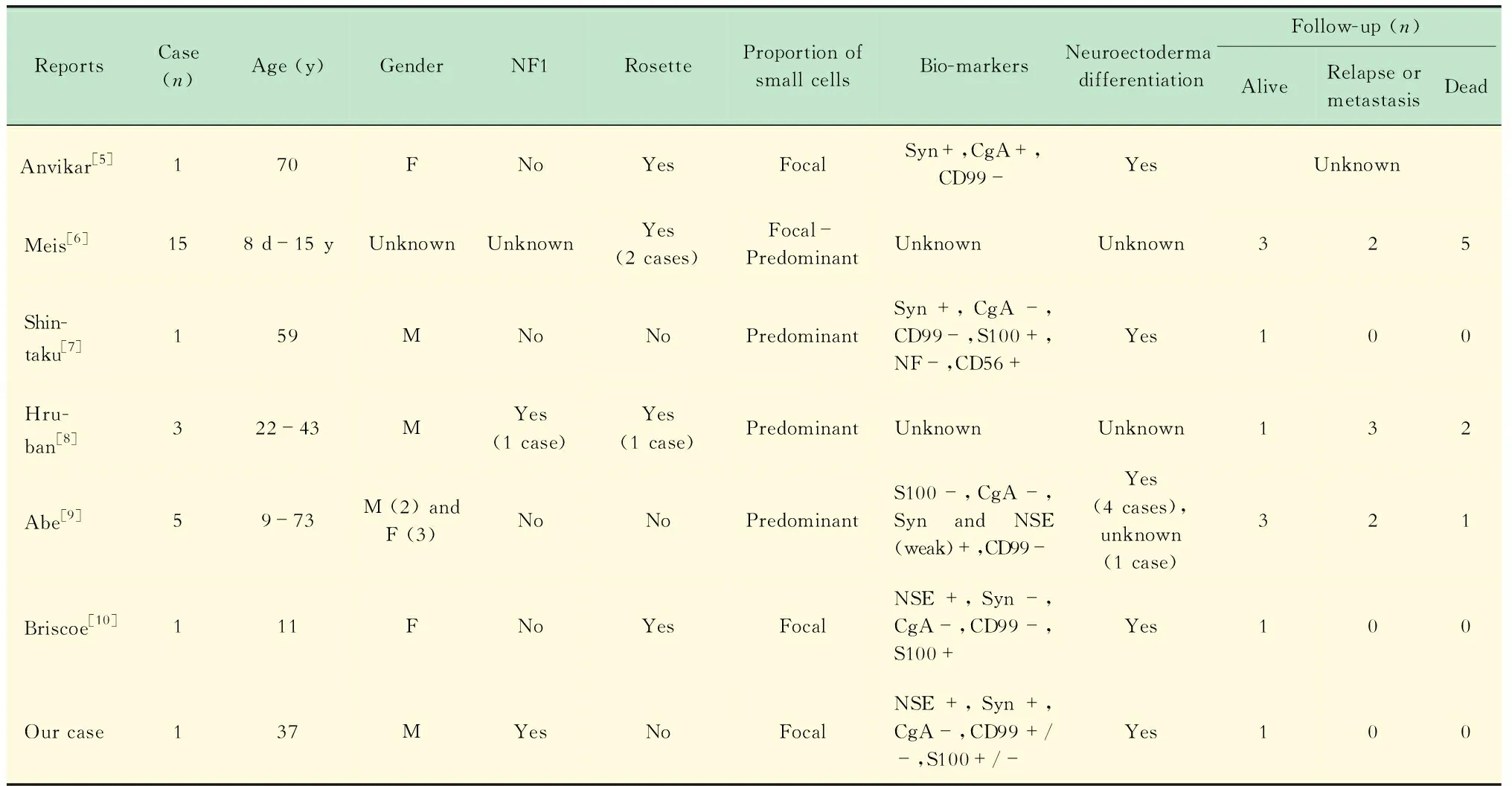
表1 已报道伴有PNET样分化的MPNST病例的临床病理学特点Tab 1 The clinicopathological characteristics of the cases reported as MPNST with PNET-like differentiation
MPNST的异质性同样表现在免疫表型上,缺乏具有诊断特异性的免疫标记物。不足50%的病例不同程度表达S100,常为散在局灶阳性,若弥漫着色要考虑其他肿瘤,但上皮型MPNST往往弥漫阳性[1,4]。Leu-7、PGP9.5和髓磷脂碱性蛋白可信性不足,SOX1-10阳性率多在30%~50%,稳定性优于S100,GFAP阳性率偏低(20%~30%)[4,11-13]。本例病变S100和SOX-10均显示散在阳性,具有一定提示意义。SOX-2的表达情况报道不一(46%~83%),但其鉴别诊断价值尚不明确[11]。p75NTR(p75神经营养因子受体)敏感性高,78%~83%的阳性率,但特异性不高(部分滑膜肉瘤及Ewing肉瘤也阳性)[11]。巢蛋白Nestin在48%的MPNST中表达,特异性较高[13]。近来研究发现,MPNST常伴CDKN2A基因变异导致核心蛋白复合体PRC2的失活,下游组蛋白H3K27me3表达丢失,利用免疫组化法检测,多达41%~68%呈现完全或部分丢失,而良性神经源性肿瘤几乎不丢失,二者鉴别具有很大意义,但H3K27me3的丢失在其他软组织肿瘤中也有报道[11,14]。上皮标记CK和EMA很少表达,但在上皮样和腺样MPNST中可见[1,4]。超过50%上皮样MPNST病例存在INI-1的缺失表达[1]。本例病变中未发现上皮标记的阳性表达和INI-1的缺失。MPNST中的异源性成分可有其对应标记物的表达,如横纹肌肉瘤成分者可表达肌源性标记物。
肿瘤性原始神经外胚叶成分,常见于原始神经外胚层肿瘤PNET/Ewing肉瘤家族,神经母细胞瘤和胚胎性中枢神经上皮肿瘤等,临床上均罕见,且多见于年轻及幼年患者[3-4]。形态变化多样,共同组织学特点是未分化的小蓝圆细胞,排列呈分叶状、片状、或弥漫性等,胞质少到中等、透亮或轻度嗜酸性,核圆或卵圆、少许不规则,染色质深染,少数情况下可见菊形团样结构。PNET家族常见特异性的染色体22q12区上EWS基因的易位重排,绝大多数表达CD99(MIC-2基因产物),以膜型表达具有指示意义,FLI-1常显示弥漫性核强阳性,但特异性不高[3-4]。此外对神经上皮标记NSE、PGP9.5、Leu-7、Syn和CgA表达不恒定,多为弱阳性或灶性表达[3-4]。本例小圆细胞成分呈现类似特点,FLI-1显示强阳性,NSE和Syn阳性,但CD99仅显示灶性的膜表达,一定程度上呈现原始神经上皮分化。MPNST含有PNET样小圆细胞成分者极罕见,其中以儿童及男性病例为多,小圆细胞成分表达一种或以上神经上皮标记物,如NSE、Syn和Chromogranin-A等,但CD99往往阴性(表1)[5-10]。Abe等[9]研究未发现异常EWS基因表达,但形态上此类PNET样病灶常存在梭形细胞成分。因此从形态及免疫表型的角度看,仅能笼统地称之为原始神经外胚层样分化(表1),不能等同于软组织或骨PNET/Ewing肉瘤家族,同时尚缺乏超微结构、免疫学及遗传学证据。在认识肿瘤本源时,区分是MPNST含有PNET成分,还是PNET伴有梭形成分类似MPNST非常重要,尤其是小块活检组织代表性不足时,往往造成诊断的纰漏,另外还体现在二者迥异的治疗上,PNET家族对化疗高度敏感,而MPNST则不然,手术切除依然是主要治疗手段,放疗有一定效果。MPNST中出现PNET样分化,依然是肿瘤异质性的重要体现。
原始神经外胚层分化在子宫肿瘤、卵巢恶性混合性苗勒氏管肿瘤和胶质母细胞瘤中亦有报道,且在内膜样腺癌和浆液性子宫内膜腺癌提示高侵袭性行为[5]。MPNST的预后结局主要是复发转移或死亡,含有PNET样成分者依然如此(表1),未发现此类成分在儿童患者中明确的预后指示意义,但在成人中尚不明确[5]。本例病变手术切除后4个月,未予其他治疗,尚未发现复发与转移。
总之,MPNST常发生于NF1患者,异质性明显,组织学改变与免疫表型复杂,罕见情况下可见原始神经外胚层样小圆细胞分化,此类成分的生物学本性尚不明确,仍需积累资料进一步研究。
