二甲双胍调控miRNAs抑制恶性肿瘤机制研究进展
2018-08-08刘萤照
刘萤照,冯 雁,王 琪
(广西医科大学附属肿瘤医院 实验研究部, 广西 南宁 530021)
微小RNA(miRNAs)是一类广泛存在于真核生物中长约22个核苷酸的非编码小分子单链RNA,在进化过程中高度保守,是许多生命活动如增殖、迁移、分化、凋亡和血管生成等的关键调节因子[1],同时还参与调控多种肿瘤的发生和发展。
二甲双胍是目前治疗2型糖尿病的首选一线用药,是最有效和最安全的药物之一。流行病学研究发现二甲双胍能减少多种恶性肿瘤发生率[2],动物学实验也证明二甲双胍对多种恶性肿瘤有明确的抑制作用。近年的研究发现二甲双胍可能通过多种机制抑制肿瘤细胞生长,包括激活AMP活化蛋白激酶(AMPK)通路、抑制线粒体呼吸链复合物Ⅰ(complex Ⅰ)、
活化促凋亡蛋白Bcl-2 相关蛋白促使肿瘤细胞凋亡、导致细胞周期停滞、选择性杀灭卵巢癌干细胞等。但目前对二甲双胍抗癌的机制未有定论,这也成为临床肿瘤治疗中应用二甲双胍的主要制约因素。生物信息学研究发现二甲双胍可改变多个miRNA的表达[3],同时,大量体内外实验研究也支持二甲双胍具有同时调控多种miRNA,抑制肿瘤细胞的增殖、迁移侵袭、上皮间质转化和促进凋亡等生物学功能。虽然参与肿瘤调控的miRNAs数量庞大,但研究发现单一miRNA就能对肿瘤的发生发展产生决定性影响[4]。深入研究二甲双胍调控的关键miRNAs,可以顺藤摸瓜发现更多影响因子、关键节点和重要靶点,进而研发肿瘤防治的新药物和新方案,为最终降伏恶性肿瘤提供一个明确的方向。本文将就近年来二甲双胍调控关键miRNAs抑制多种恶性肿瘤的研究进展进行综述。
1 二甲双胍引致肿瘤相关miRNAs改变
二甲双胍可引起肿瘤中多个miRNA发生明显改变,并产生明确的生物学功效。二甲双胍能抑制胰腺癌细胞系Panc1、PK1、PK9和鼠移植瘤的生长。miRNA芯片对比结果表明在1 212个被测miRNA中,癌细胞的129个miRNA和癌组织的186个miRNA表现出有统计学差异的变化[5]。miRNA芯片分析胆管癌鼠移植瘤组织发现,在985个被检测的miRNA中,二甲双胍可引起46个miRNA的表达显著改变[6]。对前列腺癌细胞系PC3的研究表明,二甲双胍显著改变了22个miRNA的表达水平,其中miR-146a、miR-100、miR-425、miR-193a-3p和miR-106b可能较有深入研究的意义[7]。
本课题组前期研究发现二甲双胍增敏卵巢癌铂类化疗。二甲双胍联合顺铂、卡铂或奈达铂用药均明显比单药更有效抑制肿瘤细胞体外增殖。二甲双胍和奈达铂联合用药比单药化疗裸鼠肿瘤体积减少30%。RT-qPCR检测肿瘤细胞miRNAs水平,发现二甲双胍联合化疗促进miR-33b、miR-186、miR-206和miR-503升高,而miR-129和miR-214显著下调。
2 二甲双胍调控miRNAs抑制恶性肿瘤机制
近年来,对二甲双胍抑制肿瘤的机制研究已取得诸多进展,发现了一些起关键作用的miRNA及其相关作用机制。我们将这些关键miRNA及已探明的部分路径进行了总结归纳(图1)。
2.1 抑制肿瘤细胞增殖
细胞周期蛋白是一类通过调控细胞周期控制细胞增殖的蛋白家族,其异常表达与肿瘤的发生发展密切相关。对胆管癌的研究发现,二甲双胍的抗增殖作用主要通过改变6个miRNA的表达实现。这6个miRNA均参与调控细胞周期关键蛋白的表达,其中:miR124调控CDK2、CDK4、Cyclin D1和Cyclin E1;miR182和miR27b调控CDK2、Cyclin D1;miR-let7b调控Cyclin D1;而miR221和miR181a均参与调控P27蛋白[8]。二甲双胍通过调控这些miRNA,抑制或促进相应靶蛋白的表达,致使肿瘤细胞周期停滞,抑制了肿瘤细胞的增殖。在胰腺癌细胞系PANC-1中,二甲双胍下调miR-221的表达,使CDK抑制因子p27蛋白表达增加,迫使胰腺癌细胞的增殖停滞在G1期[9]。
二甲双胍调控的关键miRNAs也能通过其他通路抑制细胞增殖。乳腺癌细胞系、鼠移植瘤和乳腺癌患者血清样本中,均可检测到二甲双胍引起miR-21-5p表达降低,其靶蛋白CAB39L、SESN1的表达量增多,从而抑制了乳腺癌细胞克隆形成和迁移[10]。二甲双胍增加miR-200c的表达,抑制靶基因AKT的表达,抑制了乳腺癌细胞增殖[11]。二甲双胍还可通过调控miR-199a-5p抑制靶基因ERBB2和IKBKB,调控miR-152-3p抑制靶基因TGFα,抑制了胰腺癌细胞的增殖。最近对子宫内膜癌的研究首次发现二甲双胍通过调控miRNAs改变DNA甲基化来影响细胞增殖。二甲双胍通过AMPK通路上调miR-let7的表达,下调H19蛋白,使DNA甲基化失调,从而抑制了肿瘤细胞增殖[12]。
2.2 促进肿瘤细胞凋亡
凋亡是由特定基因控制的程序性细胞死亡,是生命的基本特征之一。凋亡异常直接影响肿瘤的发生发展。miRNAs可通过调控细胞凋亡相关基因和蛋白产物的表达参与凋亡过程。乳腺癌细胞系中,二甲双胍通过上调miR-193b的表达量,从而使FASN表达量下降,导致乳腺癌细胞凋亡[13];通过抑制miR-27a的表达,减弱miR-27a对AMPKα2的抑制作用,从而导致caspase3表达增加,增加了癌细胞的凋亡[14]。细胞凋亡过程中,Bcl-2(B-cell lymphoma gene 2)家族起着至关重要的作用。二甲双胍增加miR-200c的表达,抑制抑凋亡因子Bcl-2和AKT的表达,促进了肿瘤细胞凋亡[11]。对胰腺癌和口腔癌细胞系的研究发现,二甲双胍能上调抑癌因子miR-26a,导致致癌基因HMGA1[15]和Bcl-2抑凋亡家族重要成员MCL-1[16]的表达量减少,增加了癌细胞的凋亡。
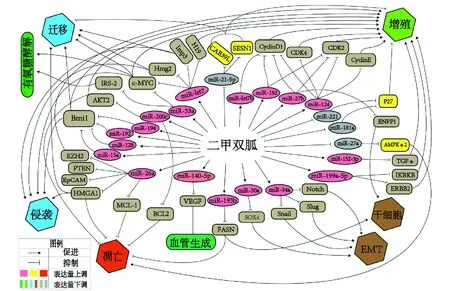
图1 二甲双胍调控miRNAs抑制恶性肿瘤机制示意图Fig 1 Mechanism of metformin regulating miRNAs to suppress malignant tumors
2.3 抑制肿瘤迁移侵袭
肿瘤细胞迁移和侵袭是影响恶性肿瘤患者预后的重要因素,受到多种基因的调控。对卵巢癌细胞系A2780、Tara R127的研究表明,二甲双胍能下调H19,上调miR-let7,启动H19/miR-let7轴,抑制靶基因Hmga2、c-Myc和Imp3,抑制肿瘤形成并减弱癌细胞迁移和侵袭的能力[17]。二甲双胍处理的A549肺癌细胞系和SGC 7901胃癌细胞系中,miR-15a、miR-128、miR-192和miR-194表达量上调,引起它们的靶蛋白Bmi-1表达量下降,使肿瘤细胞的增殖、迁移和侵袭能力减弱[18]。胰腺癌细胞系中,二甲双胍上调miR-26a,导致致癌基因HMGA1表达量减少,从而抑制了肿瘤细胞的侵袭和迁移[15]。
2.4 抑制干细胞增殖和上皮间质转化
肿瘤干细胞是肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞,与恶性肿瘤复发、耐药等生物学过程密切相关。在乳腺癌细胞系中,二甲双胍能上调miR-193b的表达量。miR-193b能直接结合FASN的3′UTR,使FASN表达量下降,抑制了乳腺癌微球体的形成[13]。体内外实验研究还发现,二甲双胍能上调miR-27b的表达从而抑制ENPP1基因的表达,降低SP细胞比例,抑制乳腺癌干细胞的增殖[19]。
上皮间质转化(epithelial-mesenchymal transition, EMT)指上皮细胞失去其形态和功能,逐渐转化为间质样细胞的过程,与肿瘤复发和转移密切相关。对胰腺癌的研究发现二甲双胍能增加miR-34a的表达,引起其靶蛋白Notch、Slug和Snail的表达量降低,从而抑制胰腺癌细胞EMT[20]。SOX4是一种致癌因子,在恶性肿瘤中高度表达,是EMT的主要调节因子之一。二甲双胍能显著增加前列腺癌细胞中抑癌因子miR-30a的表达量,下调其目的致癌因子SOX4的表达,抑制肿瘤细胞EMT[21]。
2.5 抑制肿瘤血管形成
肿瘤血管形成是指肿瘤细胞诱导的微血管形成及肿瘤中血液循环建立的过程。肿瘤的生长依赖肿瘤新生血管的形成,血管内皮生长因子(VEGF)是目前已知作用最强的血管新生促进因子。对胰腺癌细胞系的研究发现,二甲双胍上调miR-140-5p,使其目的基因VEGF表达量降低,从而抑制肿瘤血管生成[22]。
2.6 抑制有氧糖酵解
肿瘤细胞无论环境有氧无氧都主要依赖糖酵解方式进行代谢,消耗大量葡萄糖并伴有乳酸的产生。有氧糖酵解是肿瘤细胞供能的重要途径。IRS-2是有氧糖酵解的关键调节蛋白。乳腺癌细胞系中,二甲双胍能上调miR-33a,引起靶基因c-MYC和IRS-2的表达量下调,抑制了癌细胞的有氧糖酵解[23]。
3 二甲双胍调控miRNAs抑制肿瘤机制存在个体差异
有报道二甲双胍调控miRNA抑制肿瘤作用在某些细胞表现不明显,例如二甲双胍能通过上调野生型P53细胞中miR-34a的表达,抑制致癌基因Sirt1以抑制肿瘤,但这种作用在P53缺失细胞中却并不明显[24]。提示二甲双胍调控miRNA的抑瘤作用可能对不同类型的肿瘤存在差异性。也有个别研究者报告了二甲双胍功效相反的结论。因此,对这些个案仍有待进一步深入研究。
4 前景展望
目前miRNAs已经在肿瘤的早期检测、预后判断、治疗等方面显示出巨大潜力。许多miRNA如miRNA21、miRNA182和miRNA145等可能可作为新的肿瘤标记物,用于评价病情进展,预测治疗效果。miRNAs 的靶向药物也是当前研究热点,促进肿瘤的miRNAs可以被单链miRNAs或者带有互补序列的核苷酸所抑制,抑制肿瘤的miRNAs可用作治疗性miRNAs的模版,但面临着肿瘤渗透、有效剂量、肝脏毒性等问题[25]。肿瘤相关miRNAs靶向药物研究已有部分进入临床试验或在动物实验上取得进展,有望给肿瘤治疗再添新力。
进一步筛选二甲双胍调控的关键miRNAs,有助于发现预测二甲双胍抗肿瘤的分子标记,明确哪些高危人群可以最大可能地从二甲双胍治疗中获益。而深入研究二甲双胍调控这些miRNA的完整机制,将为恶性肿瘤的防治开拓又一新的路径,为防癌治癌新方案、新药的研发提供更多新的靶点和思路。
