分析反应“进程” 正确解决问题
2018-08-06江苏李万春
江苏 李万春
化学反应是一个动态的变化过程,随着反应的进行,反应的条件(如浓度、温度等)会发生变化,导致生成的产物、反应速率等随之变化,这类问题可统称为化学反应的“进程”问题。分析化学反应的“进程”,可以更深入地理解化学反应的本质。有关化学反应“进程”的试题能很好地考查宏微结合、变化观念、证据推理和实验探究等化学核心素养,是指导学生复习中需要重点关注的题型。
一、影响化学反应“进程”的常见原因
1.物质的性质
当一种物质与多种可与之反应的物质相遇时,发生化学反应的先后顺序是由这几种物质的酸性、碱性、氧化性、还原性等相对强弱决定的。在其他条件相差不大的情况下,反应按先强后弱的顺序进行。
(1)以酚酞试液为指示剂,用NaOH溶液滴定盐酸,OH-先和盐酸(强酸)反应,基本完成后再与酚酞(弱酸)反应。


(4)往FeBr2溶液中通入Cl2,Cl2先将Fe2+氧化为Fe3+,反应完成后Cl2再将Br-氧化为Br2,因为还原性:Fe2+>Br-。
(5)向含Fe3+、Cu2+的溶液中加入过量还原性铁粉,Fe先与Fe3+反应,然后再与Cu2+反应,因为氧化性:Fe3+>Cu2+。
(6)用Zn、Cu合金作电解装置中的阳极,Zn先被氧化成Zn2+进入溶液,最后Cu才被氧化,因为还原性:Zn>Cu。
2.反应物的浓度
随着化学反应的进行,反应物的浓度减小,生成物的浓度增大,溶液的酸碱性也可能发生变化,导致生成的产物或反应的“进程”发生改变。
(1)浓硫酸具有强氧化性,其氧化性是由硫酸分子中处于最高价态的+6价的硫元素产生的,加热时能氧化许多物质,浓硫酸的还原产物一般为SO2。稀硫酸溶液中不存在H2SO4分子,溶液中的H+有弱氧化性,只能和较活泼的金属发生置换反应,稀硫酸的还原产物为H2。
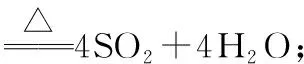
(3)盐酸中的H+具有弱氧化性,Cl-具有还原性,其还原性的强弱与盐酸浓度有关。实验室制备Cl2时MnO2为氧化剂将浓盐酸中的Cl-氧化为Cl2。该实验成败的关键在于盐酸的浓度,当HCl浓度小于一定值时,反应不能发生,故实验中必须选用浓盐酸。


3.反应体系的温度
很多化学反应的“进程”都与温度有关,温度不同,即使其他条件完全相同,反应的产物、反应速率或反应进行的程度也有所不同。
(1)在低温下,Na在空气中被O2氧化为Na2O;在加热时,被氧化为Na2O2。
(2)P2O5与冷水反应生成HPO3,与热水反应生成H3PO4。
(3)Cl2与NaOH溶液在低温下反应生成NaClO,在温度较高时反应生成NaClO3。
(4)NaCl晶体与浓硫酸在微热或不加热时反应生成NaHSO4和HCl,在较高温度时反应生成Na2SO4和HCl。
(5)在浓硫酸的作用下,C2H5OH在140℃时发生分子间脱水(取代反应)反应生成乙醚(CH3CH2OCH2CH3),在170℃时发生分子内脱水(消去反应)反应生成乙烯。
(6)Fe、Al在冷的浓硫酸或浓硝酸中发生钝化,加热时反应放出气体。
(7)化学反应中放出的热量会加快化学反应速率,如Mg与盐酸的反应呈现慢、快、慢的变化趋势,因为该反应是放热反应,开始时,温度较低,反应速率较慢,一段时间后,温度升高大于盐酸浓度减小对反应速率的影响,所以反应速率加快,随着反应继续进行,盐酸浓度降低为主要因素,反应速率随之减慢。
(8)化学反应中总是伴随着能量的变化,对于密闭、绝热容器中进行的可逆反应,反应中的热量变化对化学平衡势必会产生影响。
4.反应物的相对用量
两种反应物之间发生化学反应,当其中一种反应物可与生成物继续反应时,则两反应物相对量的多少会影响反应的“进程”。
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如将CO2通入NaOH溶液中:


(2)多元弱酸(或其酸酐)与更弱酸的盐溶液反应。如将CO2通入NaAlO2溶液中:


(3)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸反应:
(4)铝盐溶液与强碱溶液的反应:

(5)NaAlO2溶液与强酸溶液的反应:
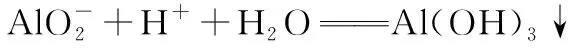
(6)Fe与稀HNO3溶液的反应:

(7)H2S与O2反应:


(8)磷与Cl2反应:
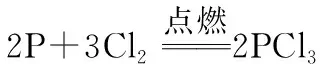

(9)Cl2与NH3反应:


(10)AgNO3溶液与氨水反应:

因为很多离子反应与反应物的量有关,导致反应物的混合方式不同时反应的“进程”不同。例如,将NaOH溶液逐滴加入到AlCl3溶液中直至过量,开始即产生沉淀,沉淀达最大值后又开始减少,直到沉淀完全溶解;而将AlCl3溶液加到NaOH溶液中至过量时,开始无明显现象,接着产生沉淀至最大量。因此,一些溶液可以利用试剂滴加的顺序进行鉴别。
二、考查化学反应“进程”的热点题型
1.原理分析型
例1.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘:


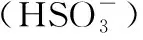

2.图象分析型

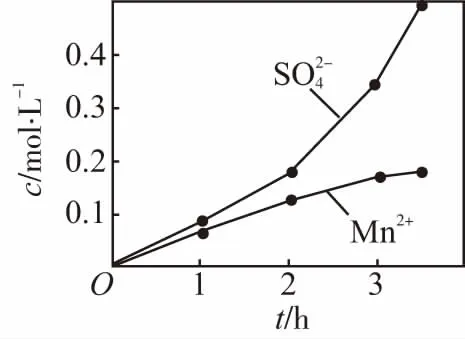
答案:Mn2+作O2与H2SO3反应的催化剂,生成H2SO4
3.实验探究型

解析:如果是NaOH溶液过浓导致红色消失,则可使NaOH溶液浓度降低而使溶液恢复红色;若是红颜色的物质被H2O2氧化生成了无色物质,则即使NaOH溶液浓度降低,溶液红色也不可恢复,据此可设计实验。
答案:向上述褪色后的溶液中逐滴滴入盐酸(或加水),如果红色恢复,则证明是NaOH溶液浓度过高造成的,甲同学的解释正确;如果溶液不再变红,则是由于反应过程中生成H2O2的强氧化作用所致,乙同学的解释正确。