2018年高考模拟试题
2018-08-06河南
河南 杨 超
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Cl—35.5 V—51 Fe—56 Cu—64
第Ⅰ卷(选择题共42分)
一、选择题(本题共7小题,每小题6分,共42分。每小题只有一个选项符合题意)
7.根据所给的信息和标志,判断下列解读正确的是( )

ABCD信息或标志《本草纲目》:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”。《本草衍义》中述:“嘉州峨眉山有燕萨石,形六棱而锐首,色莹白明澈。”可燃冰绿色食品标志解读利用KNO3的氧化性“燕萨石”指的是石灰石“可燃冰”是可以燃烧的水“绿色食品”是指绿色的食品
命题思路:该题目体现高考命题热点,弘扬传统文化,展现现代科技。
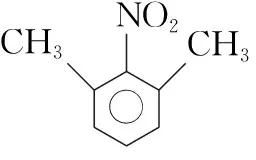
8.化学与生产、生活和科技密切相关。下列叙述正确的是( )
A.用于3D打印材料的光敏树脂是纯净物
B.14C可用于文物年代的鉴定,14C与12C互为同分异构体
C.用废轮胎、废电缆打碎制成的塑胶跑道,可以提高原子利用率
D.以“地沟油”为原料生产的生物柴油和以“石油”为原料生产的柴油化学成分不同
命题思路:化学与STSE是高考必考试题,考生应重视化学在科学、技术、社会中所产生的重要影响。
9.芳香酸X和芳香醇Y相对分子质量均为122,X与Y一定条件下发生酯化反应生成的酯有( )
A.3种 B.4种 C.5种 D.6种
命题思路:考查有机物的分类及同分异构体相关知识。
10.实验室欲制取适量NO2气体,图中最适合完成该实验的简易装置是( )

命题思路:该题目源于2011年全国高考试卷中一道非选择题,当年高考考的是制备NO,将实验装置挖出来考查制备NO2,题目比较有新意。
11.设NA为阿伏加德罗常数的值。下列叙述不正确的是( )
A.一定条件下,28 g N2与6 g H2反应,转移的电子数小于6NA
B.标准状况下,0.56 L一氯甲烷中含有共价键的数目为0.1NA
C.5.6 g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA
D.常温常压下,6.4 g氧气和臭氧的混合物中含有的原子总数为0.4NA
命题思路:常规题,从电子转移、原子数目、化学键数目入手,且注意了物质的状态等。
12.a、b、c、d、e五种短周期元素在元素周期表中有如图所示位置关系,且a、e的原子序数之和等于c的原子序数,则下列说法正确的是( )

A.原子半径的大小关系:d>c>b
B.a、b、c、d四种元素中非金属性最强的为d
C.氧化物对应水化物的酸性:d>c>b
D.a、b、c、d四种元素的单质都存在同素异形体
命题思路:元素推断为近年来高考必考试题,从原子序数之间的关系入手,结合位置关系确定元素种类,考查了元素周期表与元素周期律的相关知识。
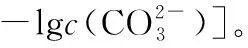

A.常温下,NiCO3的溶解度大于NiS的溶解度
B.对于曲线I,在b点加热,b点向c点移动
D.向d点对应的溶液中加入对应的阴离子的钠盐,由d点向b点移动
命题思路:高考选择题中往往第12、13题是区分度较高的试题,该题引入新的概念考查学生的迁移能力和运用化学知识识别图象的能力。
第Ⅱ卷(非选择题共58分)
二、必考题(本题共3小题,共43分)
26.(14分)某化学小组拟探究Pb(NO3)2受热分解的产物。

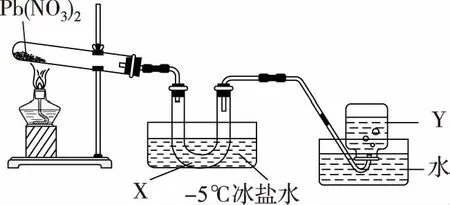
(1)Pb(NO3)2受热分解生成PbO、NO2和Y。写出硝酸铅分解的化学方程式:____________。
(2)从平衡移动原理角度解释X的主要成分是N2O4:__________。
(3)实验完毕,向U形管加入足量氢氧化钠溶液吸收NO2和N2O4,产物为两种盐。写出N2O4与氢氧化钠溶液反应的离子方程式:__________。
实验Ⅱ:探究PbO和木炭反应的氧化产物。已知:PdCl2溶液吸收CO生成黑色固体Pd和CO2。选择下列装置设计实验:

(4)气流从左至右,选择装置排序为B→____________(填代号)。
(5)点燃酒精灯之前,先通入一段时间N2,其目的是___________________。D装置作用是___________________。
(6)经检验B中产生的气体摩尔质量为32 g·mol-1。写出B中发生反应的化学方程式:____________________。
命题思路:该题目以硝酸盐的分解探究为基础,考查化学实验知识。涉及仪器的连接、实验现象的描述与分析、简单的化学计算,题目设置贴近高考。
27.(14分)C、N、S对应的化合物,是重要的化学物质,试回答下列问题:
(1)已知:氢气的燃烧热为286.0 kJ·mol-1,氨气的燃烧热为382.5 kJ·mol-1,则合成氨反应的热化学方程式为__________。
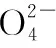

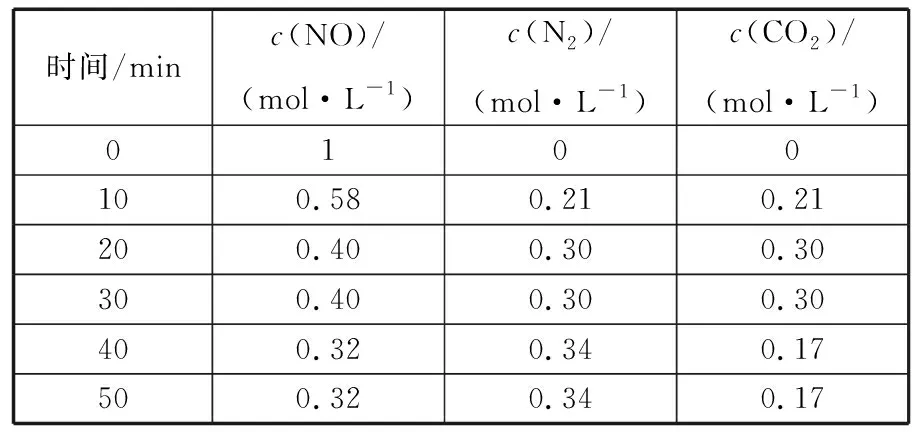
时间/minc(NO)/(mol·L-1)c(N2)/(mol·L-1)c(CO2)/(mol·L-1)0100100.580.210.21200.400.300.30300.400.300.30400.320.340.17500.320.340.17
①10~20 min时间内以CO2表示平均反应速率为_______________。
②根据表中数据,计算T℃时该反应的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率__________(填“增大”“不变”或“减小”)。
④该反应达到平衡时下列说法正确的是__________(填序号)。
a.容器内压强保持不变
b.v(NO)=2v(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤30 min时改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是____________。请在图中画出30~40 min的变化曲线。

命题思路:该题目在平衡标志方面做了小改动,改为平衡时,考查考生细心程度;新概念Kp考查考生的迁移能力;图象的绘制紧跟2018年高考《考试说明》,考生要有绘制简单图象和图形的能力。
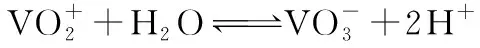
28.(15分)钒电池是一种新型酸性硫酸盐二次电池,工作原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。


(1)钒电池放电时的反应原理是___________________(用离子方程式表示)。
(2)充电过程中,若转移0.5 mol电子,质子交换膜左侧电解质溶液体系中n(H+)的变化量为__________mol。
(3)钒电池失效后,废电解液回收利用的一种工艺如下:

b.部分含钒物质在水中的溶解性见下表:

物质VOSO4NH4VO3(VO2)2SO4溶解性可溶难溶易溶

②浓缩工序中,加入NaOH的作用是__________。
③沉钒工序的化学方程式为__________。
④煅烧偏钒酸铵时,固体(取234 g NH4VO3)质量的减少量随温度变化的曲线如图所示,100~200℃时,产生的一种气体的电子式为__________,300~350℃时发生反应的化学方程式为_______________________。
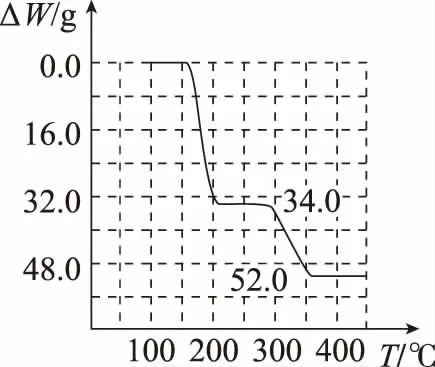
命题思路:工艺流程题考查内容丰富,一般以化学反应原理为主,该题前一部分嫁接了四川高考题中的全钒液电池工作原理,且考查了离子经过膜的细节;后一部分紧随高考热点考查热重曲线的图象分析,一般情况下含结晶水的化合物最先失水得到盐,继续升温得到金属氧化物,温度过高金属氧化物失氧或得氧质量减轻或增大。
三、选做题(本题共2小题,每小题15分,考生只能选做一题,多答则按所答的第一题计分)
35.【物质结构与性质】(15分)化学材料发展迅速,前途广阔。回答下列问题:
Ⅰ.Ⅱ~ⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。
(1)基态硒(Se)原子的电子排布式为[Ar]__________。
(2)在周期表中,Se与As、Br周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______________。

Ⅱ.甲醇燃料电池(DMFC)具有洁净环保、结构简单、低温快速启动等优点,DMFC阳极普遍采用以铂(Pt)为基础的二元催化剂,如Pt-Cr合金等。
(4)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________(填元素符号)。
(5)金属铂堆积方式如图所示,若铂原子的半径为rpm,铂的摩尔质量为Mg·mol-1,铂晶体的密度为ρ g·cm-3,则阿伏加德罗常数NA为__________(用相关字母列出计算式即可)。
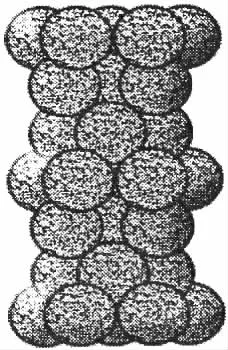
(6)二元催化剂Pt-Cr的某种合金化学式可表示为PtCr3,在该催化剂的晶胞结构中1个Pt原子近邻的Cr原子有______________个。
命题思路:物质结构模块考查知识一般较为全面,8~10个空。其中粒子堆积方式的分析是难点,往往以密度、空间利用率、阿伏加德罗常数的相关计算为依托,考查空间结构的掌握情况。
36.【有机化学基础】(15分)扑热息敏是最常用的非抗炎解热镇痛药,合成扑热息敏(D)及其衍生物(H)的流程如下:
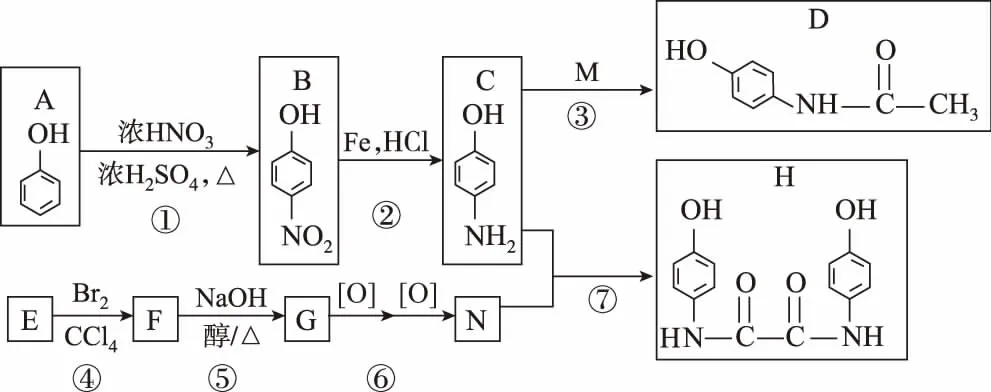
已知:E为环状烃,相对分子质量为54。
(1)反应①~⑦中属于取代反应的是__________。
(2)G的官能团的结构简式为__________。
(3)写出下列反应的化学方程式:⑤__________;⑦__________。
(4)满足下列条件的扑热息敏(D)的同分异构体有_______________种,其中核磁共振氢谱图中含有三组峰的结构简式为__________。
①属于芳香族化合物 ②含有硝基
(5)某同学改进了反应①,过程如下:
K的结构简式为__________,条件X为__________,改进后的优点是______________________。
(6)试写出用乙烯和必要的无机试剂合成N物质的合成路线:_________________。
命题思路:有机化学基础的命题,通常从命名、官能团的确定、方程式的书写、有机信息的应用、同分异构体的确定、有机合成路线的设计等方面入手。其中信息的应用、同分异构体的确定、合成路线设计是难点。该题目(5)为引入硝基时用到混酸,混酸具有强氧化性要设计保护酚羟基这一步。
答案与解析
7.【答案】A
【解析】A项火药爆炸时有氮气生成,氮元素的化合价由+5价降低到0价,利用KNO3的氧化性,A项正确;B项由“六棱而锐首,色莹白明澈”,确定其不是石灰石,“燕萨石”指的是二氧化硅,B项错误;C项为甲烷的结晶水合物,C项错误;D项“绿色食品”是指无公害的食品,D项错误。
8.【答案】D
【解析】A项树脂属于高分子化合物,因每个分子的聚合度不一定相同,打印材料的光敏树脂属于混合物,A项错误;B项二者互为同位素,B项错误;C项该过程为物理过程,原子利用率是指化学变化中产物与原料之间的关系,C项错误;D项生物柴油属于酯类,以“石油”为原料生产的柴油属于烃类,D项正确。
9.【答案】C
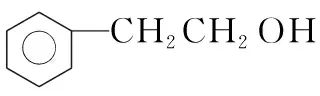
10.【答案】C
【解析】由于NO2密度大于空气,应用向上排空气法,所以A错误。B装置没有安全装置、D装置中的防倒吸装置错误。C项中,1为气体发生装置,2为向上排空气法的装置,3为防倒吸装置,4为尾气吸收装置,C项正确。
11.【答案】C
【解析】A项合成氨反应为可逆反应,转移的电子数小于6NA,A项正确;B项标况下0.56 L一氯甲烷的物质的量为0.025 mol,共价键数目为0.1NA,B项正确;C项铁与硝酸反应可能生成Fe2+、Fe3+,转移的电子数应该在 0.2NA~0.3NA之间,C项错误;D项6.4 g氧原子的物质的量为0.4 mol,D项正确。
12.【答案】B
【解析】由位置关系和原子序数关系,确定a、b、c、d、e五种元素分别为C、P、S、Cl、Ne。同周期从左至右原子半径依次减小,A项错误;C、P、S、Cl四种元素中氯元素的非金属性最强,B项正确;C项没有指出最高价,C项错误;C、P、S、Cl四种元素中,氯元素的单质无同素异形体,D项错误。
13.【答案】B




(4)D→C→D→A(或D→C→A)
(5)排尽装置内空气,避免空气干扰对氧化产物的检验
检验CO2
【解析】(1)硝酸铅分解反应符合氧化还原反应规律,铅元素化合价不变,氮元素化合价降低,则氧元素化合价升高,故Y为O2。(2)NO2转化成N2O4的反应是放热反应,降温,有利于生成无色的N2O4。(3)氧化还原反应中元素化合价有升必有降,所以两种盐为硝酸盐和亚硝酸盐。(4)依题意,先检验CO2,因为检验CO时生成CO2。装置连接顺序为炭还原氧化铅、检验CO2、除去CO2、确认CO2已除尽、检验CO。(5)通入N2的目的是排尽装置内空气,避免O2与炭或CO发生反应。D装置中的澄清石灰水用来检验CO2。(6)依据题意B中产生的气体摩尔质量为 32 g·mol-1,则产生CO、CO2的体积比为3∶1,然后根据CO、CO2的物质的量之比写出对应反应的化学方程式。

(3)①0.009 mol·L-1·min-1
②0.56
③不变
④abcd

⑤减小CO2的浓度
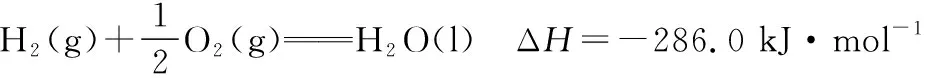

(2)0.5
(3)①2 1 1 H2O 2 1 2 H+NaClO易变质(或等质量的NaClO在反应过程中转移的电子数少等,合理即给分)



35.【答案】(1)3d104s24p4
(2)Br>As>Se>Te
(3)H2O2分子间存在氢键 sp3杂化 三角锥形
(4)K、Cu
(6)12

36.【答案】(1)①③⑦



【解析】由题推断可知E为相对分子质量为54的环状烃,所以E为环丁烯,F为,G为,N为乙二酸。(1)七个反应分别为取代、还原、取代、加成、消去、氧化、取代。(2)G为,其官能团为碳碳双键,结构简式为。(3)反应⑤为+2NaBr+2H2O,反应⑦为满足两个条件的D的同分异构体苯环上连有两个甲基、一个硝基结构有6种,含有一个甲基、一个 —CH2NO2结构有3种,共计9种。其中、核磁共振氢谱中有三组峰。(5)K的结构可以联系前后物质得出,为,条件X是为了发生硝化反应,一般用浓硝酸和浓硫酸加热条件下进行。碘甲烷、浓HI溶液主要起到了保护酚羟基的作用。(6)乙烯制乙二酸可以设计路线为