结直肠癌组织中IGFBP-3、u-PA蛋白的表达变化及其意义
2018-08-03孙立园赵杨刘莎莎薛晶王瑞婷申兴斌
孙立园,赵杨,刘莎莎,薛晶,王瑞婷,申兴斌
(1承德医学院附属医院,河北承德067000;2承德医学院)
结直肠癌是常见的消化道恶性肿瘤之一,近年来我国结直肠癌发病率呈逐渐增高趋势[1~4]。众所周知,胰岛素样生长因子家族(IGFs)与多种恶性肿瘤的发生相关,其通过与相应受体结合发挥作用,可通过激活信号传导通路及调节通路相关细胞因子水平,促进细胞的有丝分裂和分化。胰岛素样生长因子结合蛋白3(IGFBP-3)是分泌蛋白家族中的一员,是IGFs的主要调节蛋白,在促进肿瘤形成的过程中发挥不可或缺的作用。IGFBP-3在组织中分布广泛,通过调节IGFs的生物活性,促进或抑制细胞的增殖、分化及凋亡。尿激酶型纤溶酶原激活剂(u-PA)家族可降解细胞外基质中的各种成分,从而使基质、基底膜黏附性降低,有利于肿瘤细胞的浸润、生长和转移行为。目前关于IGFBP-3、u-PA与结直肠癌发生及进展的关系研究尚少。为此,本研究观察了结直肠癌组织中IGFBP-3、u-PA的表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 2016年1~12月在承德医学院附属医院接受手术治疗的结直肠癌患者70例,男31例、女39例,年龄28~81岁,均为首发病例,患者在术前均未接受过放疗、化疗及免疫治疗,排除糖尿病、慢性肾脏病史、糖皮质激素用药史;术中留取结直肠癌组织标本70例份。另取结直肠癌术后距癌组织约5 cm的正常结直肠黏膜组织标本20例份做对照,标本来源患者男12例、女8例,年龄35~72岁。两组标本来源患者的基本资料具有可比性。
1.2 IGFBP-3、u-PA蛋白检测 采用免疫组化Max Vision法,所取标本经4%甲醛固定后,常规脱水、透明、浸蜡、包埋,对组织蜡块进行连续切片,切片厚度为4 μm。脱蜡至水,用3%的过氧化氢溶液在37 ℃中孵育30 min后,将0.01 mol/L枸橼酸钠溶液(pH 6.0)煮沸,将处理好的切片放入,热修复12 min,室温冷却后清洗。滴加山羊血清封闭30 min后倒去,勿洗,滴加一抗工作液(IGFBP-3浓度为1∶100;u-PA浓度为1∶2500),放入4 ℃冰箱过夜。第二天滴加二抗及辣根过氧化物酶后进行DAB显色。最后经苏木素复染,透明、封片、镜下观察。兔抗人IGFBP-3抗体购自武汉博士德生物工程有限公司。兔抗人u-PA抗体购自巴傲得生物科技有限公司。即用型羊抗兔Max Vision试剂盒、即用型DAB显色试剂盒均购自北京中衫金桥生物技术有限公司。IGFBP-3、u-PA阳性产物均为棕黄色颗粒状,位于细胞质和细胞膜。每个切片于高倍镜(400×)下选择10个细胞染色集中且均匀的区域(热点区),计数阳性细胞,以阳性细胞百分比≥25%判定为目的蛋白表达阳性。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验,相关性分析采用Spearman相关分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌组织及正常结直肠黏膜组织中IGFBP-3、u-PA蛋白表达比较 IGFBP-3阳性表达位于细胞膜和细胞质,呈棕黄色颗粒。结直肠癌组织、正常结直肠黏膜组织中IGFBP-3阳性表达率分别为21.43%(15/70)、80.00%(18/20)。u-PA阳性表达于细胞膜和细胞质中,染色颗粒粗大,呈棕黄色。结直肠癌组织、正常结直肠黏膜组织中u-PA阳性表达率分别为65.71%(46/70)、15.00%(3/20)。结直肠癌组织中IGFBP-3阳性表达率低于NM组织,u-PA阳性表达率高于正常结直肠黏膜组织(P均<0.05)。
2.2 IGFBP-3、u-PA表达与结直肠癌临床病理参数的关系 IGFBP-3蛋白的表达与结直肠癌TNM分期、淋巴结转移有关(P均<0.05),u-PA蛋白的表达与结直肠癌TNM分期、浸泡深度、淋巴结转移有关(P均<0.05),详见表1。
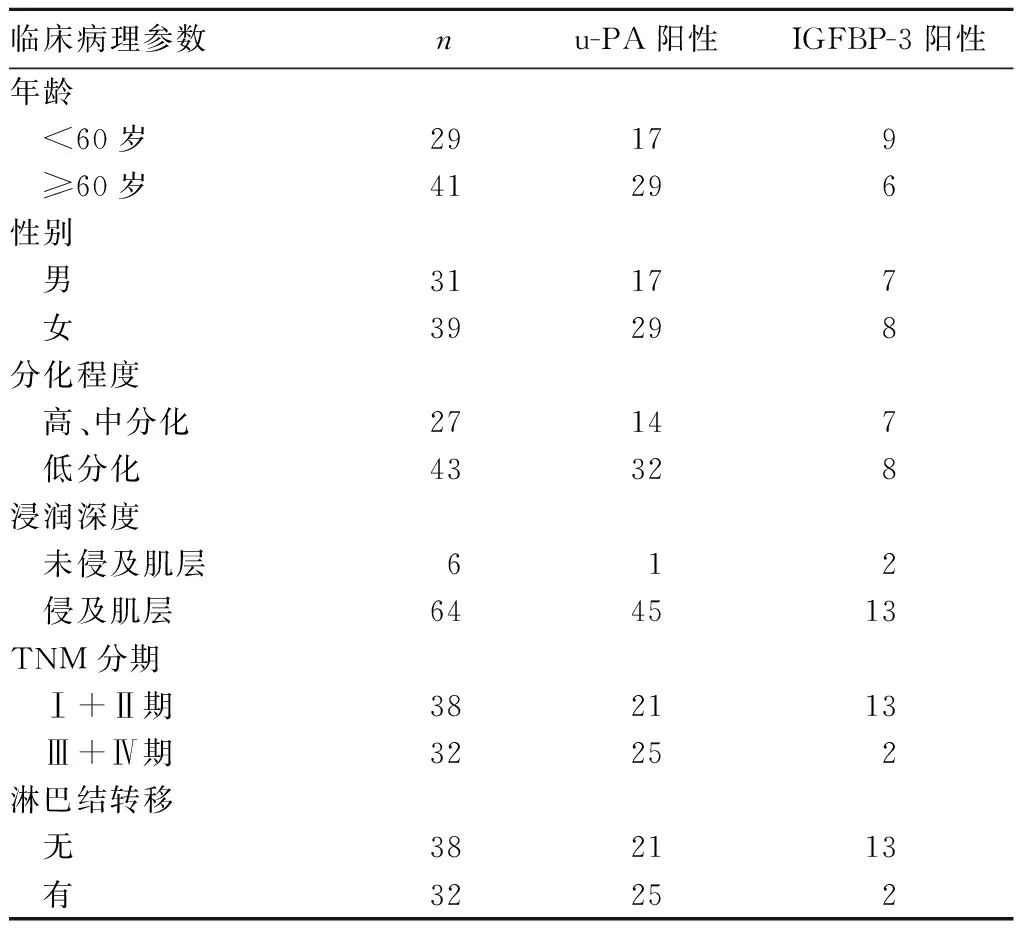
表1 IGFBP-3、u-PA蛋白表达与结直肠癌临床病理参数的关系(例)
2.3 结直肠癌组织中IGFBP-3、u-PA蛋白表达的相关性 u-PA与IGFBP-3在结直肠癌组织中的表达呈负相关关系(r=-0.447,P<0.05)。
3 讨论
目前对于恶性消化道肿瘤一般的治疗手段是手术,虽然各种化疗药物及放疗的应用已十分广泛,但是由于恶性肿瘤有着十分复杂的分子机制,这导致患者的生存率并没有提高,因此迫切需要学者寻找更多、更为合适的医学治疗手段。结直肠癌的发生发展过程中涉及多种因子、多个步骤。癌变过程中,包括癌基因的激活、抑癌基因的失活、错配修复基因的突变及基因过度表达等。虽然结直肠癌的治疗手段逐渐丰富,但肿瘤细胞的侵袭和转移仍严重影响着结直肠癌患者的治疗效果。研究[5~8]表明IGFs及u-PA家族与众多恶性肿瘤的发生发展、侵袭和转移相关。因此,研究结直肠癌的分子机制及发展规律,对于早期诊断、治疗乃至预后具有极其重要的意义。
有研究[9,10]发现,IGFs中与胰岛素原高度同源的两种多肽因子IGF-1和IGF-2除结构同源外其作用也类似,既可参与调节血糖的作用,还能调控多种细胞的增殖和分化。研究[8,9,11]显示,IGFs通过与其受体结合,激活细胞信号传导途径发挥作用,主要涉及的两个细胞信号传导途径包括丝裂原激活蛋白酶途径(MAPK)和磷脂酰肌醇3激酶(PI3K)途径,两条信号途径既可促进细胞的有丝分裂,促进肿瘤细胞生长、增殖,亦能抑制肿瘤细胞的凋亡,被公认与多种恶性肿瘤的发生密切相关。IGFBP-3是分泌蛋白家族中的一员,是IGFs的主要调节蛋白,在IGFs发挥促进肿瘤形成的过程中不可或缺。IGFBP-3在组织中分布广泛,通过调节IGFs的生物活性,促进或抑制细胞的增殖、分化及凋亡。IGFBP-3在多种肿瘤的发生进展中起到抑癌基因的作用。研究[12,13]发现,IGFBP-3是IGFBP家族成员中与IGF-1结合能力最强的因子,可竞争性与IGF-1结合,抑制IGF-1促进细胞有丝分裂、加快细胞增殖分化及抑制凋亡的作用,因此这种抑制肿瘤生长作用是间接的;另外,IGFBP-3还可不依赖于IGF-1信号传导途径,而直接发挥抑制肿瘤的作用[14]。本研究结果显示,IGFBP-3在结直肠癌组织中的阳性表达率低于正常结直肠黏膜组织,提示IGFBP-3表达下调与结直肠癌的发生发展有关。推测在癌变过程中,涉及到的信号通路中某些细胞因子通过降低IGFBP-3的表达,加快了肿瘤进展。我们进一步分析发现,在有淋巴结转移及TNM分期较高的结直肠癌组织中,IGFBP-3的表达下调,而在无淋巴结转移及TNM分期较低的结直肠癌组织中,IGFBP-3的表达上调,推测IGFBP-3参与了结直肠癌的转移过程,其低表达可加快肿瘤的侵袭和转移。
u-PA最早在卵巢肿瘤中发现,是一种高度特异性的丝氨酸蛋白酶,后经研究发现,它可以由多种细胞如单核细胞、中性粒细胞、肿瘤细胞等合成[15]。u-PA发挥作用前是以无活性或活性很低的纤溶酶原(Pro-uPA)形式存在;Pro-uPA与受体结合后形成复合物,经过复杂的转化,u-PA变为有活性的蛋白酶,从而发挥降解或重塑细胞外基质、介导细胞转移的作用。u-PA还可通过参与多种途径的信号转导来增强肿瘤细胞的侵袭。Malinowsky等[16,17]发现,u-PA在甲状腺癌、非小细胞肺癌及其他恶性肿瘤中的表达水平升高,可促进肿瘤细胞的侵袭、转移。郭颖等[18,19]发现,u-PA在肝癌、胃癌、卵巢癌等癌组织中的表达明显高于正常组织。有研究[20]发现,转移酶抑制剂法基尼通过诱导IGFBP-3的分泌降低了u-PA的分泌水平及活性;另外通过降低胰岛素样生长因子受体(IGF-R)及蛋白激酶B(Akt)的表达水平,有效抑制IGF-1信号通路的传导,从而抑制头颈部鳞癌的侵袭和转移。薛猛等[8]发现,HoxD10(同源盒基因)可直接结合到IGFBP-3的启动子区域,在转录水平激活IGFBP-3在胃癌细胞中的表达;且干扰胃癌细胞中IGFBP-3的表达后,u-PA mRNA表达水平升高,推测u-PA参与了IGFBP-3调节胃癌细胞迁移、侵袭的过程。本研究结果显示,结直肠癌组织中u-PA的阳性表达率高于正常结直肠黏膜组织;u-PA在侵及肌层、有淋巴结转移、高TNM分期的结直肠癌组织中的表达水平上调,推测其过表达加快了肿瘤的侵袭、转移过程。相关性分析结果显示,结直肠癌组织中IGFBP-3、u-PA表达呈负相关关系,推测二者共同参与了结直肠癌的发生及进展。因二者涉及到的调控网络中影响因子众多且关系错综复杂,具体的调节因子及机制还有待进一步研究。
